蛋白研究高分秘籍,内含各类蛋白纯化方案!
时间:2020-11-18 11:02:15 浏览次数:228
蛋白质是生命的物质基础,是构成细胞的基本物质,也是生命活动的主要承担者。作为生物研究员们,自然是离不开对于蛋白质的研究。如何才能更好的去研究蛋白的本质并且去发现生命的奥秘呢?蛋白纯化技术是必不可少的工具。
蛋白纯化在生物化学的研究应用中使用广泛,是一项重要的技术。为了更好地去研究一个蛋白的结构和功能,我们可以先把蛋白质从细胞中纯化出来,即为蛋白纯化。
蛋白纯化近几年在基础研究中大放光彩,无论是研究蛋白的性质,结构,通路,相互作用,在文章中加入蛋白纯化的内容不仅会使文章更加充实,而且也会更有说服力,是较快的提高文章分数的神器哦!
那蛋白纯化是不是很难做么?小编可以负责任的说:并不难。今天小编就通过两篇业界著名的蛋白基础研究杂志Protein Expression and Purification中的文章来带大家看一看蛋白纯化的奥秘!
文章一
High level expression, purification and characterization of active fusion human C1q and tumor necrosis factor related protein 2 (hCTRP2) in Escherichia coli
该文章主要内容是作者为了探究人CTRP2蛋白的生理作用和作用机制,在Escherichia coli中表达并纯化出了CTRP2蛋白。作者首先构建了CTRP2的质粒,在大肠杆菌中表达,并用GE的纯化柱对蛋白进行纯化,然后检测了hCTRP2的活性。这里小编主要对CTRP2蛋白的表达和纯化内容进行展开。
CTRP2蛋白的表达和纯化主要包括几个步骤:
1、CTRP2质粒的构建;
2、CTRP2蛋白的表达;
3、CTRP2蛋白的纯化
01
CTRP2质粒的构建
想要表达并纯化一个蛋白,通常构建该蛋白的质粒并在大肠杆菌中表达是较快得到大量蛋白的常规方法,并且在构建质粒的过程中可以让蛋白带上标签,之后利用标签蛋白的特异性进行亲和层析纯化。由于His标签分子量小,基本不改变蛋白的生物结构和理化性质,在变性的条件下也可以进行纯化,因此His标签是最常用的标签。
主要步骤
(1) 以全长的Human CTRP2 cDNA (NCBI accession NM_031908)为模板对Human CTRP2 cDNA进行PCR扩增。引物分别为:5’-GCGGATCCGACCCACTGCTTG-3’和5’-GCCTCGAGTACCTCGTTGGGGTC-3’。
(2) PCR产物使用BamHI 和XhoI内切酶进行酶切,然后插入pET32a (+)载体质粒的BamHI and XhoI位点中间。
(3) 重组质粒转入E.coli TOP10感受态细胞进行质粒扩增和鉴定,鉴定后的重组质粒转入E. coli strain BL21 (DE3)进行表达。
相关产品:

02
CTRP2蛋白的表达
质粒构建成功后,需要诱导CTRP2蛋白的表达。
主要步骤
(1) 包含pET/hCTRP2重组质粒的E. coli strain BL21 (DE3)菌株接种到5ml包含70 μg/ml ampicillin的LB培养基中,37℃,200rpm过夜培养。过夜的培养基接种到50ml包含70 μg/ml ampicillin(diluted 1:100)的LB培养基中,培养至OD600 =0.4–0.6。
(2) 这个时候需要加IPTG进行蛋白的诱导表达。作者进行了不同的IPTG的浓度和诱导时间的摸索,并进行了跑胶检测。
(3) 大肠杆菌菌体通过离心收集(16,000g for 3 min),细胞沉淀用裂解液进行悬浮(100 μl of 50 mM Tris–HCl buffer, pH 8.0, containing 200 mM NaCl, 2% Triton X-100 and 3 mM protease inhibitor PMSF),然后冰上超声20次(sonicated 3 s with 7 s intervals between each pulse)。
(4) 超声后的细胞进行离心(16,000g for 15 min at 4℃),取部分上清和6xloading buffer混合,在95℃加热5min。用12% SDS-PAGE进行跑胶并用考马斯亮蓝 R250进行染色。

图一:CTRP2蛋白诱导情况优化。图A:诱导浓度优化。IPTG的浓度分别为0,0.05,0.1,0.2,0.5,1.0 mM,诱导3h。图B:诱导时间优化。使用0.2mM IPTG分别诱导0,1,2,3,4和5h。M:蛋白Marker。SDS-PAGE跑胶并用考马斯亮蓝R250进行染色。
相关产品:

03
CTRP2蛋白的纯化
经过跑胶鉴定表明CTRP2蛋白在裂解液上清中,接下来要对蛋白进行纯化。
主要步骤
(1) 作者用1L的LB培养基进行CTRP2蛋白的诱导表达,步骤同上。细胞生长至OD600=0.4-0.6时,加入0.2 mM IPTG进行诱导表达37℃,5h。
(2) 大肠杆菌细胞通过离心收集(12,000g for 10 min at 4 ℃),细胞沉淀用50ml buffer A悬浮(50 mM Tris–HCl, 300 mM NaCl, 20 mM imidazole and 3 mM protease inhibitor PMSF, pH 8.0),然后在冰上进行超声(100次,5 s pulse with 5 s intervals between each pulse)。
(3) 30,000g for 30 min at 4℃进行离心,取上清用0.45μm滤膜过滤,然后用His标签预装柱(镍柱)进行纯化。
(4) 镍柱先用bufferA进行平衡,然后进行样品上样。
(5) 用结合缓冲液(50 mM Tris–HCl, 300 mM NaCl,50 mM imidazole and 3 mM PMSF, pH 8.0)洗去未结合的蛋白,然后用洗脱缓冲液(imidazole (150, 200, 250,300,500 mM) in 5 ml buffer C(50 mM Tris–HCl, pH 8.0, 300 mM NaCl, 3 mM PMSF))把CTRP2蛋白洗脱下来,咪唑浓度可以进行摸索以达到最高的纯度。
(6) 蛋白通过superdex 75 Increase凝胶过滤层析柱进行进一步纯化。
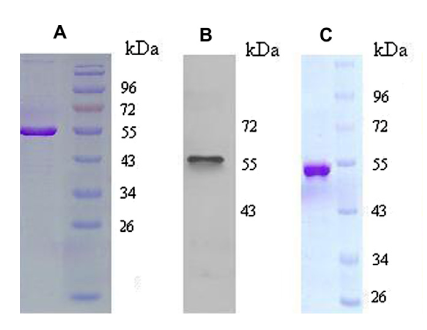
图二:hCTRP2蛋白的纯化。A:hCTRP2蛋白经过Ni柱纯化后,SDS-PAGE跑胶并用考马斯亮蓝R250进行染色。B:hCTRP2蛋白用His标签抗体进行WB检测。C:hCTRP2蛋白通过superdex 75 Increase柱纯化后,SDS-PAGE跑胶并用考马斯亮蓝R250进行染色。
相关产品:
文章二
Prokaryotic expression, refolding, and purification of fragment 450–650 of the spike protein of SARS-coronavirus
这篇文章主要内容是作者构建并表达了SARS冠状病毒Spike蛋白的450-650片段,然后用WB和ELISA检测该病毒片段具有较强的诱导免疫反应的活性。步骤也比较详细,这里小编主要对其中的包涵体变性和复性的内容进行展开。
包涵体是胞质内形成的高密度,不溶性的蛋白质颗粒。形成原因主要是蛋白表达量过高,没有足够的时间形成正确折叠的结构或者缺乏修饰等,是我们在进行蛋白体外转化和表达时经常会遇到的问题。处理方法主要是把不溶性的包涵体在体外变性再复性成具有正确构象的可溶形式,就可以成功获得有活性的目的蛋白。
01
SARS病毒的S蛋白的
S450-S640片段质粒构建和表达
主要步骤
(1)作者使用pET28a进行质粒构建,转化到Escherichia coli BL21 (DE3) cells中,在包含kanamycin (25g/ml)的1L的2YT培养基中37℃进行培养。
(2)当细胞密度达到OD600=0.8-1.0时,加入0.1mM IPTG进行诱导表达3.5h,37℃。
(3)细胞5000g,15min,4℃进行离心收集,用bufferA进行悬浮(20 mM Tris–HCl, 500 mM NaCl, 5 mM imidazole,5 mM β-mercaptoethanol, pH 7.9)。
(4)冰上超声(4s pulse, 4s pause, 200W for 50 times)。裂解后的细胞5000g,15min,4℃进行离心,用buffer B进行悬浮(Buffer A + 0.5% Triton X-100)。
02
包涵体溶解,复性和纯化
主要步骤
(1)包涵体用40ml buffer C进行溶解(Buffer A + 8 M urea),4℃过夜。16000g,30min离心,上清用0.45μm的滤膜过滤,上样Ni柱。
(2)用buffer C洗柱子,2ml/min。
(3)用buffer D进行复性(20 mM Tris–HCl, 500 mM NaCl, 5 mM imidazole,1 mM GSH, 0.1 mM GSSG, 20% glycerol, pH 7.9),拉尿素的线性梯度从8M-0M。
(4)柱子用buffer E进行清洗(20 mM Tris–HCl, 500 mM NaCl, 100 mM imidazole,20% glycerol, 5% glucose, pH 7.9)。
(5)用buffer F进行洗脱(20 mM Tris–HCl, 500 mM NaCl, 800 mM imidazole,20% glycerol, 5% glucose, pH 7.9)。
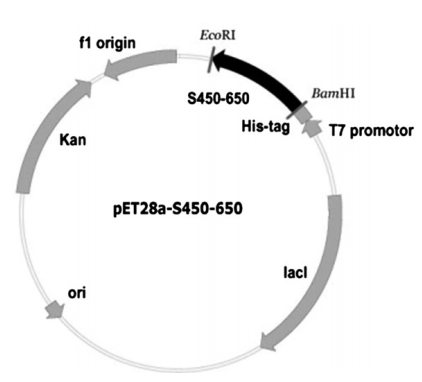
图三:重组的pET28a-S450-650。将SARS病毒的S蛋白的S450-S640 DNA片段插入到pET28a表达载体上。该载体具有T7启动子,His标签,酶切序列和抗卡那霉素序列。
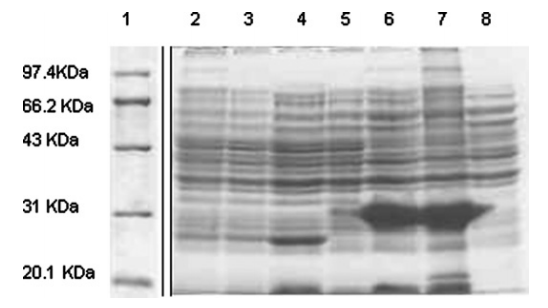
图四:蛋白表达跑胶检测。Lane 1:Marker;Lane 2:未转化重组质粒的E.coli BL21细胞裂解液;Lane 3:转化pET28a空载的BL21细胞裂解液;Lane 4:转化pET28a空载,IPTG诱导后的BL21细胞裂解液;Lane 5:转化pET28a-S450-S650重组质粒的BL21细胞裂解液;Lane 6:转化pET28a-S450-S650重组质粒,IPTG诱导的BL21细胞裂解液;Lane 7:IPTG诱导后的重组蛋白细胞裂解液沉淀;Lane 8:IPTG诱导后的重组蛋白细胞裂解液上清。
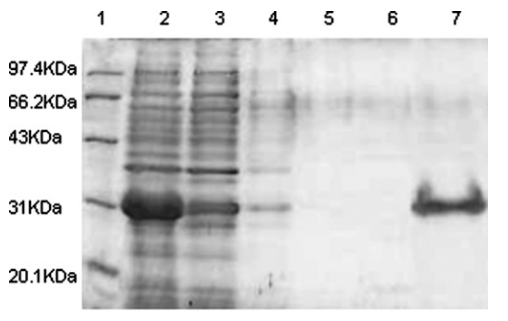
图五:S450-S650蛋白纯化。Lane 1:Marker;Lane 2:细胞裂解液;Lane 7:纯化后的蛋白。
相关产品:
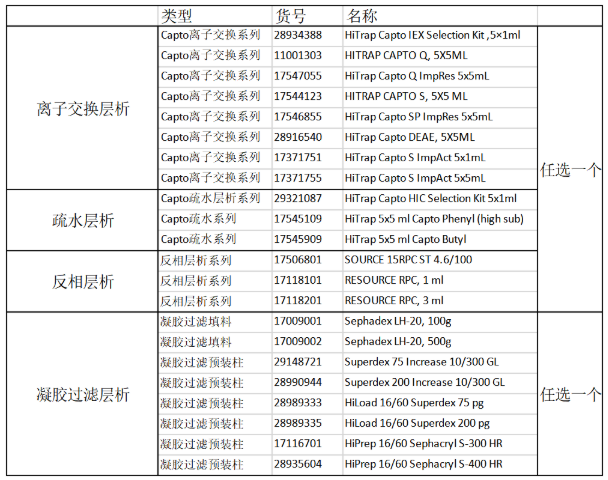
掌握了这么多蛋白纯化的技能之后,让我们来一起看一下蛋白纯化王牌Cytiva(原GE医疗生命科学)提供的解决方案吧,小优按照纯化样本的类型:标签蛋白、抗体、膜蛋白、多糖、天然蛋白、天然产物给您一一提供对应的纯化方案!
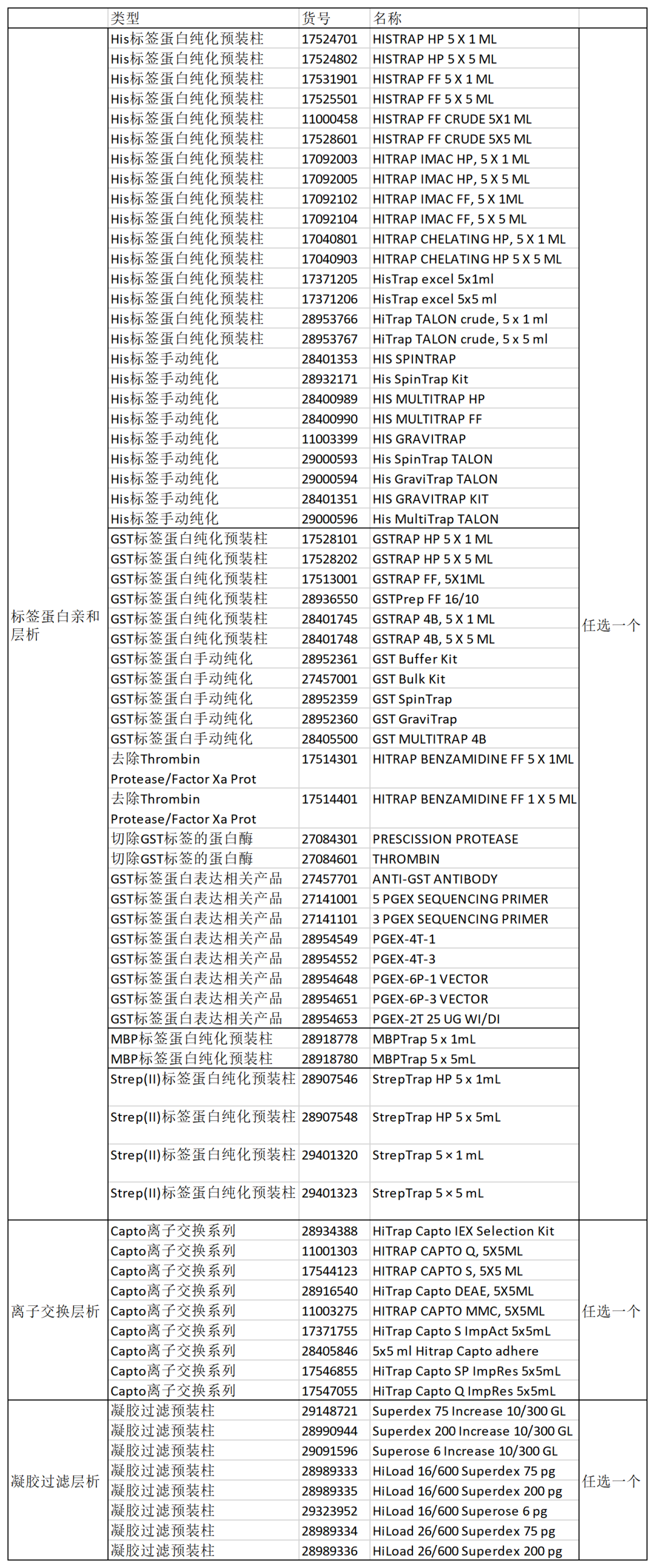
1、标签蛋白纯化
标签蛋白纯化一般选择用2步纯化的方法:标签蛋白亲和层析+分子筛,如果需要更高的蛋白纯度,可以在两步纯化中间再加一个离子交换层析。
向上滑动阅览
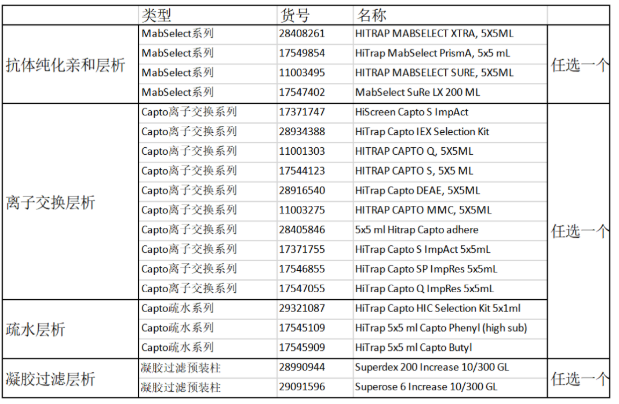
2、抗体纯化
抗体纯化建议您使用3步纯化的方法,第1步采用MABSELECT进行亲和层析,第2步和第3步使用离子交换/疏水层析和分子筛进行进一步的精细纯化。
3、膜蛋白纯化
膜蛋白纯化建议您使用2步纯化的方法,第1步使用标签蛋白亲和层析,第2步使用分子筛。

4、 多糖纯化
多糖纯化建议您第1步使用离子交换层析,第2步使用分子筛。

5、 天然蛋白纯化
天然蛋白纯化建议您第1步使用离子交换/疏水层析,第2步使用凝胶过滤层析。
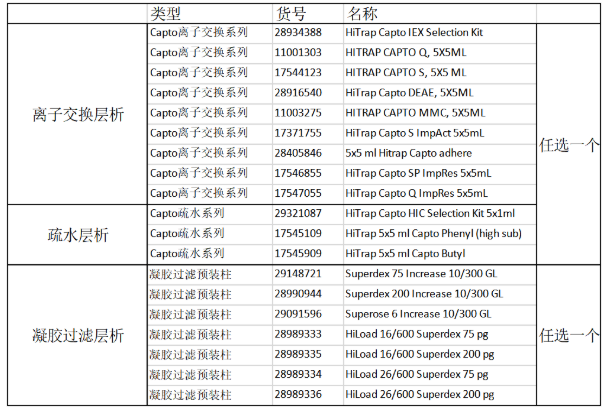
6、 天然产物纯化
天然产物纯化建议您第1步使用离子交换/疏水/反相层析,第2步使用凝胶过滤层析。
上海优宁维生物科技股份有限公司
试剂 | 耗材 | 仪器 | 软件 | 定制 | 实验服务 | 供应链
免费热线:4008-168-068
咨询邮箱:info@univ-bio.com
订购商城:www.univ-bio.com
微信公众平台:优宁维抗体专家,欢迎关注!
小优博士(小程序):5大课堂, 让你的科研不再难!









 危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)
危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)  营业执照(三证合一)
营业执照(三证合一)