关于流式数据分析,大家一直都想听,群众呼声也很高,但是一直苦于没有时间去做,最近正好有时间来做一些梳理,本期专门给大家讲讲我的流式数据分析和圈门的思路经验。
那么当我们在做完流式实验,拷贝到流式上机时的数据后,我们要怎么开始我们的流式数据分析工作呢?
首先,准备软件,本期所有的数据分析讲解都是基于BD flowjo这款数据分析软件,没有的老师可以参考往期内容去下载;
其次,将待分析的数据按照上机的panel进行分组整理,拖动到flowjo中,检查每个样本的上机补偿是否合适,如果不合适在flowjo或者其他软件(例如cytoflex的脱机软件)中微调到合适结果(关于如何调补偿,如果发现补偿不合适,请参考往期内容,这里不赘述)。
当一个补偿合适的结果放到我们面前时,我们接下来要做的就是去进行正式的数据分析了。
第一.明思路
数据分析前一定要明确自己的分析思路,我的思路一般是“两先两后”。
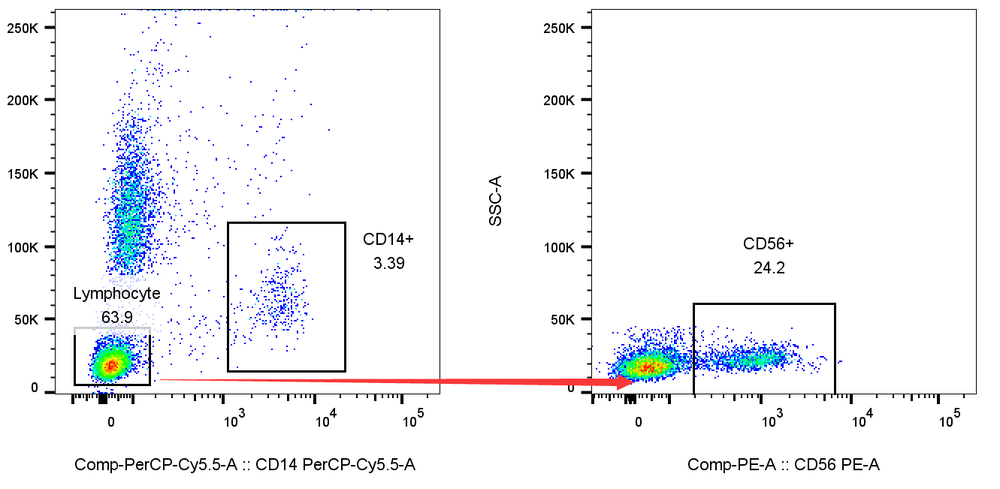
1. 先髓后淋:如果你的样本中包含多个细胞亚群,尤其是同时含有髓系和淋系细胞时,推荐先圈出髓系,后再髓系阴性中圈淋系,因为髓系表面的FC等受体,往往会非特异染色淋巴的抗体,先髓后淋可以获得更加准确的淋巴亚群结果。
例:先分析CD56后分析CD14,会导致CD56阳性偏高,CD14阳性偏低,而如果遵循先髓后淋的原则,结果则会更加准确: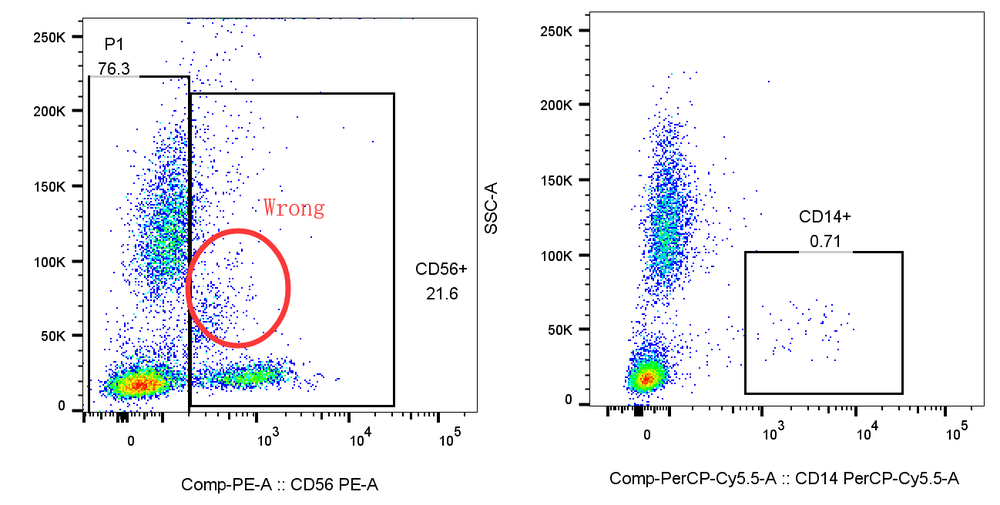
2. 先准后不准:对于表达准确biomarker的亚群优先gate,留下不准确的亚群最后gate,这个就有点类似于排除法了,也和之前几期讲过的lin值的思路一致,先圈出准确的亚群,留下不准确的亚群进行gate,有助于我们把不准确的亚群也变得准确:
例:肺脏髓系亚群分型,作者先分出容易鉴定的Neu/EOS/mono,再进一步分析得到DC和M亚群:
第二,定门型
这个也是很多流式新人不太明了的地方,流式的圈门方式多种多样,十字门,矩形门,圆形门,不规则门等等等,那我到底什么时候用哪种门进行gate呢?这一点其实也只需要根据一句口诀,就是“随形而圈”。
1.当样本分群非常方正,单阳就是单阳,双阳就是双阳,不存在多个单阳/双阳群时,我们一般可以选择十字门进行圈门;
例:最经典的十字门就是凋亡了: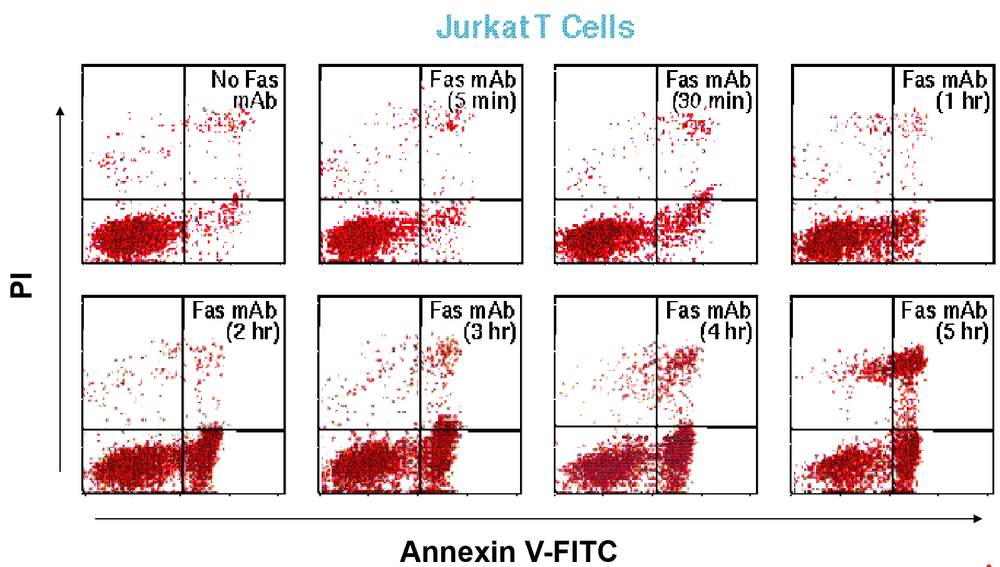
2.当样本的分群比较明显,但是存在多个单阳群,或者多个双阳群且分界清晰时,可以选择矩形门或者多边形门根据细胞的分群,形态进行圈门;
例:在分析NK细胞时,统计CD56的2个分群比例关系: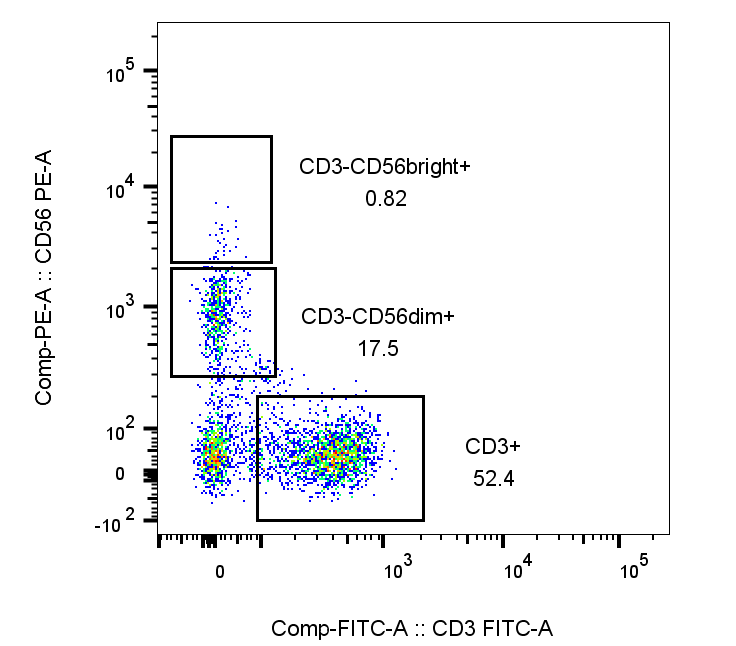
例:通过细胞形态进行CD14/CD11b的多边形圈门,从而分析多个细胞亚群的比例关系:
3. 当样本分群不明显时,我们需要根据其FMO或者同型FMO对照,来确定样本的阳性区间,并根据阳性区间的边界进行圈门,此时多推荐矩形门或者象限门;
三,巧统计
当我们把数据圈门按照如上所讲的思路和原则圈门完成后,接下来我们就到了统计分析的时候了,这时候我们也要注意一点,一定要对我们的数据进行合理的统计方式选择,并不是任何时候都是看一个数据的百分比了事的。
总的来说我们一般在流式里有3种统计方式,这里列出给大家参考:
1. 统计百分比:这个应该是最常见的统计方式了,针对我们圈的每一个门,我们都能看到当前门占上一个门的百分比,进而统计出整个细胞亚群中门的百分比,但是需要注意的是,如果某类细胞全部表达一个marker,那么我们就很难通过百分比来得到统计学差异了;
2. 统计平均荧光强度:针对细胞上某种蛋白的表达强度,我们不仅仅可以通过百分比统计,更是可以统计其平均荧光强度来判断样本的表达水平,这样的好处是对于某些都表达的marker,我们也可以根据其表达强弱来统计出差异性;
例:在磷酸化表达的流式实验中,通过MFI表达结果的差异性明显好于通过百分比: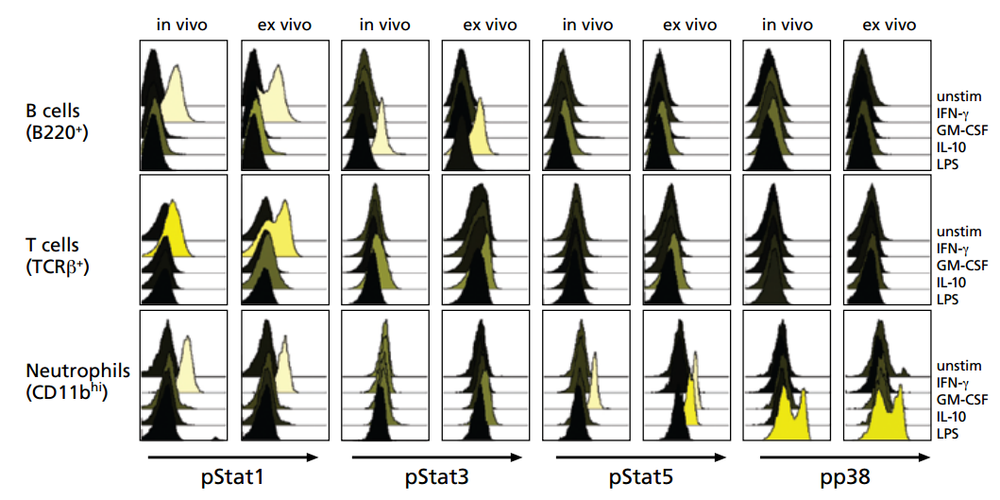
3. 对于一些组织中的样本,我们可以利用绝对计数微球来统计出某些细胞占组织样本的绝对占比,从而统计出差异性,比如某个样本中,CD45+的细胞亚群比例没有太大差异,但是CD45细胞本身出现了增加或者减少,我们此时就可以通过绝对计数来发现这种现象,从而完成细微的统计分析。
总的来说,流式的数据分析需要我们有清晰的思路和细致的观察,多多尝试,一定可以得到自己理想的分析结果的。
当然,很多时候也在和大家强调一个问题,就是染色本身,做好流式染色本身也是一个一力降十会的事情,如果各位老师想要系统的了解各类流式染色步骤,也欢迎关注我们本周三的流式集中营:完整的流式实验流程在这里。







