细胞死亡&细胞功能:细胞焦亡【Pyroptosis】
时间:2021-06-30 09:24:52 浏览次数:1163
细胞焦亡【Pyroptosis】
2001年,Cookson 等人意识到细菌感染引起的巨噬细胞死亡是一种与细胞凋亡完全不同的死亡形式,这种caspase-1依赖的程序性细胞死亡被称为细胞焦亡。与caspase-1类似,caspsae-11/-4/-5也是一种炎症性半胱氨酸天冬氨酸蛋白酶。
![]()
2013年,Vishva Dixit和Edward Miao实验室发现革兰氏阴性菌脂多糖可以导致小鼠巨噬细胞的细胞死亡,这一过程依赖于caspase-11。![]()
2014年,邵峰实验室首次发现人为caspase-4与caspase-11具有相同的生物学功能。Caspsae-11/-4/-5的N-末端结构域可以直接识别和结
合细菌中的脂多糖,引起蛋白酶寡聚,引发细胞焦亡。Gasdermin家族是细胞焦亡的关键分子。
![]()
2018年,细胞死亡命名委员会(NCCD)将细胞焦亡重新定义为由Gasdermin蛋白家族成员形成的质膜毛孔的程序性死亡,这是一种炎症反应。
一、细胞焦亡信号通路

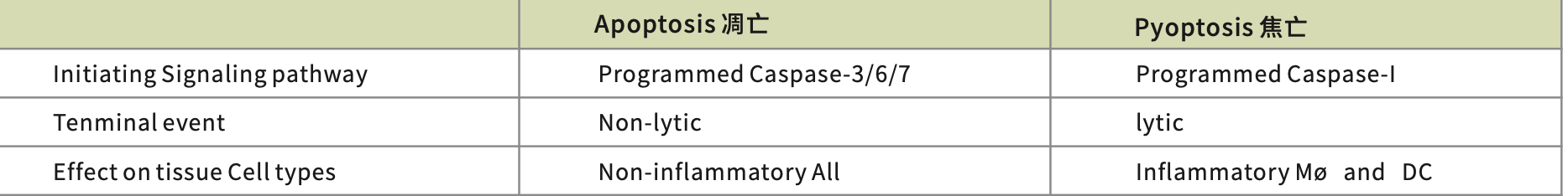
二、细胞凋亡与细胞焦亡的区别
细胞焦亡介于细胞凋亡和坏死之间。与细胞凋亡相似,染色体DNA也有核固缩、断裂,TUNEL和Annexin V染色呈阳性。与细胞凋亡不同,细胞焦亡是由caspase-1激活的。细胞膜上的孔洞形成会导致细胞完整性丧失,导致细胞内容物释放,通透性增加,引发炎症反应,最终导致细胞膜破裂和溶解。
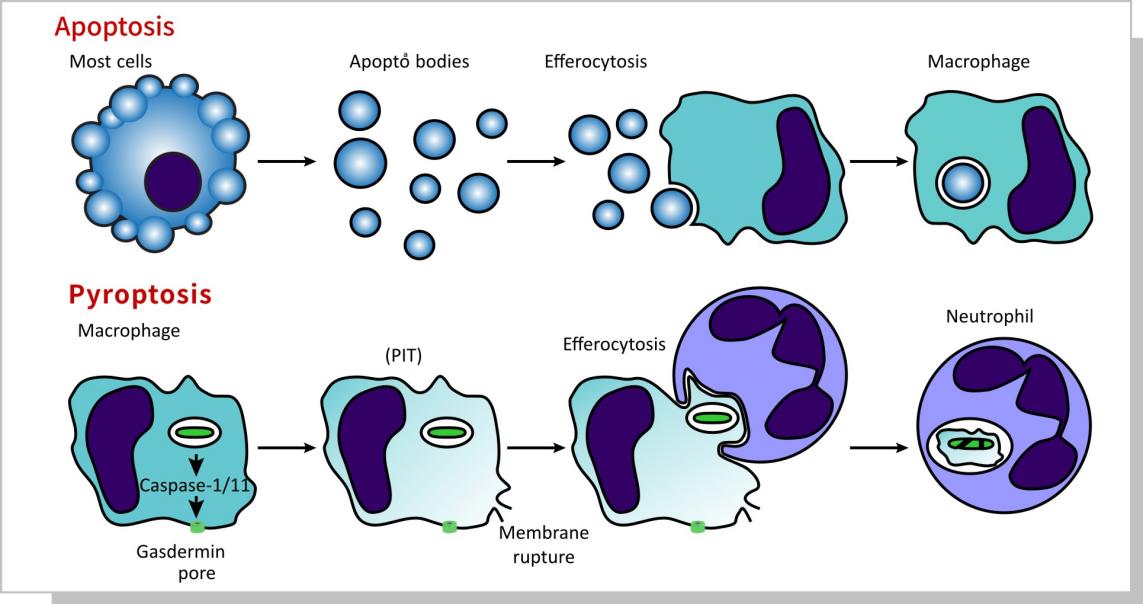
三、经典焦亡途径:Caspsae-1+非经典焦亡之途径Caspase-4/5/11
Caspase-1的激活是经典的细胞焦亡途径的核心,是抵抗病原微生物感染的一种防御机制,是天然免疫系统的重要组成部分。
在经典的细胞焦亡途径中,细胞内PRR接受信号刺激,随后炎性小体聚集,细胞内形成大分子蛋白复合体,炎性小体的形成激活caspase-1前体。一方面,Caspase-1的激活促进了失活的IL-1β和IL-18前体的裂解,产生成熟的IL-1β和IL-18;另一方面,激活的Caspase-1作用于胃泌-D(GSDMD),并将其裂解为反应性氨基(N)端和羧基(C)端。N末端结构域具有脂质选择性,它可以与真核细胞膜特有的磷脂酰肌醇和原核细胞膜特有的果磷脂结合,后者包含磷脂酰肌肉和心脏磷脂脂质体,并在膜形成时聚合形成直径为10−20 nm的中空环状低聚物。微腔导致细胞内外失衡,导致细胞裂解死亡。同时,IL-1β和IL-18等小分子通过毛孔分泌到细胞外。此外,更多的免疫细胞被招募来触发炎症反应,最终导致细胞焦亡。
非经典的焦亡途径,通常是细胞质脂多糖(lipopoly-saccharide,LPS)直接激活Caspase-4、Caspase-5和Caspase-11介导焦亡,Caspase-4、Caspase-5和Caspase-11可以直接被细胞内革兰阴性细菌LPS刺激,以激活和水解自身的蛋白酶活性。活化的Caspase-4、Caspase-5和Caspase-11也可以作用于GSDMD并产生与Caspase-1相同的裂解作用,从而导致细胞膜穿孔。激活的Caspase-4、Caspase-5和Caspase-11在NLRP3和ASC存在下可以与Caspase-1相互作用,从而促进其激活。同样的,Caspase-1裂解IL-1β和IL-18的前体以形成活性IL-1β和IL-18,通过GSDMD-NT形成的膜通道释放并引起焦亡。与经典途径不同的是,在非经典的细胞焦亡中,仅IL-1β和IL-18前体的裂解取决于Caspase-1,GSDMD的切割则是由其他已激活的炎症性Caspases完成的。
四、 Caspase-3引发的细胞焦亡
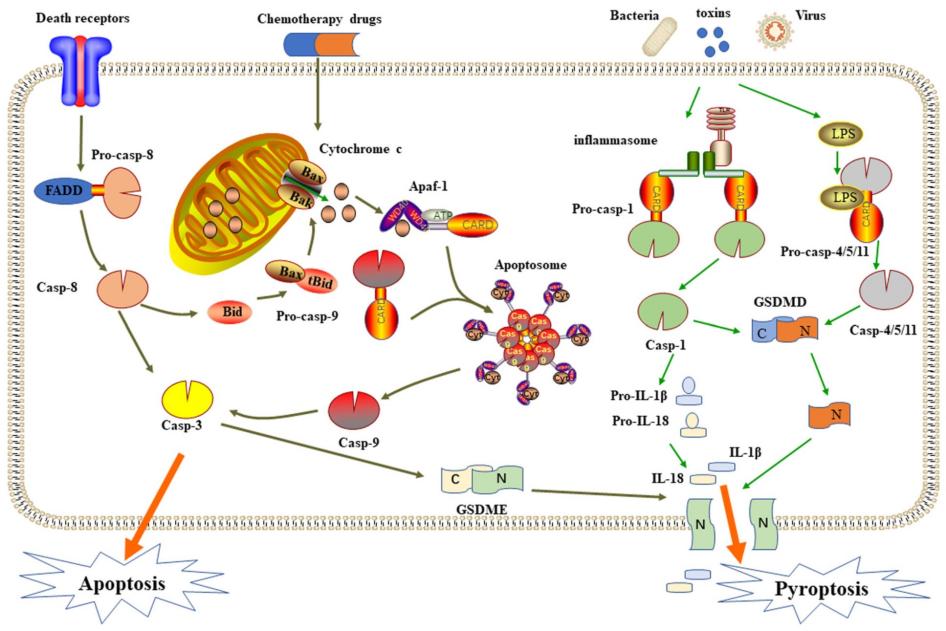
Caspase-3是凋亡信号的重要靶标,为何和焦亡相关?
caspase-3是如何诱导细胞焦亡的呢?
Caspase-3有多种激活机制。最常见的是在化疗药物的刺激下,线粒体通过DNA损伤释放与凋亡相关的因子,启动内源性和外源性的凋亡信号通路,导致caspase-3的激活。由于GSDME的N端和C端结构域中存在一个天然的caspase-3裂解位点,激活的caspase-3能够裂解GSDME的特定位点,释放活性的N-末端结构域,并穿透质膜诱导细胞焦亡。
五、焦亡中的重要蛋白GSDMD
GSDMD是细胞焦亡治疗中不可缺少的物质。GSDMD在食道、胃和皮肤中表达。在人类,GSDMD由氨基末端的242个氨基酸(AA)组成,通过43-AA接头与199-AA的羧基末端相连。2015年,研究人员利用基因组筛选技术发现,GSDMD作为炎性半胱氨酸酶的底物,当被切割时会产生一个活性区域,导致膜孔形成,最终导致细胞焦亡。进一步的研究表明,炎性半胱氨酸蛋白酶激活GSDMD,并将其切割成C端抑制域和N端效应域。后者与细胞膜内侧的膜脂、细菌膜内外的磷脂酰肌醇和心磷脂特异性结合。这种脂质体选择性,使其能够诱发细胞焦亡并杀死细胞内的细菌。当N-末端结构域从细胞中释放出来时,它可以被胞外细菌激活,而不会对其他真核细胞造成损害。这种选择性活性可防止组织损伤和控制细菌感染。它是所有炎症性半胱氨酸酶的共同底物分子。
Summary of the Gasdermin Family Properties and Functions

在细胞焦亡过程中,炎症半胱氨酸蛋白酶将GSDMD裂解成GSDMD-N末端结构域和GSDMD-C末端结构域,使GSDMD-N从GSDMD-C结构域中释放出来,并与细胞膜结合。它会形成引发细胞焦亡的通道。2015年,邵峰老师实验室利用人类基因组的全基因组编辑筛选,发现了导致细胞焦亡的关键分子GSDMD。该团队进一步研究发现,GSDMD是一种代表GSDMS的家族蛋白,并宣布它已将细胞焦亡重新定义为“一种由Gasdermin家族蛋白介导的程序性细胞死亡模式”。由此可见GSDMD是细胞焦亡的关键分子。

六 、焦亡中的炎症小体
炎症小体(Inflammasome)是由感应器、适配器和酶原Proaspase-1组成的多聚蛋白复合物。炎症小体的组装是天然免疫细胞对病原体相关分子模式(PAMP)和损伤相关分子模式(DAMP)的反应。炎性小体通过引起Caspase-1自我剪切,活化,进而裂解Pro-IL-1β、Pro-IL-18形成成熟IL-1β、IL-18。
现已检测到许多不同的炎性体复合体,每个复合体有独特的 PRR 和激活触发物。特征最明显的是 NLRP3 复合体,它含有 NLRP3、ASC、pro-caspase-1 和丝氨酸-苏氨酸激酶 NEK7。

NLRP3 炎性小体的形成过程
第一步初始化:PAMP 或 DAMP 介导的 TLR4 或 TNFR 激活会诱导 NF-kB 信号转导,导致 NLRP3、pro-IL-1β 和 pro-IL-18 表达升高
(引导步骤,信号 1)。
第二步激活组装:大量信号(全病原体、PAMP/DAMP、钾外流、溶酶体损坏的环境因子 [尿酸、硅和明矾]、内源性因子 [淀粉样蛋白 β、胆固醇结晶] 和线粒体损害)会间接激活 NLRP3,导致复合体组装和 caspase-1 激活(信号 2)。蛋白组分之间的结构域相互作用会形成复合体炎性体结构。

细胞焦亡抑制剂全推荐 细胞焦亡与炎症小体相关产品 细胞焦亡相关化合物
如何测量细胞焦亡:
|
细胞焦亡标记物 |
细胞焦亡标记物描述 |
检测方法 |
|
▲ 炎性小体形成 |
细胞焦亡的特点是炎性体的形成;炎性体的标记物是 NLRP3 |
WB |
|
▲ Caspase-1 活性 |
细胞焦亡期间发生 caspase-1 的剪切 |
WB、FC流式、IHC |
|
▲ Gasdermin D 剪切 |
细胞焦亡期间发生 gasdermin-D 剪切 |
WB、IHC |
|
Caspase-4,5,11 |
细胞焦亡期间发生 caspase-4,5,11的剪切 |
WB、FC流式、IHC |
|
IL-1 Beta,IL-18 |
细胞焦亡期间发生炎症因子的释放 |
WB、FC流式、EliSA |
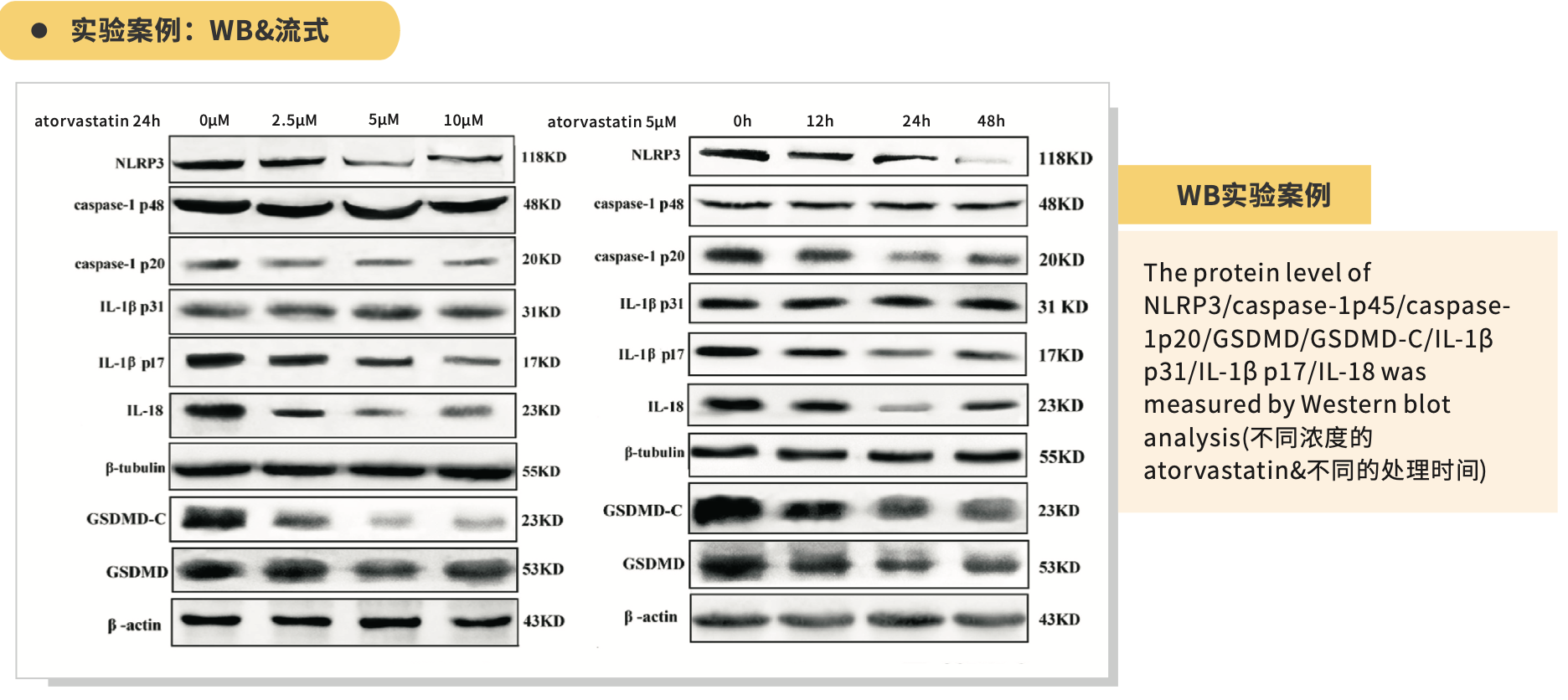
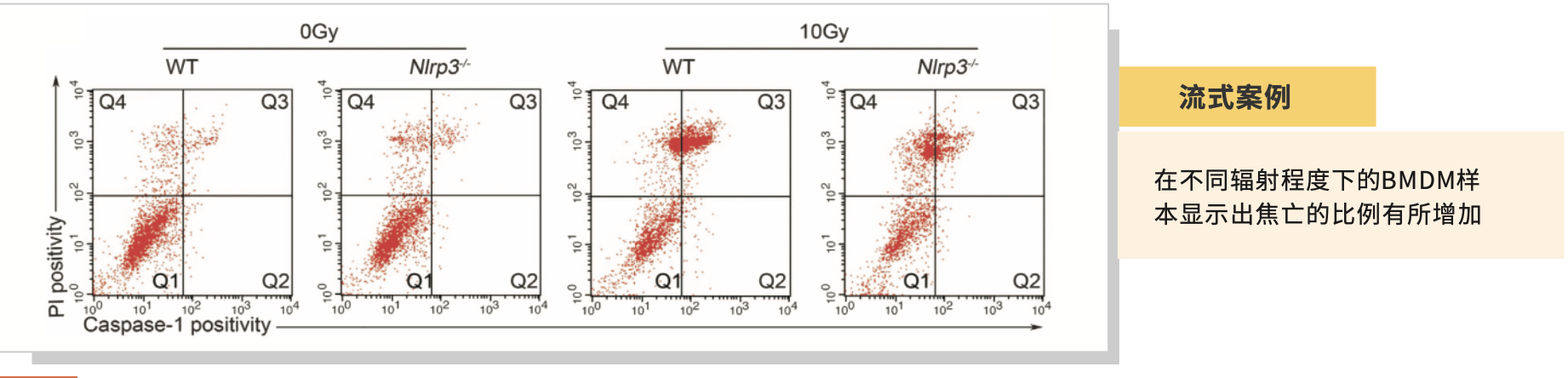
七、 引用文献
1. Liu Y G , Chen J K , Zhang Z T , et al. NLRP3 inflammasome activation mediates radiation-induced pyroptosis in bone marrow-derived macrophages[J]. Cell Death & Disease, 2017, 8(2):e2579.
2. Shi J , Gao W , Feng S . Pyroptosis: Gasdermin-Mediated Programmed Necrotic Cell Death[J]. Trends in Biochemical Sciences, 2016, 42(4).
3. Swanson K V , Deng M , Ting P Y . The NLRP3 inflammasome: molecular activation and regulation to therapeutics[J]. Nature reviews. Immunology, 2019.
4. Mangan M , Olhava E J , Roush W R , et al. Targeting the NLRP3 inflammasome in inflammatory diseases[J]. Nature Reviews Drug Discovery, 2018.
5. Wang J , Manoranjan S , Louis L , et al. Caspase-11-dependent pyroptosis of lung epithelial cells protects from melioidosis while caspase-1 mediates macrophage pyroptosis and production of IL-18[J]. Plos Pathogens, 2018, 14(5):e1007105.
6. Wu L M , Wu S G , Chen F , et al. Atorvastatin inhibits pyroptosis through the lncRNA NEXN-AS1/NEXN pathway in human vascular endothelial cells[J]. Atherosclerosis, 2019, 293.
7. Kovacs S B , Miao E A . Gasdermins: Effectors of Pyroptosis[J]. Trends in Cell Biology, 2017:S0962892417300843.
8. Jisa B , Khla B , Yhj C , et al. Inflammasomes and autoimmune and rheumatic diseases: A comprehensive review - ScienceDirect[J]. Journal of Autoimmunity, 103:102299-102299.
9. Jiang M , Qi L , Li L , et al. The caspase-3/GSDME signal pathway as a switch between apoptosis and pyroptosis in cancer[J]. Cell Death Discovery.
上海优宁维生物科技股份有限公司
试剂 | 耗材 | 仪器 | 软件 | 定制 | 实验服务 | 供应链
免费热线:4008-168-068
咨询邮箱:info@univ-bio.com
订购商城:www.univ-bio.com
微信公众平台:优宁维抗体专家,欢迎关注!
小优博士(小程序):5大课堂, 让你的科研不再难!













 危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)
危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)  营业执照(三证合一)
营业执照(三证合一)