细胞死亡&功能:坏死性凋亡【Necroptosis】
时间:2021-06-30 11:18:08 浏览次数:831
坏死性凋亡【Necroptosis】
坏死性凋亡是程序性裂解细胞死亡的途径,其被认为在某些退行性或炎性疾病期间在杀死病原体感染的细胞和/或受损细胞中起作用。坏死性凋亡可以通过多种先天免疫信号传导途径诱导,包括通过刺激RIG-I样受体,TLR和死亡受体引发的途径。这些信号通路都导致坏死性激酶RIPK3(受体相互作用的丝氨酸-苏氨酸激酶3)的磷酸化和活化,在死亡受体诱导的坏死性凋亡的情况下也需要RIPK1活性。RIPK3通过磷酸化激活假激酶MLKL(混合谱系激酶结构域样),引起其构象变化和活化,活化的 MLKL定位到质膜引起膜通透性变化 。
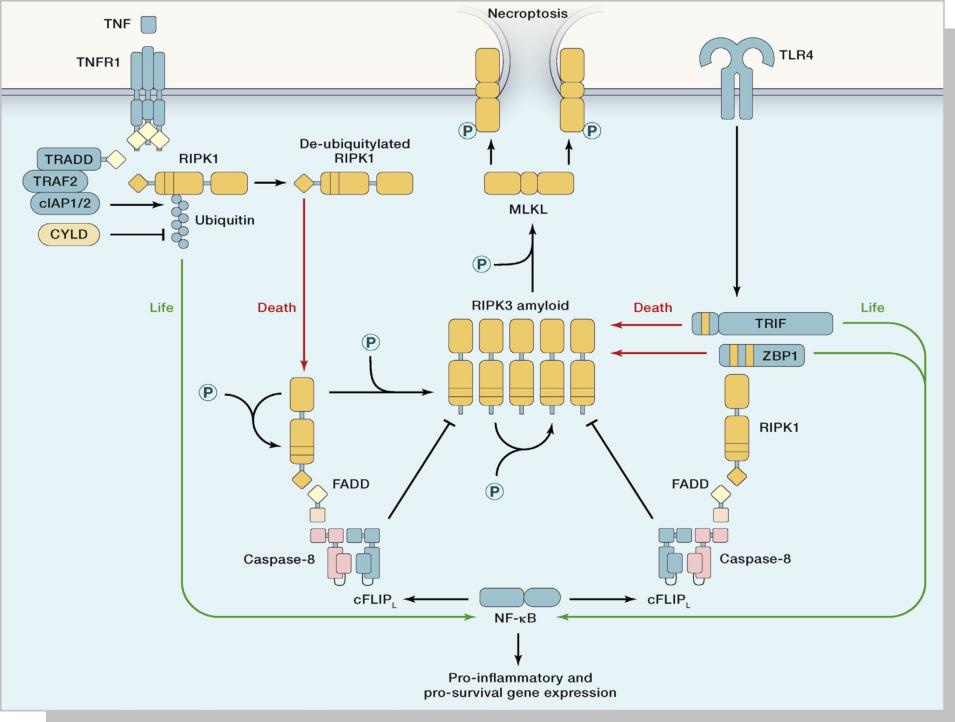
一 、坏死性凋亡之信号通路

二、坏死性凋亡的引发因素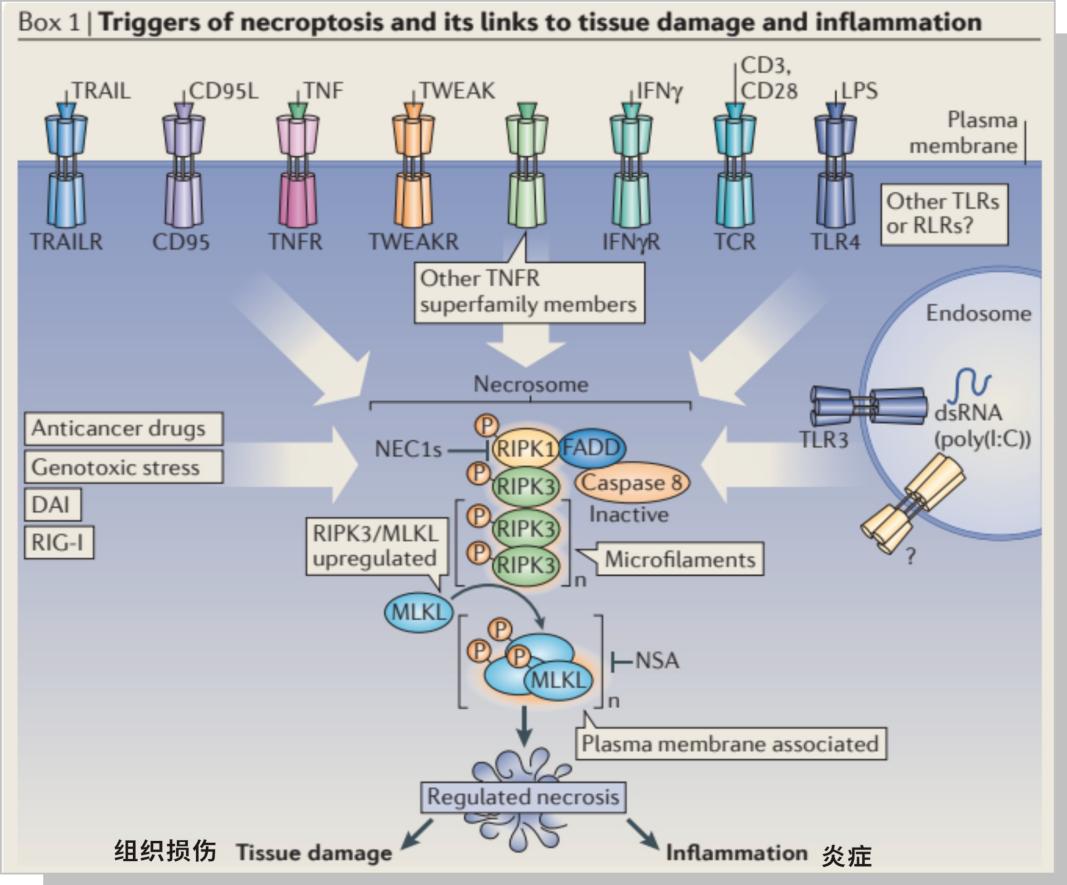
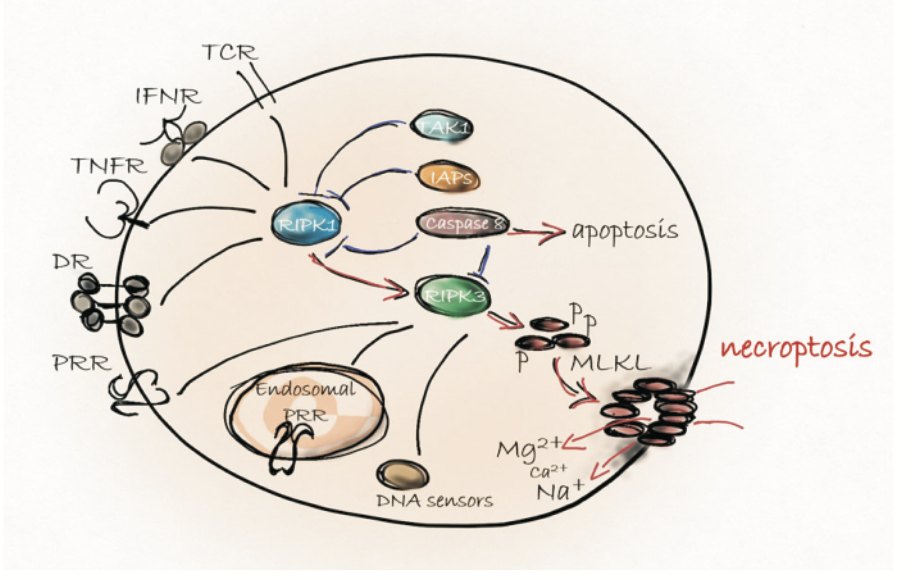
三、坏死性凋亡的重要靶标
各种胞外或胞内信号直接或通过RIPK1激活RIPK3蛋白。Ripk3介导的磷酸化诱导MLKL膜易位,因此,离子内流导致死亡。生存信号通过上调IAPs或激活TAK1激酶途径阻断ripk1诱导的信号传导,保护细胞免受不必要的坏死。caspase -8介导的前凋亡RIPK1和RIPK3的切割确保了免疫沉默性凋亡的优势,而非免疫刺激性坏死。
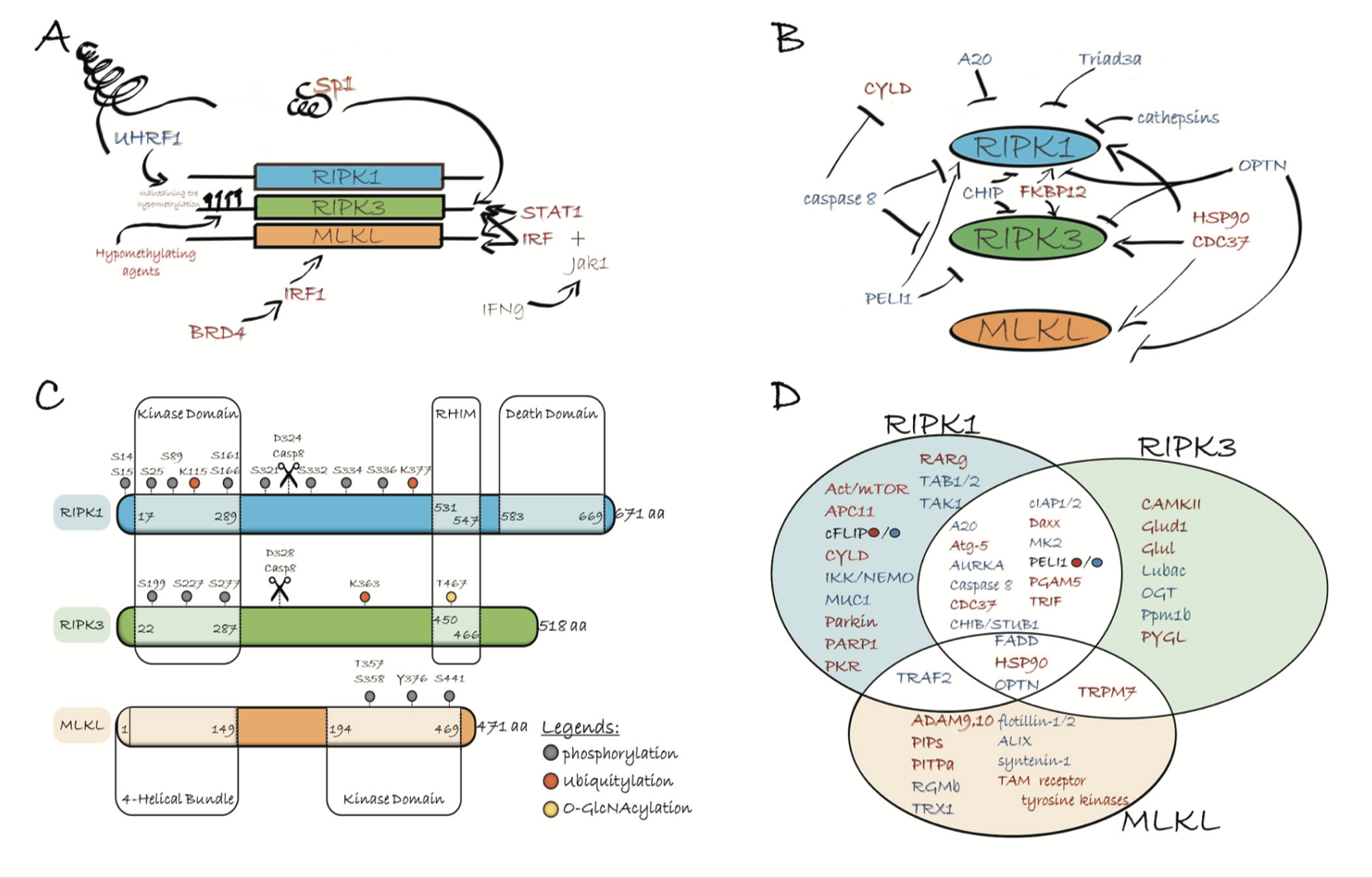
坏死性凋亡相关抗体
1. RIPK1是一个能与TNFRl相互作用的蛋白因子, 既能参与凋亡调节, 也能参与程序性坏死调节。RIPKl的N末端是激酶结构域, 且激酶区会在丝氨酸/苏氨酸残基位点发生自身磷酸化; C末端为死亡结构域; N末端和C末端之间是一段中间区域, 包含同型作用结构域。RIPKl的3个结构域具有不同的功能:通过N末端的调控激活NF-κB信号途径使细胞存活; 通过C末端的死亡结构域与TNFRl相互作用诱导凋亡; 通过同型作用结构域与RIPK3形成坏死小体参与调节程序性坏死。
2. RIPK3具有RIP同型结构域, 能与RIPKl结合, 是细胞程序性坏死的重要分子开关: 下调RIPK3可阻止细胞程序性坏死, 但不影响细胞凋亡; RIPK3基因缺陷小鼠胚胎成纤维细胞内RIPKl表达正常, TNF-α未能诱导程序性坏死; 用缺乏激酶活性的RIPK3突变体转染细胞也未见程序性坏死的发生。Caspase-8和FADD对程序性坏死具有负性调节作用, 原因可能是caspase-8把RIPKl和RIPK3从复合物Ⅱ中裂解下来, 阻止RIPKl与RIPK3相互作用和相关基因表达, 从而抑制程序性坏死。
3. MLKL是一种激酶样蛋白, 即N端的4个螺旋束结构域(4HB) 通过2个螺旋接头与C端的假性激酶样区域连接。其中4HB结构域是细胞死亡执行区域, 且与假性激酶区结合保持失活状态。活化的RIPK3使位于MLKL假性激酶区的α螺旋Thr357和Ser358磷酸化, 从而造成结构不稳定, 释放N末端的4HB结构域。MLKL在胞质膜上寡聚化, 造成胞质膜的不稳定或间接下调Ca2+或Na+离子通道, 升高了胞内渗透压, 导致细胞坏死。此外, MLKL磷酸化形成寡聚体与磷酸肌醇相连, 可使MLKL从胞质移到细胞膜, 直接破坏膜的完整性, 导致细胞坏死。
如何测量坏死性凋亡:(只列出来部分重要靶标)
|
坏死性凋亡标记物 |
坏死性凋亡标记物描述 |
检测方法 |
|
RIP 和 RIP3 激酶 |
含有 RIP 和 RIP3 激酶可引起坏死性凋亡的蛋白复合体 |
WB、IHC、FC |
|
Phospho-RIP 和 Phospho-RIP3 激酶 |
RIP 激酶的磷酸化作为坏死性信号转导事件激活的指标 |
WB、IHC、FC |
|
MLKL |
RIP3 下游蛋白靶标 |
WB、IHC、FC |
|
Phospho-MLKL |
MLKL 磷酸化是坏死凋亡细胞的标记物 |
WB、IHC、FC |
|
Caspase-8 |
坏死性凋亡的抑制 |
WB、IHC、FC |
|
炎症因子检测 |
坏死性凋亡的功能检测 |
多因子检测 |
|
泛素 |
蛋白修饰 |
WB、IHC |
坏死性凋亡实验结果
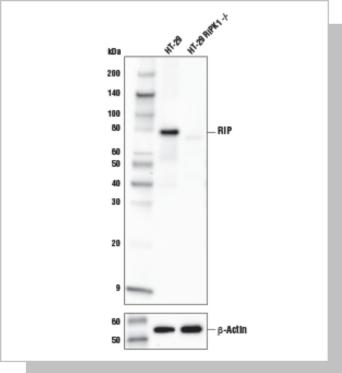
使用RIP (E8S7U) XP® Rabbit mAb (上图)或β-Actin (D6A8) Rabbit mAb #8457(下图)对HT-29 和T-29 RIPK1 敲除(-/-) 细胞提取物进行 蛋白质印迹分析。HT-29 RIPK1 敲除型细胞由马萨诸塞州波士顿哈佛 医学院的Yuan Junying 博士惠赠。 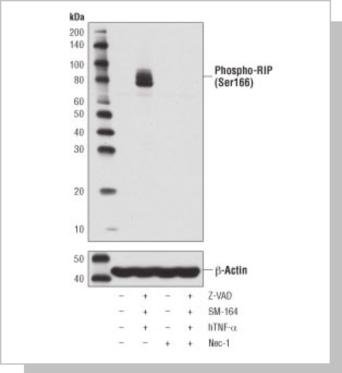
使 用 MLKL (D2I6N) Rabbit mAb ( 上 ) 或 Myc-Tag (71D10) Rabbit mAb #2278(下),对转染空载(-) 转染Myc/DDK 标签的全长人MLKL 蛋白表达载体(hMLKL-Myc/DDK;+) 的293T 细胞的提取物进行蛋白 质印迹分析 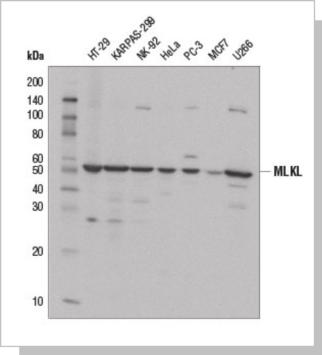
使用Phospho-RIP (Ser166) (D1L3S) Rabbit mAb(上图)或β-Actin (D6A8) Rabbit mAb #8457(下图)对未经处理(-) 或经过如下所示的 处理组合方法处理的HT-29 细胞进行蛋白质印迹分析:Z-VAD(20 μ M,先于其他混合物30 分钟添加;+)、人TNF-α(hTNF-α,20 ng/ml,7 小时;+)、SM-164(100 nM,7 小时;+)和 necrostatin-1(Nec-1,50 μM,7 小时;+)。
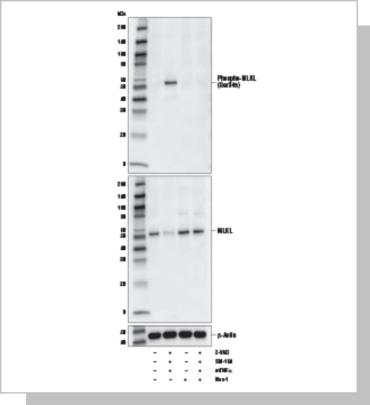
使 用 Phospho-MLKL (Ser345) (D6E3G) Rabbit mAb(上 图 ) 、 总 MLKL (D6W1K) Rabbit mAb (Mouse Specific) #37705(中图)或β- Actin (D6A8) Rabbit mAb #8457(下图)对未经处理的(-) 或经过以 下组合处理方法处理的L-929 细胞提取物进行蛋白质印迹分析:Z- VAD(20 μM,先于其他混合物30 分钟添加;+)、Mouse Tumor Necrosis Factor-α (mTNF-α) #5178(20 ng/ml,4 小时;+)、SM- 164(100 nM,4 小时;+)和necrostatin-1(Nec-1,50 μM,4 小 时;+)。
四、引用文献
1. Green D R . The Coming Decade of Cell Death Research: Five Riddles[J]. Cell, 2019, 177(5):1094-1107.
2. Kim, Chun, Lin, et al. RIPK1 counteracts ZBP1-mediated necroptosis to inhibit inflammation[J]. Nature, 2016.
3. Pasparakis M , Vandenabeele P . Necroptosis and its role in inflammation[J]. Nature, 2015, 517(7534):311.
4. Berghe T V , Linkermann A , Jouan-Lanhouet S , et al. Regulated necrosis: the expanding network of non-apoptotic cell death pathways[J]. Nature Reviews Molecular Cell Biology, 2014, 15(2):135-147.
上海优宁维生物科技股份有限公司
试剂 | 耗材 | 仪器 | 软件 | 定制 | 实验服务 | 供应链
免费热线:4008-168-068
咨询邮箱:info@univ-bio.com
订购商城:www.univ-bio.com
微信公众平台:优宁维抗体专家,欢迎关注!
小优博士(小程序):5大课堂, 让你的科研不再难!











 危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)
危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)  营业执照(三证合一)
营业执照(三证合一)