细胞死亡&细胞功能:铁死亡【Ferroptosis】
时间:2021-06-30 11:23:51 浏览次数:1915
一、铁死亡介绍
铁死亡,是一种调节细胞死亡的方式,主要是铁超载和活性氧(ROS)依赖的脂质过氧化物累积引起的。主要表现为,与正常线粒体相比膜密度更致密,体积更小,嵴减少或消失,外膜破裂。线粒体是铁利用、分解代谢和合成代谢途径的主要细胞器,在铁代谢、物质代谢和能量代谢中起着中心作用。线粒体脂质代谢的关键调节因子(如ASCF2和CS)、铁稳态(如铁蛋白、mitoferrin1/2和NEET蛋白)、谷氨酰胺代谢和其他信号通路的干扰会对铁敏感产生影响。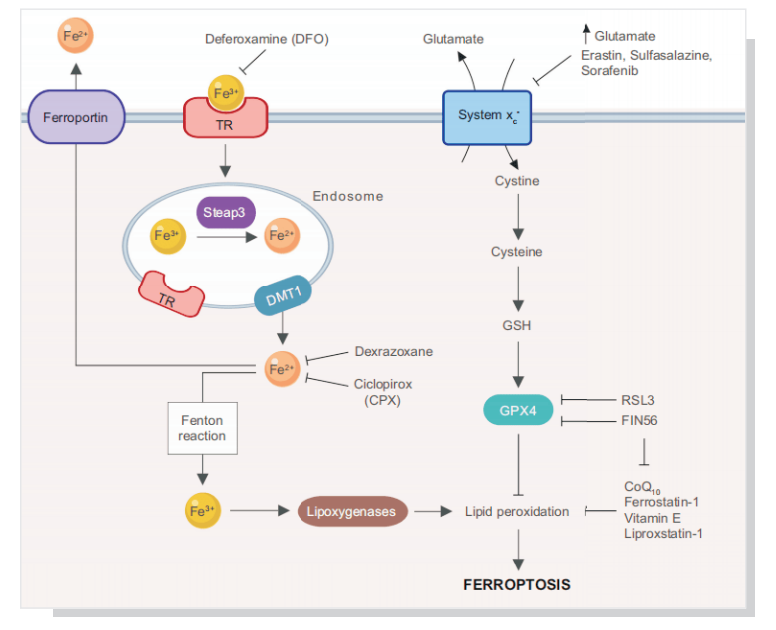
二、铁死亡相关疾病
铁死亡在神经系统疾病、心脏疾病、肝脏疾病、胃肠道疾病、肺部疾病、肾脏疾病、胰腺疾病等多种系统疾病中起着重要作用。
铁死亡与哺乳动物退行性疾病(例如:阿尔茨海默氏病、亨廷顿舞蹈病和帕金森综合征)、肿瘤、中风、脑出血、外伤性脑损伤、局部缺血-再灌注损伤和肾衰竭相关的病理性细胞死亡也有关联。铁离子螯合剂可以抑制这一过程,很多抑制或缓解脂质过氧化的药物均可抑制铁死亡的过程,包括亲脂性抗氧化剂,脂质过氧化抑制剂等等,但不能被凋亡或自噬抑制剂抑制。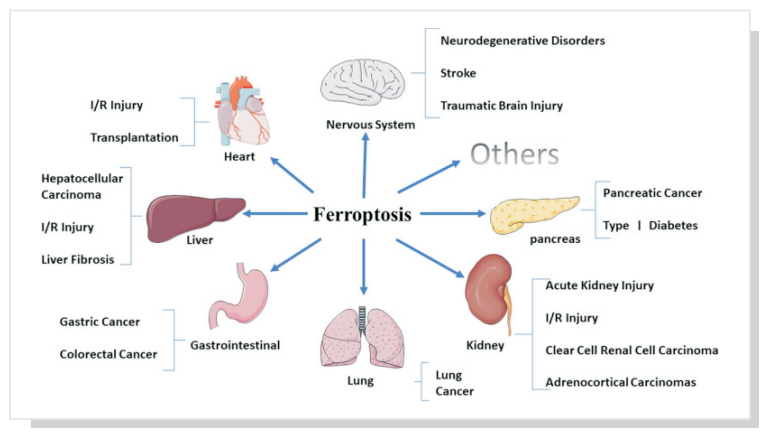
三、铁死亡相关特征
|
形态学特征 |
超微结构显示,铁死亡时细胞膜断裂和出泡,线粒体萎缩、线粒体脊减少甚至消失、膜密度增加、细胞核形态正常,但缺乏染色质凝集;电镜下观察到胞内线粒体变小、双层膜密度增高。 |
|
生物学特征 |
活性氧(ROS)增加、铁离子聚集,激活丝裂原活化蛋白激酶(MAPK)系统,通过降低胱氨酸的摄取、耗竭谷胱甘肽,抑制ystem Xc-和增加还原型酰腺嘌呤二核苷酸磷酸氧化酶,释放花生四烯酸等介质。 |
|
免疫学特征为损 |
(damage-associatedmolecular patterns molecules,DAMPs)释放前炎症介质(如高迁移率族蛋白B1等)。 |
|
基因水平 |
主要受核糖体蛋白L8(ribosomalprotein L8,RPL8),铁反应元件结合蛋白(ironresponse element binding protein 2,IREB2),ATP合成酶F0复合体亚基C3(ATP synthase F0 complex subunit C3,ATP5G3),三四肽重复结构域35(tetratricopeptide repeat domain 35,TTC35),柠檬酸合成酶(citratesynthase,CS),酰基辅酶A合成酶家族成员2(acyl-CoAsynthetase family member 2,ACSF2)以及受代谢、储存基因TFRC、ISCU、FTH1、FTL、SLC11A2的调节。 |
四、几种死亡之形式比较铁死亡、凋亡、自噬
|
铁死亡 |
凋亡 |
自噬 |
|
|
形态学特征 |
Small mitochondria with increasedmitochondrial membranedensities,reduction or vanishing ofmitochondria Crista, outer mitochondrial membrane Rupture and normal nucleus |
Cellular and nuclear volume reduction, chromatin agglutination,nuclearfragmentation, formation of apoptotic bodiesand cytoskeletal disintegration, no significant changes in mitochondrial structure |
Formation of double-mem braned autolysosomes, including macroautophagy, microautophagy and chaperone- mediated autophagy |
|
生物学特征 |
Iron accumulation and lipid peroxidation |
DNA fragmentation |
Increased lysosomal activity |
|
调控通路 |
Xc- /GPX4, MVA, sulfur transfer pathway, P62-Keap1-NRF2 pathway, P53/SLC7A11,ATG5-ATG7-NCOA4pathway,P53-SAT1-ALOX15pathway, HSPB1-TRF1,FSP1-COQ10-NAD(P)Hpathway |
Death receptor pathway, mitochondrionpathway and endoplasmic reticulum pathway;Caspase, P53, Bcl-2 mediated signaling pathway |
mTOR, Beclin-1, P53 signaling pathway |
|
关键基因 |
GPX4, TFR1, SLC7A11, NRF2, NCOA4, P53,HSPB1, ACSL4, FSP1 |
Caspase, Bcl-2, Bax, P53, Fas |
ATG5, ATG7, LC3, Beclin-1, DRAM3, TFEB |
|
检测指标阳 性调控因子 |
ROS、PTGS2上升NADPH下降 |
细胞色素C释放caspase活化细胞内钙离子增高 |
LC3-Ⅰ向LC3-Ⅱ转化 |
|
阳性调控因子 |
Erastin、RSL3、RAS Sorafenib、p53 |
p53、 Bax、Bak、TGF-B 地塞米松、放射线 |
ATG家族、Beclin1 |
|
阴性调控因子 |
GPX4、FSP1、SLC7A11、NRF2、Ferrostatin-1、Liproxstatin-1、DFO |
Bcl-2、Bcd-XL Z-VAD-FMK、IL-4 |
mTOR3-Methyladenine, Wortmannin,Spautin1 |
五 、铁死亡的发生涉及的主要信号通路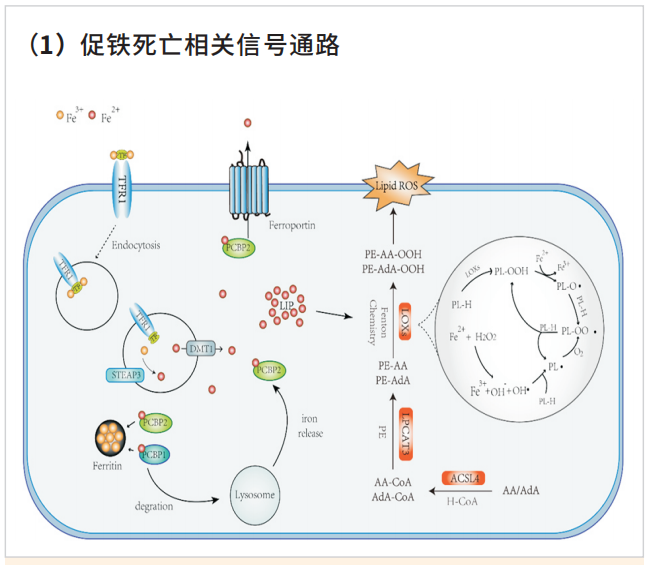
作为新兴的死亡方式,越来越多的研究者致力于对铁死亡机制的研究。多不饱和脂肪酸是细胞膜的组成部分,并且参与调节多种生物学功能,包括炎症、免疫、突触可塑性和细胞生长。但是多不饱脂肪酸双烯丙基处的C-H键极易被氧化攻击,因此其也是铁死亡过程中的重要底物,大量积累的脂质过氧化物以及其毒性代谢物会导致细胞的死亡。在此过程中,ACSL4、脂氧合酶、芬顿反应、活性氧等的存在都会促进铁死亡的进一步发展。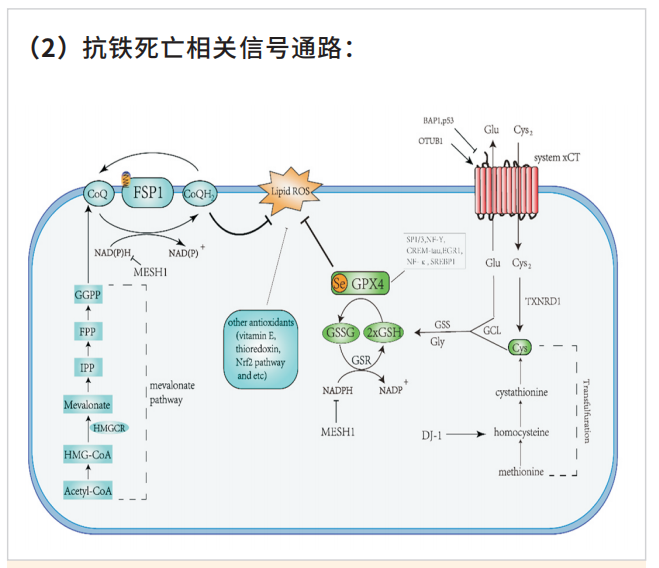
细胞存在着高效的抗氧化机制将脂质过氧化物降解形成脂质醇,以维持细胞内的氧化稳态。这个平衡是由多种氧化还原活性酶参与,涉及脂质代谢,铁代谢以及氨基酸代谢等。其中,GSH-GPX4和FSP1-CoQ10是抗铁死亡的两条主要通路。此外,机体内还存在着NRF2调控的抗氧化通路以及维他命E等内源性抗氧化物。
六、铁死亡的调控
(1)抑制GPX4诱导铁死亡:GPX4 能降解小分子过氧化物和某些脂质过氧化物,抑制脂质过氧化。研究发现,若细胞中 GPX4 表达下调则会对铁死亡更敏感;相反,若上调 GPX4 的表达,则会产生对铁死亡的耐受。因此,将GPX4抑制后将诱导细胞发生铁死亡。
(2)抑制胱氨酸谷氨酸转运受体 (systemXC-)诱导铁死亡:通过systemXC-,谷氨酸与胱氨酸以1:1比例交换,因此,谷氨酸的水平会影响到systemXC- 的功能。细胞外高浓度的谷氨酸会抑制systemXC-从而诱导铁死亡。敲除systemXC-的小鼠由于细胞外谷氨酸水平减少,可以防止神经毒性损伤。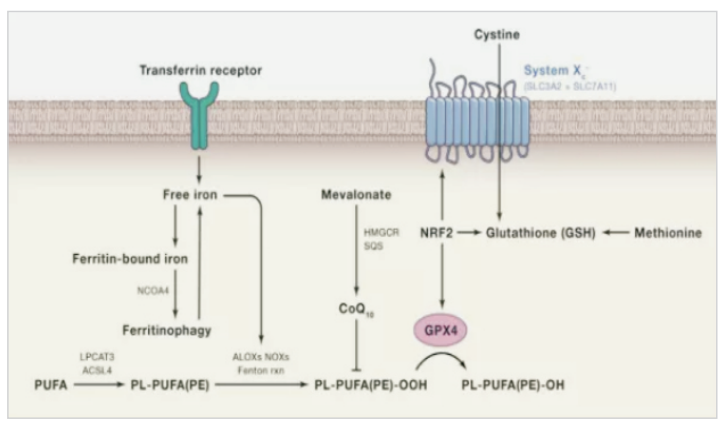
(3)p53介导铁死亡:p53是一种抑癌基因,通过下调systemXC-组分SLC7A11的表达抑制细胞对胱氨酸的摄取,导致谷胱甘肽过氧化物酶活性降低,削减细胞抗氧化能力,增强细胞对铁死亡的敏感性。同时,研究发现,在人肿瘤细胞中SLC7A11过度表达,这种过表达能够抑制活性氧诱导的“铁死亡”,同时削弱p53KR介导的对肿瘤生长的抑制作用。

(4)ROS调控:诱导铁死亡发生均会导致细胞内脂质ROS升高,从而引起细胞死亡,这也是脂质抗氧化剂可抑制铁死亡的原因。线粒体作为含铁丰富(铁是线粒体氧化呼吸链必需离子)、ROS产生为主的细胞器,被认为是铁死亡发生的重要场所。它既是细胞内产生ROS的重要场所,其脂肪酸代谢又为细胞铁死亡提供特定的脂质前体。p53也能够通过ROS应答和"铁死亡"抑制肿瘤生长。 
(5)Erastin在铁下垂、细胞凋亡、增殖和分化中的作用。Erastin可通过直接与VDAC2或VDAC3结合引起线粒体氧化损伤,或通过与SLC7A5结合引起谷胱GSH缺失而诱导铁下垂。在某些情况下,erastin介导的TP53上调可诱导线粒体凋亡通路。Erastin也被证明通过抑制BMP2、BMP4、BMP6和BMP7的表达,促进人外周血单个核细胞向B细胞和NK细胞的增殖和分化。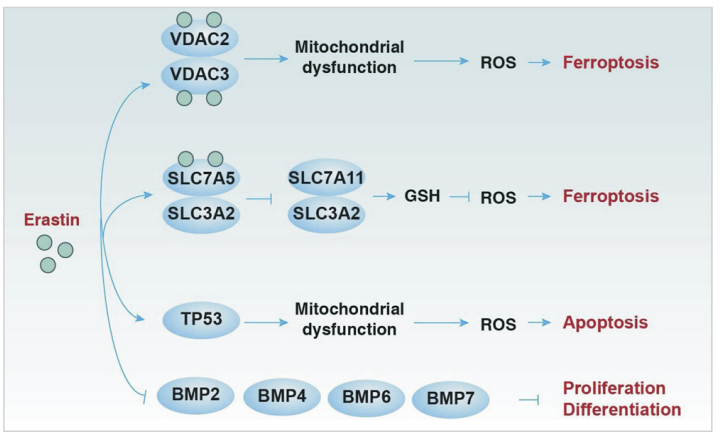

铁死亡相关检测抗体
铁死亡相关化合物
七、铁死亡的相关检测方法
|
特征 |
方法学 |
说明 |
|
细胞活性 |
CCK-8 |
细胞活力检测 |
|
铁水平检测 |
PGSK探针 |
流式细胞术或共聚焦显微镜检测细胞内铁含量的细胞膜透性染料,结果表明,在铁死亡的细胞中,PGSK的绿色荧光会减弱 |
|
活性氧水平 |
C11-BODIPY |
其中COX2、ACSL4、PTGS2、NOX1在铁死亡细胞中表达上调,GPX4、FTH1在铁死亡细胞中表达下调 |
|
铁死亡相关的蛋白 |
qRT-PCR/WB检测TGS2、NOX1、 FTH1、COX2、GPX4、ACSL4 |
通过电镜或者流式细胞术,在铁死亡细胞中,探针会由红色转化为绿色 |
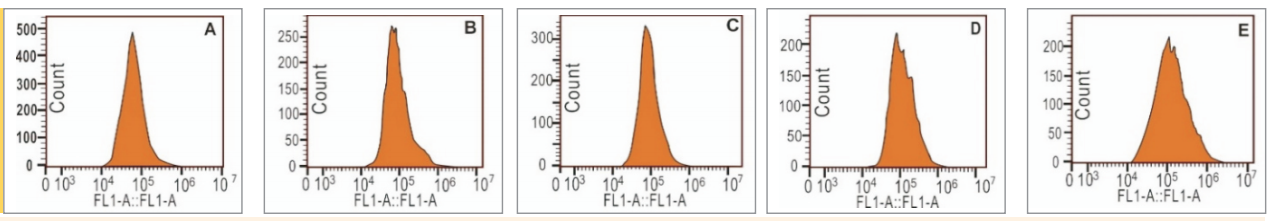
Representative flow cytometry analysis of the4,4-difluoro-5-(4-phenyl-1,3-butadienyl) -4-bora-3a,4a-diaza-s-indacene-3-undecanoic acid (C11-BODIPY) fluorescence intensity (A–F) and the percentage of the relative mean fluorescence intensity of C11-BODIPY of bmMSCs.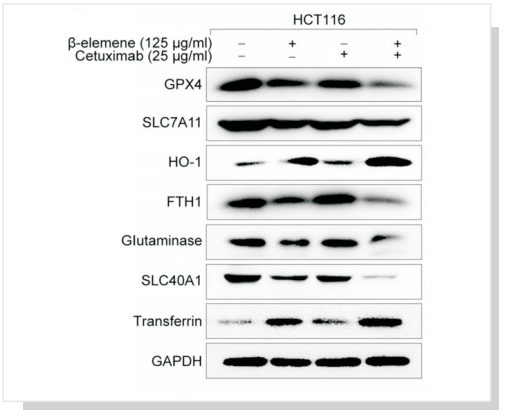
WB案例
KRAS突变CRC细胞经过β-elemene和西妥昔单抗联合治疗处理,观察铁死亡相关蛋白的变化。The expression ofpositive regulatory proteins for ferroptosis (HO-1 and transferrin) and the negative regulatory proteins for ferroptosis (GPX4, SLC7A11, FTH1, glutaminase, and SLC40A1)were detected by western blotting after the treatment (β-elemene 125 µg/ml, cetuximab 25 µg/ml) for 24 h.
八、引用文献
1. Xin Chen , Jingbo Li , Rui Kang , Daniel J. Klionsky & Daolin Tang (2020): Ferroptosis: Machinery and Regulation, Autophagy
2. Tang, D., Chen, X., Kang, R., & Kroemer, G. (2020). Ferroptosis: molecular mechanisms and health implications. Cell Research.
3. Borong, Zhou, Jiao, et al. Ferroptosis is a type of autophagy-dependent cell death.[J]. Seminars in Cancer Biology, 2019.
4. Li J , Cao F , Yin H L , et al. Ferroptosis: past, present and future[J]. Cell Death & Disease, 2020, 11(2):88.
5. Mou Y , Wang J , Wu J , et al. Ferroptosis, a new form of cell death: opportunities and challenges in cancer[J]. Journal of Hematology & Oncology, 2019, 12(1).
6. Tang R , Xu J , Zhang B , et al. Ferroptosis, necroptosis, and pyroptosis in anticancer immunity[J]. Journal of Hematology & Oncology, 2020, 13(1).
7. Chen X , Yu C , Kang R , et al. Iron Metabolism in Ferroptosis[J]. Frontiers in Cell and Developmental Biology, 2020, 8.
8. Wang H , Liu C , Zhao Y , et al. Mitochondria Regulation in Ferroptosis[J]. European Journal of Cell Biology, 2019, 99(1):151058.
9. Wang Y , Wei Z , Pan K , et al. The function and mechanism of ferroptosis in cancer[J]. Apoptosis, 2020, 25(11-12).
10. Sun Y , Chen P , Zhai B , et al. The emerging role of ferroptosis in inflammation[J]. Biomedicine & Pharmacotherapy, 2020, 127:110108.
11. X Lin, Ping J , Wen Y , et al. The Mechanism of Ferroptosis and Applications in Tumor Treatment[J]. Frontiers in Pharmacology, 2020, 11.
12. Xu S , Min J , Wang F . Ferroptosis: an emerging player in immune cells (News&Views)[J]. Science Bulletin, 2021(2731–44).
13. Xu S , He Y , Lin L , et al. The emerging role of ferroptosis in intestinal disease[J]. Cell Death & Disease.
14. Chen X , Kang R , Kroemer G , et al. Broadening horizons: the role of ferroptosis in cancer[J]. Nature Reviews Clinical Oncology, 2021.
15. Liu P , Feng Y , Li H , et al. Ferrostatin-1 alleviates lipopolysaccharide-induced acute lung injury via inhibiting ferroptosis[J]. Cellular & Molecular Biology Letters, 2020, 25(1).
16. X Li, Zeng J , Liu Y , et al. Inhibitory Effect and Mechanism of Action of Quercetin and Quercetin Diels-Alder anti-Dimer on Erastin-Induced Ferroptosis in Bone Marrow-Derived Mesenchymal Stem Cells[J]. Antioxidants, 2020, 9(3):205-.
17. Chen P , Li X , Zhang R , et al. Combinative treatment of β-elemene and cetuximab is sensitive to KRAS mutant colorectal cancer cells by inducing ferroptosis and inhibiting epithelial-mesenchymal transformation[J]. Theranostics, 2020, 10(11):5107-5119.
不同细胞死亡形式总结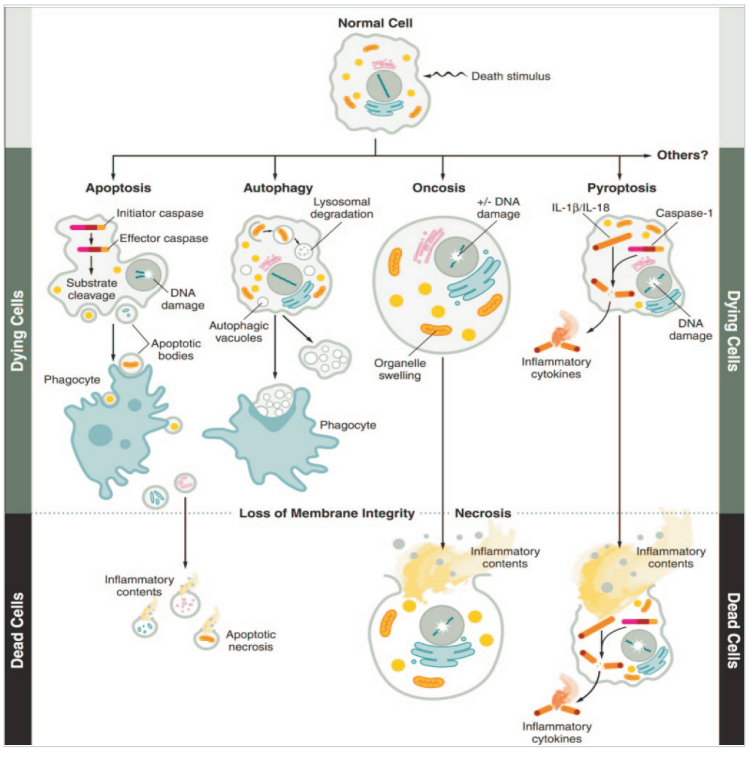
 铁死亡系列文章介绍
铁死亡系列文章介绍
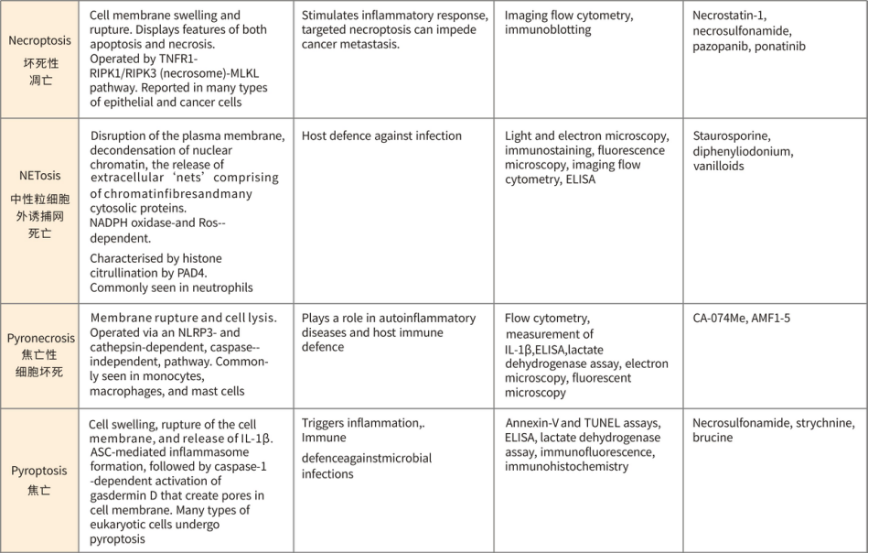
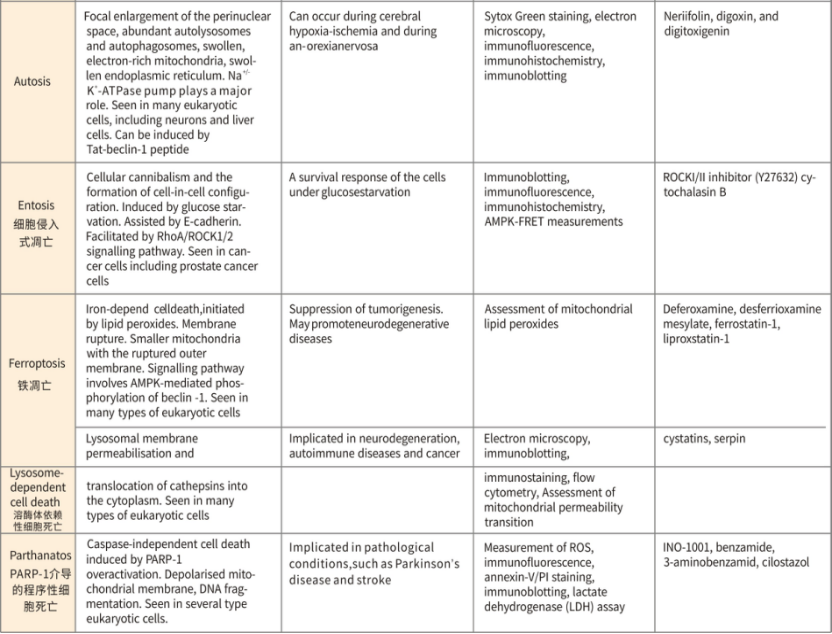
不同死亡形式的比较(形态、特征、检测方法、抑制剂)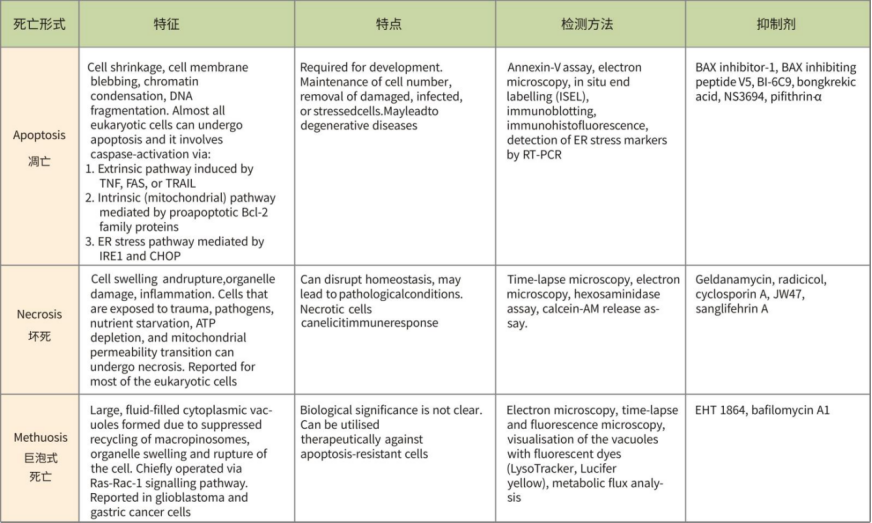
上海优宁维生物科技股份有限公司
试剂 | 耗材 | 仪器 | 软件 | 定制 | 实验服务 | 供应链
免费热线:4008-168-068
咨询邮箱:info@univ-bio.com
订购商城:www.univ-bio.com
微信公众平台:优宁维抗体专家,欢迎关注!
小优博士(小程序):5大课堂, 让你的科研不再难!









 危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)
危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)  营业执照(三证合一)
营业执照(三证合一)