(高分文献解读)
Nature:自噬促进胰腺癌免疫逃逸的机制
自噬是一种自我消化机制,其中细胞质材料、蛋白质(在通常定义为巨自噬的途径中)、受损的细胞器,如线粒体(称为线粒体自噬)和脂质被隔离到称为自噬体的囊泡中,以进行降解和回收。在基础条件下,自噬对于维持细胞稳态至关重要,充当蛋白质/细胞器质量控制机制;在饥饿、缺氧和化疗/放疗等压力条件下,它反而是癌细胞存活和适应肿瘤微环境扰动的基础。细胞自噬的过程包括:自噬的诱导阶段、成核过程、自噬体延伸阶段、自噬体成熟阶段、自噬体裂解阶段(如下图所示)。
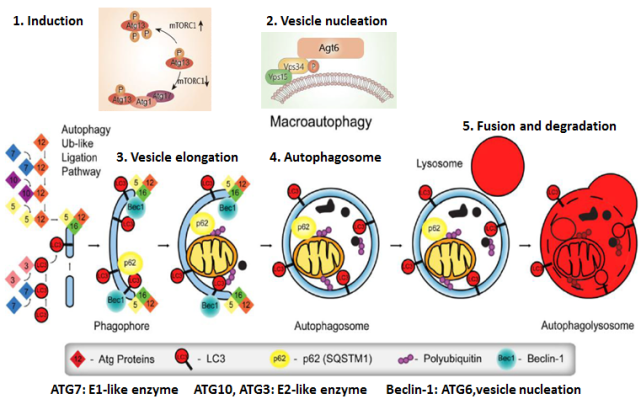
自噬和线粒体自噬作为双峰过程在癌症中起作用,其差异功能严格取决于癌症的发生、进展和类型。例如,它们可以通过帮助癌细胞在压力下存活来促进癌症进展,或者当发生突变或异常时,通过影响细胞信号传导或促进细胞内毒性来诱导致癌作用。出于这个原因,癌症中自噬的研究是许多研究人员的主要焦点,并且一些临床试验已经在进行中以操纵自噬并通过这种方式确定疾病治疗的结果。近年来,自噬在癌症中的作用越来越受到关注,并且人们越来越关注将该过程作为癌症治疗方法。
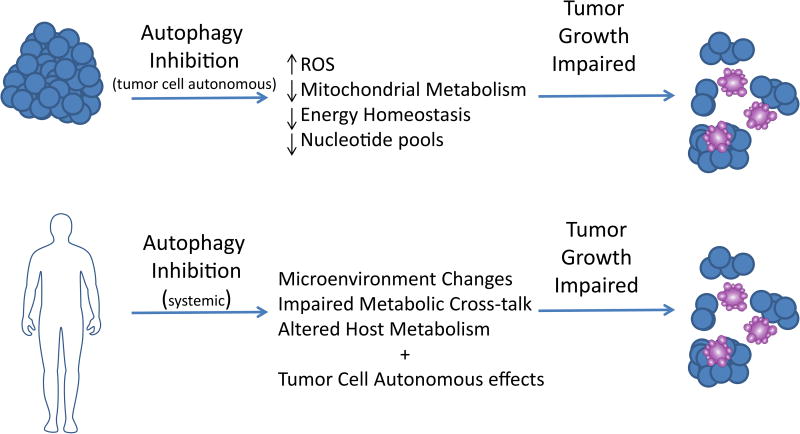
自噬与肿瘤机制图
今天解读的文章来自Nature一篇高分文献,题为“Autophagy promotes immune evasion of pancreatic cancer by degrading MHC-I”,该文章研究发现在PDAC(胰腺导管腺癌)细胞中,MHC-I(组织相容性复合体I类)在细胞膜上表达减少,主要富集于胞内自噬体和溶酶体中,并证明了自噬可以帮助MHC-I在溶酶体中降解,进而帮助PDAC细胞发生免疫逃逸。
话不多说,赶紧和小优一起解读文章吧,内容很多,全是干货,有需要的老师可以先收藏哦!

1. MHC-I富含自噬体和溶酶体
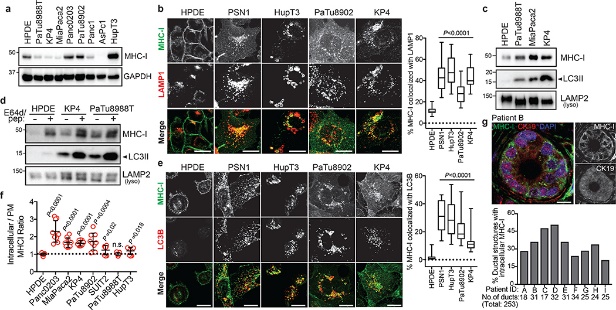
图1
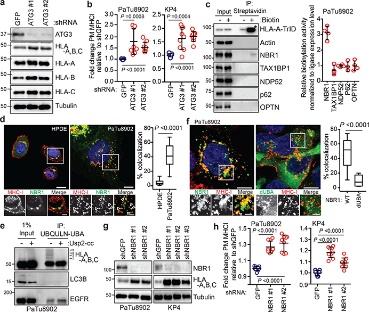
图2
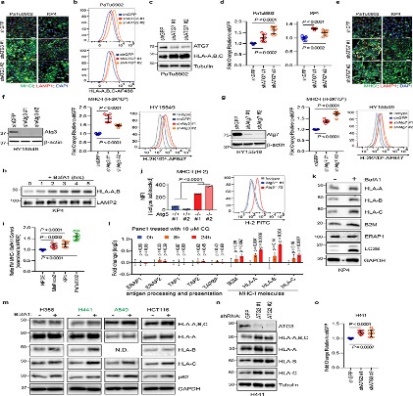
图3
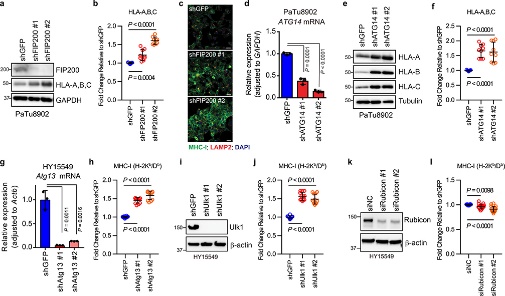
图4
作者通过未转化的人胰腺导管上皮 (HPDE)细胞和PDAC细胞,采用蛋白免疫印迹,免疫荧光和流式细胞仪技术等实验技术,对MHC-I进行分析,同时构建PDAC 12基因工程小鼠模型 (GEMM)并对模型中PDAC细胞的表面MHC-I进行实验分析,结果表明:
(1)MHC-I富含PDAC细胞的溶酶体,并显示出细胞表面表达降低(图1)。
(2)MHC-I在KRas突变癌症中的异质分布(图2)。
(3)自噬和溶酶体抑制可恢复 MHC-I 水平和质膜定位(图3)。
(4)抑制巨自噬,而不是 LAP/LANDO,可恢复MHC-I水平(图4)。
2. NBR1介导MHC-I的选择性自噬
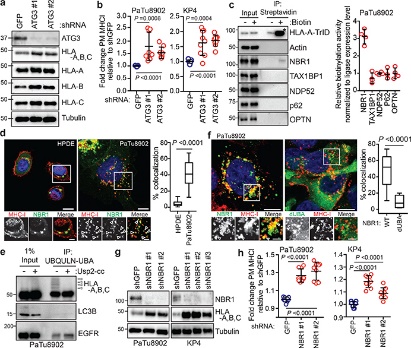
图5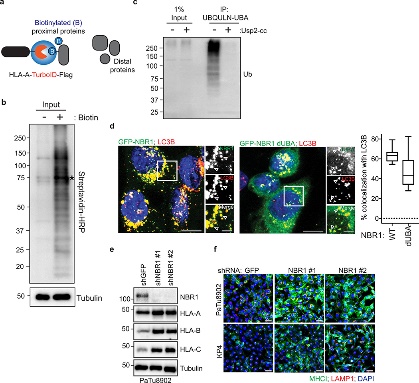
图6
研究表明,自噬可以使用自噬货物受体蛋白选择性降解靶分子,这些受体蛋白结合并招募自噬体膜的底物。为了鉴定 PDAC 细胞中参与 MHC-I 降解的自噬受体蛋白,作者进行了邻近生物素化测定,其中 HLA-A 与生物素连接酶 TurboID (TrID)和 Flag (HLA-A- TrID) 融合。添加生物素后,HLA-A-TrID 会用生物素共价标记连接酶几纳米范围内的内源性蛋白质,并采用蛋白免疫印迹和荧光技术对HPDE细胞和PDAC 细胞中 NBR1和 MHC-I分析。结果表明:
(1) NBR1 通过自噬依赖性途径促进 MHC-I 运输至溶酶体(图5)。
(2) NBR1的UBA结构域与MHC-I 相互作用(图6)。
3. 自噬抑制增强抗肿瘤免疫
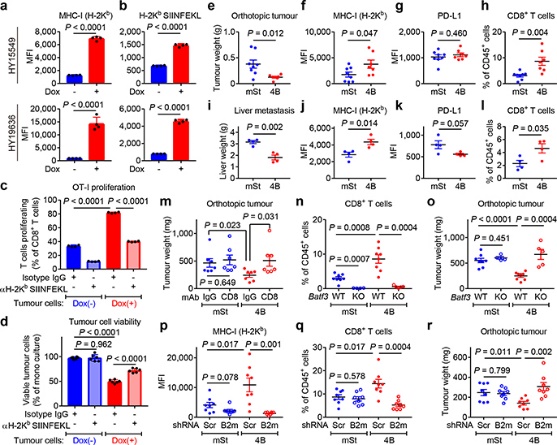
图7
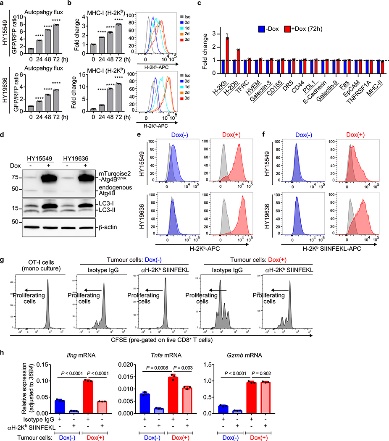
图8
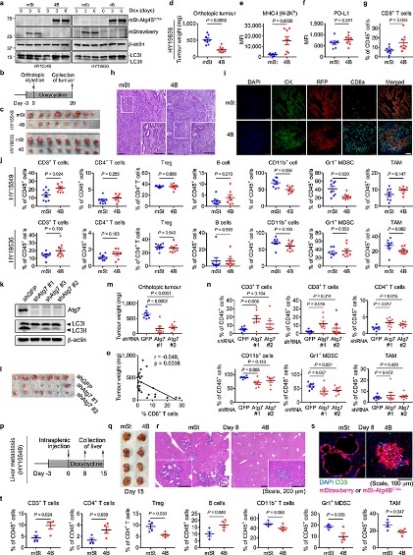
图9
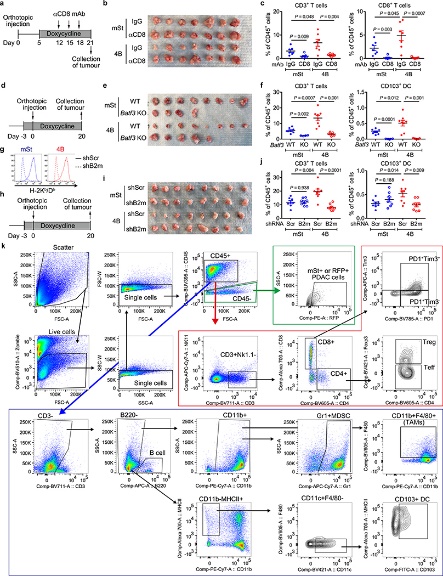
图10
CD8+细胞毒性T细胞在抗肿瘤免疫中起关键作用。为了验证这一事实,作者使用源自C57Bl/6小鼠的小鼠 PDAC 细胞并对其进行工程改造,以表达强力抑制自噬12、19 的Atg4B的强力霉素(Dox)诱导型显性失活突变体 ( Atg4BC74A)。同时为了测试自噬抑制对体内抗肿瘤免疫反应的影响,表达 Dox 诱导型 mStrawberry (mSt) 或 mSt- Atg4B C74A (4B) 的小鼠 PDAC 细胞(扩展数据 图 6a) 被原位移植到同基因 (C57BL/6) 小鼠中。最后,为了证实自噬抑制后 MHC-I 表达增加对体内肿瘤生长的影响,细胞表面 MHC-I 通过敲低 MHC-I 复合物的关键成分 beta-2 微球蛋白 (B2m) 耗尽。通过不同处理和试验方法,最终结果表明:
(1) 自噬抑制增强抗肿瘤 T 细胞反应(图7)。
(2) 自噬抑制恢复 MHC-I 表达,导致体外抗肿瘤 T 细胞反应增强(图8)。
(3) 自噬抑制调节原位肿瘤和肝转移中的抗肿瘤免疫(图9)。
(4) 自噬抑制后的肿瘤消退通过CD8+T细胞的消耗或细胞表 MHC-I的消融来挽救(图10)。
4. 基础自噬决定免疫原性
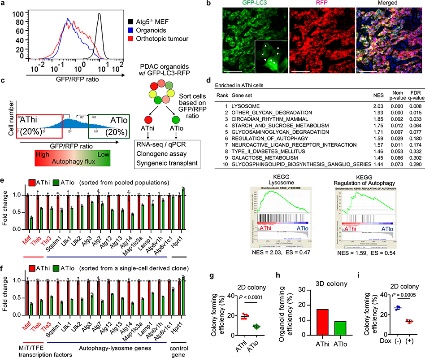
图11
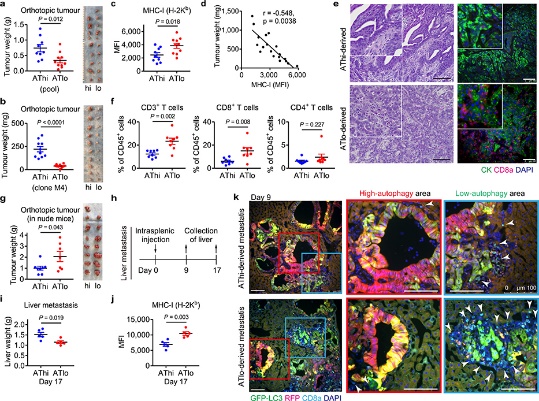
图12
自噬通量可能决定 PDAC 细胞的免疫原性,为了加以验证,作者生长为类器官的小鼠 PDAC 细胞为实验材料进行分析。同最低和最高20% GFP/RFP比率的PDAC 细胞被分离为自噬高(AThi)和低(ATlo)细胞。并对其实验分析,结果表明:
(1) 使用GFP-LC3-RFP分离具有不同自噬通量的PDAC细胞(图11),表明基础自噬通量的多样性不是来自遗传变异,而是来自自噬/溶酶体基因程序的异质表达(图11)。
(2) 基础自噬通量决定了PDAC细胞的免疫原性(图12).
5. 自噬抑制使PDAC对双重ICB敏感

图13

图14
PDAC对免疫检查点阻断 (ICB)无效。为了测试自噬抑制是否可能使PDAC对ICB敏感,作者用单独的抗PD-1抗体或双重ICB(抗 PD-1/CTLA4抗体)治疗已建立的同基因原位肿瘤。并且为了评估全身自体吞噬抑制发现使用氯喹(CQ)的可译性,临床上可用的抗疟药抑制溶酶体酸化已被用于抑制自噬在患者。治疗溶酶体抑制剂CQ或BafA1增加在小鼠PDAC细胞表面MHC-I水平在体外。进行实验验证分析。结果证明:
(1) 自噬抑制使PDAC对双重ICB 敏感(图13)。
(2) 自噬抑制与双重ICB协同作用(图14)。
结论
MHC-I在PDAC细胞中的空间差异性表达,即MHC-I在包膜上表达减少而富集于自噬体和溶酶体中,联想到PDAC免疫逃逸现象和对ICB治疗不敏感,进而证明了自噬可以帮助MHC-I在溶酶体中降解,帮助PDAC细胞发生免疫逃逸。自噬是细胞的一种重要的自我保护机制,自噬抑制的抗肿瘤作用通过消耗 CD8 +T 细胞或减少表面 MHC-I 表达。自噬抑制,无论是在基因上还是在药理学上与氯喹 (CQ) 一起,与双重 ICB(抗 PD1 和抗 CTLA4)协同作用,并导致增强的抗肿瘤免疫反应。研究结果揭示了通过选择性靶向 MHC-I 分子进行降解,增强自噬/溶酶体功能在免疫逃避中的作用,并为自噬抑制和双重 ICB 组合作为针对PDAC的治疗策略提供了基本原理。
自噬在癌症中起着复杂的作用,但自噬抑制可能是晚期癌症的有效治疗策略。对肿瘤微环境中自噬的更深入了解促进了新型抑制剂和临床试验策略的开发。确定最有可能从这种方法中受益的患者仍然存在挑战和机遇。
本文涉及部分相关产品:
| 货号 | 产品名称 |
| 5174S | GAPDH (D16H11) XP® Rabbit mAb |
| 9091S | LAMP1 (D2D11) XP® Rabbit mAb |
| 3415S | Atg3 Antibody |
| 8558S | Atg7 (D12B11) Rabbit mAb |
| 8054S | ULK1 (D8H5) Rabbit mAb |
| 8465S | Rubicon (D9F7) Rabbit mAb |
| 5114S | SQSTM1/p62 Antibody |
| 85336S | CD8α (D8A8Y) Rabbit mAb #85336 |
| 2775S | LC3B Antibody |
| 4413S | Anti-rabbit IgG (H+L), F(ab')2 Fragment (Alexa Fluor® 555 Conjugate) #4413 |
| 4414S | Anti-rabbit IgG (H+L), F(ab')2 Fragment (Alexa Fluor® 647 Conjugate) |
| 563123 | BD Horizon™ BV711 Hamster Anti-Mouse CD3e |
| 553092 | BD Pharmingen™ APC Rat Anti-Mouse CD45R/B220 |
| 552850 | BD Pharmingen™ PE-Cy™7 Rat Anti-CD11b |
| 557661 | BD Pharmingen™ APC-Cy™7 Rat Anti-Mouse Ly-6G and Ly-6C |
| 743281 | BD OptiBuild™ BV605 Rat Anti-Mouse F4/80 |
| 565451 | BD Horizon™ BV421 Armenian Hamster Anti-Mouse CD11c |
| 557494 | BD Pharmingen™ FITC Rat Anti-Mouse CD103 |
| NB100-220 | LC3B Antibody |
| 5299S | Atg4B Antibody |
| BE0207 | InVivoMab anti-mouse MHC Class I (H-2Kb) bound to SIINFEKL peptide (OVA residues 257-264) |
| BE0083 | InVivoMab mouse IgG1 isotype control |
| 04-418Q | X-VIVO 15 with Gent L-Gln, Phen Red, 1 L |
| LT07-518 | MYCOALERT ASSAY CONTROL SET-10 TESTS |
| abs955 | 免疫(共)沉淀(IP/CoIP)试剂盒 |
| abs9161 | 广谱型蛋白酶抑制剂混合物 |
| abs9229 | RIPA裂解液 |
| abs152809 | Rabbit anti-TAX1BP1 Polyclonal Antibody |
| NB100-690APC | alpha Tubulin |
| abs971 | PBS |
| abs9450 | Trypsin |
| abs47048003 | 胶原酶 Ⅳ型 |
| C5138-1G | Collagenase from Clostridium histolyticum release of physiologically active rat hepatocytes tested, Type IV |
| LS004186 | Collagenase, Type 4 |
| 17089102 | Percoll |
| abs930 | Lymphocyte Separation Medium(human,Ficoll-Paque ) |
| 3533-001-02 | Cultrex®RGF BME, Type 2 |
| 12-719Q | DMEM/F12 |
| 2028-EG | Mouse EGF |
| 7150-RS | Mouse R-spondin1 |
| 1324-WN | Mouse Wnt3a |
| 6997-NG | Mouse Noggin |
| 3533-005-02 | Cultrex®RGF BME, Type 2 |
| SHC202 | MISSION(R) TRC2 pLKO.5-puro Non-Mammalian shRNA Control Plasmid DNA Targets no known mammalian genes |
| L-023538-01-0005 | ON-TARGETplus Human RUBCN siRNA |
| D-001810-10-05 | ON-TARGETplus Non-targeting Pool |
| D-001830-10-05 | ON-TARGETplus GAPD Control Pool |
| T-2001-02 | DharmaFECT 1 Transfection Reagent |
| RHS4430-200239899 | GIPZ Lentiviral Human ATG3 shRNA |
| RMM4431-200355199 | GIPZ Lentiviral Mouse Atg3 shRNA |
| RHS4430-200184031 | GIPZ Lentiviral Human ATG7 shRNA |
| RMM4431-200323137 | GIPZ Lentiviral Mouse Atg7 shRNA |
| RHS4430-200206246 | GIPZ Lentiviral Human NBR1 shRNA |
| RHS4430-200189573 | GIPZ Lentiviral Human FIP200 shRNA |
| RHS4430-200198072 | GIPZ Lentiviral Human ATG14 shRNA |
| RMM4431-200323150 | GIPZ Lentiviral Mouse B2m shRNA |
| RMM4431-200352002 | GIPZ Lentiviral Mouse Atg13 shRNA |
| RMM4431-200346705 | GIPZ Lentiviral Mouse Ulk1 shRNA |
| RHS4371 | GIPZ GAPDH Lentiviral shRNA Positive Control |
| RHS4346 | GIPZ Non-silencing Lentiviral shRNA Control |
| RHS4349 | GIPZ Lentiviral Empty Vector shRNA Control |










 危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)
危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)  营业执照(三证合一)
营业执照(三证合一)