叮叮叮,一年一度备受关注的诺贝尔奖, 已于2021年10月4日公布了。瑞典卡罗琳医学院宣布, 将2021年诺贝尔生理学或医学奖授予David J. Julius和Ardem Patapoutian, 以表彰他们在痛觉和触觉领域研究方面所作出的贡献。

2021年生理学或医学奖得主 |(来源:诺贝尔奖官网)
● David Julius 教授通过分析辣椒素如何激活疼痛感觉神经细胞,发现了一个新的离子通道蛋白TRPV1。随后David Julius和研究人员合作解析了在寒冷情况下会被激活的离子通道TRPM8蛋白的结构。
● Ardem Patapoutian教授使用压敏细胞发现了一类新型传感器,可以对皮肤和内部器官中的机械刺激做出反应。至此,一种全新的、完全未知的机械敏感离子通道Piezo1被发现,而后,第二个相关的基因Piezo2被发现 。
本次小优通过两位诺贝尔奖得主David Julius 和Ardem Patapoutian的两篇文章跟大家一起解析人体的传感系统。


本文通过分析辣椒素如何引发我们接触辣椒时感受到的灼烧感,揭示了疼痛通路中的热激活离子通道:辣椒素受体(TRPV1)的存在。
下一期:小优将带来另一篇诺贝尔获得者David Julius发表在“Neuron”上面关于TRPV1通路研究的解析,实验设计非常精妙和有趣。敬请期待~
引言
辣椒素是辣椒的天然产物,也是许多辛辣食物的原料药。在哺乳动物中,接触辣椒素的痛觉受体末梢,最初导致神经元兴奋,随后感到疼痛和局部释放炎症调节物。
电生理和生化研究表明,辣椒素通过增加细胞膜对阳离子的通透性而使伤害性神经元兴奋。建立模型疏水性辣椒素分子对膜脂类的直接干扰到感觉神经元上或感觉神经元内特定受体的激活。
由于辣椒素衍生物表现出结构-功能关系,并以剂量依赖的方式引起反应,受体位点的存在,代表了最可能的机制。Capsazepine是一种具有竞争力的辣椒素拮抗剂,它模拟了辣椒素的细胞作用,进一步加强了这个模型的假设。
对于辣椒素作用的分子本质及其与内源性疼痛信号机制的关系,可以通过克隆一个编码辣椒素受体的基因来获得更详细的理解。使用功能性筛选方法来分离一个辣椒素受体基因cDNA克隆,这个克隆推导出的氨基酸序列表明,这个辣椒素受体是一个膜内蛋白,与钙通道家族具有同源性。
克隆的受体似乎只在感觉神经节内的小直径神经元中表达,为辣椒素作用的显著选择性提供了明确的分子解释。这种受体也是一种热传感器,当环境温度升高到已知的能引起疼痛相关行为的范围时,这种热传感器会被强烈激活。
因此,辣椒素通路激活可能有助于在体内检测疼痛热刺激的热阀门离子通道而引起燃烧感觉。
辣椒素受体基因cDNA的克隆
从背根神经节衍生的RNA中构建了一个cDNA文库。这个文库被细分为大约16,000个克隆,每个克隆池转染人类胚胎肾源性HEK293细胞。
用荧光钙敏感染料Fura-2染细胞,并用显微镜观察细胞内钙水平的变化(图1)。最终获得了一个含有3kb cDNA克隆,这个克隆本身就赋予了转染HEK293细胞的辣椒素或树脂类毒素敏感性。
由于辣椒素和树脂类毒素结构的基本化学成分是香草酸盐,当时Julius和他们的团队把这个新的克隆命名为VR1(香草酸受体),也就是我们现在熟知的TRVP1。
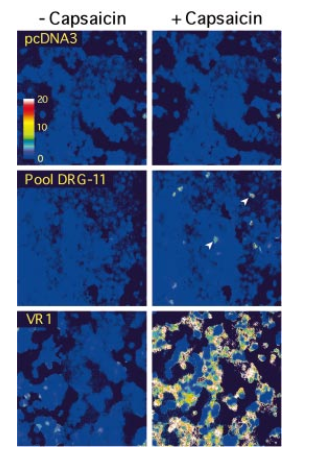
图1:Expression cloning of a capsaicin receptor using calcium imaging
VR1和香草酸受体药理学分析
在非洲爪蟾卵母细胞中表达VR1,并用全细胞电压钳分析法定量研究香草酸受体激动剂和拮抗剂对电生理反应的影响。
在保持负电位时,接触辣椒素或树脂毒素会在表达VR1的卵母细胞中产生剂量依赖性内向电流反应,而在注水对照细胞中则不会(图2a)。同时辣椒素诱发的反应在VR1表达细胞中被竞争性的香草酸受体拮抗剂辣椒碱可逆地阻断,浓度IC50=283.5nm时抑制天然受体。
香草酸受体对非竞争性拮抗剂钌红的敏感性,这种敏感性阻断了辣椒素受体的可逆反应(图2b),对树脂毒素(50nm)的反应也可逆地被辣椒碱(5 uM)或钌红(10 uM)拮抗。
从几个辣椒品种中获得乙醇提取物,并在卵母细胞表达系统中测定其与辣椒素饱和剂量(10uM)相关的效价(图2c) ,实验结果发现这些辣椒变种的不同“辣度”,与它们作为VR1激活因子的等级顺序效应有关。

图2:VR1 responds to purified vanilloids and pepper extracts
- Activation of VR1 by capsaicin and resinferatoxin
- Antagonismbycapsazepine (cpz)and rutheniumred (RR),
- Responses to capsaicin (10 mM) and extracts derived from four varieties of peppers in oocytes
- expressing VR1 (30s application))
VR1离子通道具有较高的钙离子渗透率
对转染表达VR1的哺乳动物细胞进行了一系列的膜片钳实验。在整个细胞结构中,VR1转染的HEK293细胞表现出强烈的内向电流反应(保持电位-60mV) ,这种反应在辣椒素溶液中进行时间较短。在无VR1转染载体的细胞中没有观察到这种电流。在无钙培养基中,无论是在恒定的 -60mV保持电位下,还是在-100mV到+40mV电压阶段内(增量为20mV),辣椒素诱发电流不随时间变化而变化。
电流变化,反映出辣椒素介导的反应肯定涉及阳离子选择性通道的打开,因此我们进行了一系列的离子置换实验,以检测不同阳离子对辣椒素诱发电流在 VR1表达细胞中的相对贡献。不同阳离子成分的溶液中的细胞所建立的电流-电压关系表明 VR1不区分单价阳离子,但对二价阳离子表现出明显的偏好。渗透顺序: Ca2+ >Mg2+ >Na+≈K+≈Cs+)。

图3. VR1 is a calcium-permeable, non-selective cation channel
VR1蛋白结构
VR1基因含有2514个核苷酸,编码838个氨基酸的蛋白质,相对分子质量为95000(Mr95k)(图5a)。亲水性分析表明 VR1含有6个跨膜结构域,在跨膜结构域5和6之间还有一个短的疏水性伸展(图5b)。氨基末端亲水段(432个氨基酸)含有一个相对富含脯氨酸的区域,其后是三个锚蛋白重复结构域。羧基端(154氨基酸)没有可识别的序列。
通过对蛋白质数据库的同源性检索,发现 VR1与钙通道家族成员(SOCs)之间存在显著的相似性,后者是果蝇视网膜蛋白TRP和TRPL的典型成员(图5c)。这个家族的成员已被认知介导细胞外钙离子进入细胞,以应对细胞内钙的消耗。这些蛋白质的拓扑结构与VR1相似,具有多个N端氨基酸重复的脯氨酸富集区,其次是三个氨基酸重复结构域。

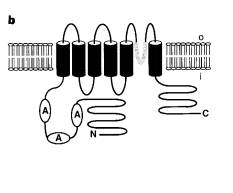

图5 VR1 resembles store-operated channels
- Predicted amino-acid sequence encoded by the vanilloid receptor cDNA VR1
- Predicted membrane topology and domain structure of VR1
- Alignment of VR1 with related sequences
感觉神经元特异性VR1表达
辣椒素作用的高度选择性表明辣椒素受体可以作为痛觉神经元的特异性分子标记。免疫印迹实验结果显示在三叉神经节和背根感觉神经节中VR1显著表达。免疫组织化学检,测VR1表达的细胞模式,实验表明,在背根和三叉神经节中,VR1主要表达在小直径的神经元亚群中。(图6)

图6:Vanilloid receptor expression is restricted to sensory neurons
毒热激活的VR1
探讨高温对 VR1活性的影响。将转染的 HEK293细胞在环境温度突然从22°C上升到45°C时进行荧光钙成像。此条件下,单独转染载体的细胞只表现出细胞质游离钙的轻微弥散变化。相反,大部分表达 VR1的细胞在二次热处理后钙含量明显增加(图7),这些实验结果表明VR1的表达也具有热敏感性和温度反应特性。
为了确定VR1是否能在不同的细胞环境中对热产生类似的反应,将这些研究扩展到卵母细胞系。在对照组,注水卵母细胞,急剧升高的灌注温度产生一个小的内向电流,线性增加到50°C。表达VR1的卵母细胞在高达40°C的温度下表现出相似的反应,但在这个阈值以上,它们的反应明显大于对照组。
因此,即使在这种非哺乳动物,VR1的表达也具有热敏感性和温度反应特性。药理实验也表明VR1直接参与了这种热反应: 施用钌红可以显著降低(88±2% ,n=5) VR1表达的卵母细胞对热的反应,而对照细胞的反应只减少了21±26% (n=5)。
综合起来,这些观察结果有力地支持了这样的假设: VR1是由有害的,有毒的热量所激活的。

图7:VR1 is activated by noxious thermal stimuli
质子是VR1的内源性调节剂
利用卵母细胞表达系统研究了氢离子对克隆香草酸受体的影响。在没有辣椒素的情况下,溶液PH突然从7.6降到5.5,结果显示VR1表达的卵母细胞中只有不到10% 表现出较大的内向电流,这表明氢离子沙龙不能有效地激活这种蛋白质。
接着评估降低PH 值对VR1对辣椒素反应性的影响,表达VR1的卵母细胞在 PH=7.6时接受次高浓度辣椒素处理(300nM)(图8)。一旦它们的当前反应达到一个相对稳定的平台,这些卵母细胞就会暴露在一种含有相同浓度辣椒素的溶液中(PH=6.3)。
在这些条件下,内向电流迅速增加到一个新的平台,比第一次大五倍。回到PH=7.6时,卵母细胞的反应减弱到最初的平台,去除辣椒素后又回到基线。这种增强只有在激动剂浓度低于饱和时才能观察到。这些结果表明,虽然单独的氢离子不足以激活VR1,但可以显著增强辣椒素诱发的反应,可能是通过增加辣椒素的效力。

图8 Hydrogen ions potentiate the effect of capsaicin on VR1
本文涉及部分相关产品(更多请联系我们)
|
货号 |
产品名称 |
|
Anti-TRPV1 (VR1) Antibody |
|
|
Anti-TRPM8 (extracellular) Antibody |
|
|
Capsaicin |
|
|
Resiniferatoxin |
|
|
jetPRIME® |
|
|
Attractene Transfection Reagent |
David Julius教授的研究揭开了感知温度的机制,但机械压力如何转化为人体触觉仍是未解之谜,另一位诺奖得主Ardem Patapoutian在2011年发表的文章帮我们解惑。


引言
已在许多细胞中记录了机械激活 (MA) 阳离子通道活动。Ardem Patapoutian和他的合作者们首先确定了一种细胞系,当用微量移液管戳碰单个细胞时,该细胞系会发出可测量的电信号。假设在这些细胞中被机械力激活的受体是离子通道,并鉴定编码可能受体的候选基因。他们将这些基因逐个敲除,以发现负责研究细胞机械敏感性的基因。
经过大量探索,成功地确定了一个基因,该基因的沉默使细胞对微量移液器的戳刺不敏感。至此,机械敏感离子通道被发现,并命名为Piezo1。而后,第二个相关的基因被发现并命名为Piezo2。
机械力感知蛋白(离子通道)Piezo1和Piezo2已被证明参与调控血压、呼吸和排尿等其他重要的生理过程。
细胞系的探索
为了鉴定参与机械转导的蛋白质,首先需要寻找一个表达类似于原代细胞中记录到的MA电流的细胞系,用压电驱动玻璃探针对细胞表面施加压力,同时用另一个移液管进行膜片钳全细胞记录,筛选了几个小鼠和大鼠细胞系(Neuro2A,C2C12,NIH/3T3,Min-6,50B11,F11,PC12)。
实验结果(图1)表明Neuro2A细胞系表达出跟原代细胞最一致的MA电流,相比其他细胞系,Neuro2A细胞系表现出相对较快的适应动力学(对持续刺激的反应活性降低)。
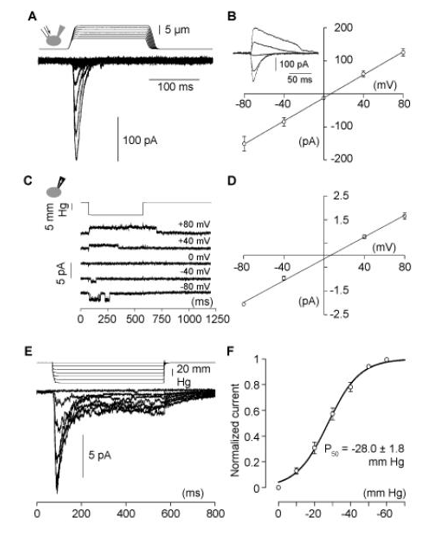
图1:Mechanically-activated currents in Neuro2A cells
Piezo1蛋白的发现
富集N2A细胞系中的转录本,进行了优先排序后,使用 siRNA 敲除测试每个N2A候选细胞,在压电驱动的压力刺激下测量并观察敲除基因后的细胞MA电流衰减情况,再用qPCR 测定目标转录本的丰度。
实验结果表明将FM38A (序列相似性为38的家族)敲除后,可以显著减少MA电流(图2)。由此假设 FM38A编码一种蛋白质,用于表达被压力激活的离子通道,并把这个基因命名为Piezo1。

图2:Suppression of mechanically-activated currents by Piezo1 (Fam38A) siRNA
Piezos是一种大型跨膜蛋白,在不同物种中保守。许多动物、植物和其他真核生物都含有Piezo通路。Piezo蛋白的二级结构和总长度是中度保守的,与其他蛋白的相似性极小。
据Transmembrane Hidden Markov Model prediction program分析,所有Piezo蛋白都有24到36个预测的跨膜结构域,预测蛋白含有2100至4700个氨基酸。在膀胱、结肠、肾脏、肺和皮肤中观察到Piezo1和Piezo2表达,但Piezo2在肾脏和皮肤中的表达较少。
Piezo1和Piezo2诱导MA电流
Piezo1在不同类型的细胞中诱导 MA电流,克隆N2A细胞中Piezo1基因到pIRES2-EGFP载体中,在转染12-48小时后,在全细胞模型中记录了绿色荧光蛋白(GFP)阳性细胞的 MA电流。
在N2A、HEK293T和 C2C12细胞系中,Piezo1过表达,MA电流-电压关系与内源性N2A细系中MA电流相似。用离子选择性的方法研究了Piezo1过表达的三个细胞系内MA电流的离子选择性,我们发现激活阈值和失活的时间常数是相似的. Piezo1在 N2A和 HEK293T 细胞中的过度表达可以被 -60mmHg 压力脉冲诱发大电流刺激(图3)。
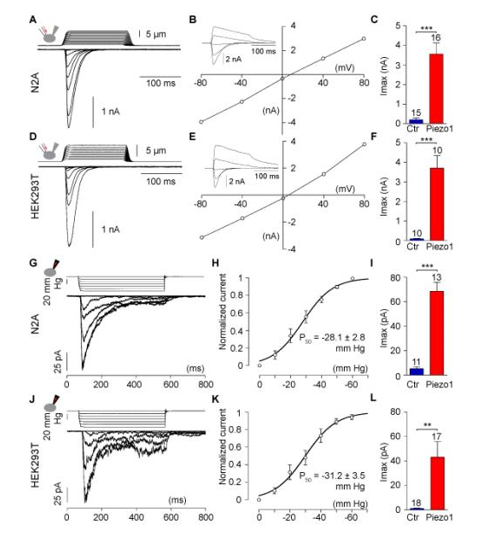
图3. Large mechanically-activated currents from cells overexpressing Piezo1
同样方法检测Piezo2过表达细胞中的MA电流变化,结果显示在 N2A、HEK293T细胞系中,都有较大的MA电流,在N2A细胞系中,同时共转染Piezo1 siRNA来抑制内源性MA电流,结果显示MA电流电压在-80和 +80mV之间呈线性关系。
Piezo2依赖型电流受到NMDG抑制,而非选择性阳离子导电。此外,无论是内向电流还是外向电流,Piezo2依赖性MA电流的失活动力学都比Piezo1依赖性MA电流快,并且在所有保持电位都被测试。
因此,Piezo1和Piezo2赋予了不同的通道特性。(图4)

图4:Piezo2-dependent large mechanically-activated currents kinetically distinct from Piezo1-induced currents
DRGs神经元中Piezo2重要性
用成年小鼠DRG切片做免疫组化实验,结果表明20%的DRG神经元表达Piezo2 mRNA(共2391个神经元)。Piezo2的表达与伤害性标记物 TRPV1(24%)的重叠,进一步提示了Piezo2在伤害性机械感觉中的潜在作用。
用 siRNA 转染来检测Piezo2在DRG神经元MA电流中的作用。通过记录了转染GFP 的DRG 神经元细胞以及Piezo2 siRNA干扰的细胞中MA 电流。根据失活动力学,对记录的电流进行了分组。
根据干扰siRNA转染细胞中τinac的分布,定义了4种不同类型的神经元: τinac < 10ms,10 < τinac < 30,τinac > 30ms和无反应神经元。τinac< 10ms 的神经元表达MA电流的比例明显低于Piezo2 siRNA转染的神经元表达MA电流的比例。在Piezo2 siRNA转染的细胞中,神经元以正常比例呈现动力学较慢的电流(图5)。
观察到在表达Piezo2 siRNA的人群中,机械不敏感神经元数量增加的趋势,如果Piezo2 siRNA丧失能够将快速适应的神经元转化为无反应的神经元。根据150ms测试脉冲中电流失活的程度分析了这些RNAi数据,得出了类似的结论。

图5 Sensitivity of fast-inactivating MA currents in DRG neurons to depletion of Piezo2
小结
研究发现Neuro2A 细胞的MA电流需要Piezo1,而DRG神经元的MA 电流子集需要Piezo2。此外,在三种不同的细胞类型中过度表达Piezo1或Piezo2会使毫安电流增加17ー300倍。
得出结论:Piezos是各种细胞类型中表达MA电流必要和充分条件。Piezo通道的突破性发现,使人们对身体各个部位的位置和运动有了知觉。
本文涉及部分相关产品(更多请联系我们)
|
货号 |
产品名称 |
|
Anti-Piezo1 Antibody |
|
|
Anti-Piezo2 Antibody |
|
|
SKF 96365 hydrochloride |
|
|
GlyT2-IN-1 |
|
|
DharmaFECT 1 Transfection Reagent |
|
|
ON-TARGETplus PIEZO1( Human )siRNA Reagents |
|
|
ON-TARGETplus PIEZO2( Human )siRNA Reagents |
好的研究依赖于稳定高质量的试剂, Alomone离子通道专家(优宁维独家代理)多年来一直为离子通道研究提供稳定可靠的抗体,小分子化合物等。除了试剂,离子通道研究另一个不可或缺的工具就是—全自动膜片钳。








