【罗工流式宝典第2式】小鼠高血压模型(主动脉、肾脏组织)中Th细胞的鉴定
时间:2021-10-27 16:11:23 浏览次数:326
T淋巴细胞在几种心血管疾病的发展中都起着关键作用。研究表明,高血压与其发展过程中血管和肾脏中T细胞的过度积累有关。T细胞具体很多不同的亚群,则由其表面不同的标记物、分泌的细胞因子以及它们表达的转录因子的组合来区分的。
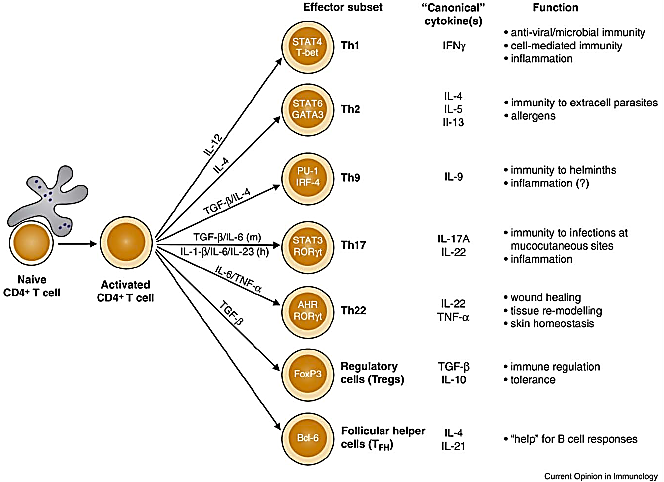
常见T细胞亚群
当表面指标已经不足以来识别区分我们实验目的的亚群时,我们的实验设计就会涉及到胞内染色,而胞内细胞因子类的marker需要体外刺激和固定破膜方可完成,接下来以小鼠的肾脏和主动脉组织样本为例,细说从特殊组织的单细胞悬液制备到流式胞内染色的详细步骤 :
实验前准备
|
组织单细胞悬液制备 |
流式染色 |
|
1. RPMI培养基、血清、胶原酶、DNA酶、双抗、L-谷氨酰胺、2-巯基乙醇、PBS 2. 40μm滤器 3. 密度梯度离心试剂 4. 剪刀、镊子、注射器
|
1. 细胞因子分泌刺激阻断剂 2. 固定破膜试剂盒 3. 相关鉴定指标抗体 4. 死活染料 5. FcR阻断剂 6. FACS 缓冲液 |
1.小鼠组织样本的获取与制备
a. 获取组织样本
①通过让小鼠吸入二氧化碳实施安乐死。用70%的乙醇喷洒胸部,用剪刀小心的剪开皮肤和胸壁,让心脏暴露出来;
②为了灌洗血管系统,在右心房做一个小切口,使用21或23 G针稳定地向左心室顶端注射至少10 mL预冷的PBS(约1 mL/s)。直到所有的器官都变白。当肝脏变白时便表明灌洗效果良好;
③用小钳子和细剪刀,轻轻切出肠、胃、脾脏、胰腺和肝脏,以更好地观察主动脉。注意:这一步骤必须非常精确地完成,因为胃肠道的损伤会引起污染;
④用剪刀剪下并移除出每一个肺。使用无针注射器,用磷酸盐缓冲盐水(PBS)冲洗胸腔。用无菌纱布去除多余的血液和液体;
⑤用精细解剖钳切除腹主动脉引流淋巴结。确保不要使囊泡破裂。用解剖钳去除每个淋巴结表面的剩余脂肪。然后用细剪刀剪出两个肾脏;
⑥用精细、弯曲的剪刀切除整个主动脉(胸主动脉和腹主动脉)。从心脏开始小心地从食道和椎骨向下解剖到髂骨分叉处,并确保血管的周围脂肪附着在主动脉上。
注:可以在显微镜下进一步解剖主动脉以切除周围结构。具体来说,切除动脉分支(颈动脉、锁骨下动 脉、乳糜泻、肠系膜和肾动脉)和淋巴结。一定要在每个主动脉周围保持一层一致的血管周围脂肪,因为 这是高血压环境中许多炎症细胞所在的部位。将每个组织放置在含有预冷PBS的单独试管中。

小鼠解剖肉眼外观
b. 肾脏单细胞悬液制备
①制备肾脏组织消化液:在RPMI1640培养基中加入胶原酶D(2 mg/mL)和DNA酶I (100 µg/mL);
②解离组织:将小鼠2个肾脏剪碎,转移至含10 mL组织消化液的离心管中,37ºC旋转孵育20 min。后立即加入含5%血清的预冷的RPMI1640培养基来停止酶消化;
注:有条件的科室可结合Gentle Macs仪器进行研磨,效果更佳
③使用注射器黑色柱塞进行研磨,并通过40 μm细胞过滤器过滤,用2 mL 2% RPMI培养基冲洗。
④滤液,300 g 离心8 min(4ºC),获得单细胞沉淀;
⑤将沉淀用3 ml 36%密度的梯度离心介质重悬。将悬浮液轻轻的连续转移到一个含有3 ml 72%密度梯度离心介质的15 ml锥形离心管中(注意保持分层明显)。1000 g离心20 min(无制动,4°C);
⑥免疫细胞将位于分界面上。去除最顶部含有细胞碎片的黄色层,然后用预冷的PBS将体积补充至15 ml。上下颠倒摇匀。离心300 g,8 min(4°C),
⑦用适量含有5%血清的RPMI重悬颗粒细胞,等待后续实验。使用台盼蓝排除法通过细胞计数仪计算总寄细胞及活细胞的数量。
c. 主动脉单细胞悬液制备
①制备主动脉消化液:在RPMI1640培养基中加入胶原酶A(1 mg/ml)、胶原酶B(1 mg/ml)和DNaseI(100 µg/ml);
②用细钳将主动脉转移到含有1 ml主动脉消化溶液的离心管中。用细剪刀在1 ml消化液中将整个主动脉切成非常小的块,期间保持在冰上预冷状态。以37°C连续旋转孵育30 min;
③将溶液转移到组织培养皿中,加入5倍体积的预冷的5%血清RPMI停止酶消化;
④通过40 µm过滤器过滤后,将溶液移液转移到50 ml锥形管中。用1 ml注射器的黑色柱塞研磨按压,将剩余的组织分离成单个细胞悬液,冲洗滤清器,滤液300 g 离心8 min(4ºC),获得单细胞沉淀;
⑤用5%血清10 ml RPMI重悬沉淀,300 g离心8 min(4°C),在含有5%血清的RPMI中重悬,等待后续实验。后续实验前使用台盼蓝排除法通过细胞计数仪计算总细胞及活细胞的数量。
2. T细胞流式检测
a.体外刺激
①培养基制备:每1 mL细胞培养中加入2 µl的刺激阻断剂(含有Phorbol 12-Myristate 13-Acetate (PMA)、钙离子载体离子霉素和高尔基抑制剂BrefeldinA(BFA))(BD货号:550583)来刺激细胞;
②组织单细胞悬液,以1×106 cells/mL的密度重悬于培养基中(12或24孔板),在37度培养箱中培育4-6 h;
③将细胞转移到流式管中,然后进行离心收集(300 g,8 min,4°C)。用无钙镁离子的1×PBS缓冲液洗涤细胞两次,等待后续检测;
b. 表染和胞内染色
①1000 µl的1X PBS重悬细胞沉淀。加入1 µl FVS氨基染料(死活染色),室温孵育15 min;。
②用1-2 mL的FACS缓冲液(无钙镁离子的PBS加入4%血清和2 mM的EDTA)洗涤细胞,离心 (300 g,8 min,4°C),每106/100 µl细胞添加0.5 µg抗cd16/CD32抗体(FcR阻断剂),室温孵育10 min,以阻断Fc受体;
③取适当体积表面抗体,4°C下孵育30min;
④用2mL FACS缓冲液洗涤细胞两次,离心(300g,8min,4°C)去上清;
⑤按照制造商的说明书,使用固定破膜试剂盒进行细胞破膜,通过在适当的(通常每管100µl)试剂盒配套缓冲液中重悬细胞来进行胞内抗体染色,4°C下孵育40min,并按说明书步骤进行细胞洗涤;
⑥然后离心(500g,8min,4°C)去上清。用适当的(通常每管300µl)的FACS缓冲液重悬,并使用流式细胞仪中合适的通道进行分析。


圈门思路及部分细胞因子染色结果示例图
参考文献
[1] Laroumanie F , Dale B L , Saleh M A , et al. Intracellular Staining and Flow Cytometry to Identify Lymphocyte Subsets within Murine Aorta, Kidney and Lymph Nodes in a Model of Hypertension[J]. Journal of Visualized Experiments : JoVE, 2017, (119).
[2] Mohamed, A, Saleh, et al. Lymphocyte adaptor protein LNK deficiency exacerbates hypertension and end-organ inflammation.[J]. Journal of Clinical Investigation, 2015.
[3] Madhur M S , Lob H E , Mccann L A , et al. Interleukin 17 Promotes Angiotensin II–Induced Hypertension and Vascular Dysfunction[J]. Hypertension, 2010, 55(2):500-507.
[4] Laroumanie F , Douin-Echinard V , Pozzo J , et al. CD4(+) T Cells Promote the Transition From Hypertrophy to Heart Failure During Chronic Pressure Overload[J]. Circulation, 2014, 129(21).
上海优宁维生物科技股份有限公司
试剂 | 耗材 | 仪器 | 软件 | 定制 | 实验服务 | 供应链
免费热线:4008-168-068
咨询邮箱:info@univ-bio.com
订购商城:www.univ-bio.com
微信公众平台:优宁维抗体专家,欢迎关注!
小优博士(小程序):5大课堂, 让你的科研不再难!









 危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)
危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)  营业执照(三证合一)
营业执照(三证合一)