小G蛋白:Rac1和Cdc42通路——转移性癌症治疗未来风向标
小G蛋白,是具有GTP酶活性的一类蛋白,因其分子量只有20—30KD而得名。其家族成员在细胞信号通路中具有分子开关的功能,并参与调控许多生物学过程,尤其在癌症研究领域中发挥着重要的作用。今天就带大家一起来了解小G蛋白Rho亚家族中的两个重要成员——Rac和Cdc42——旨在通过探索其对癌细胞转移的干预,来对转移性癌症治疗的科研工作起到一些启发作用。
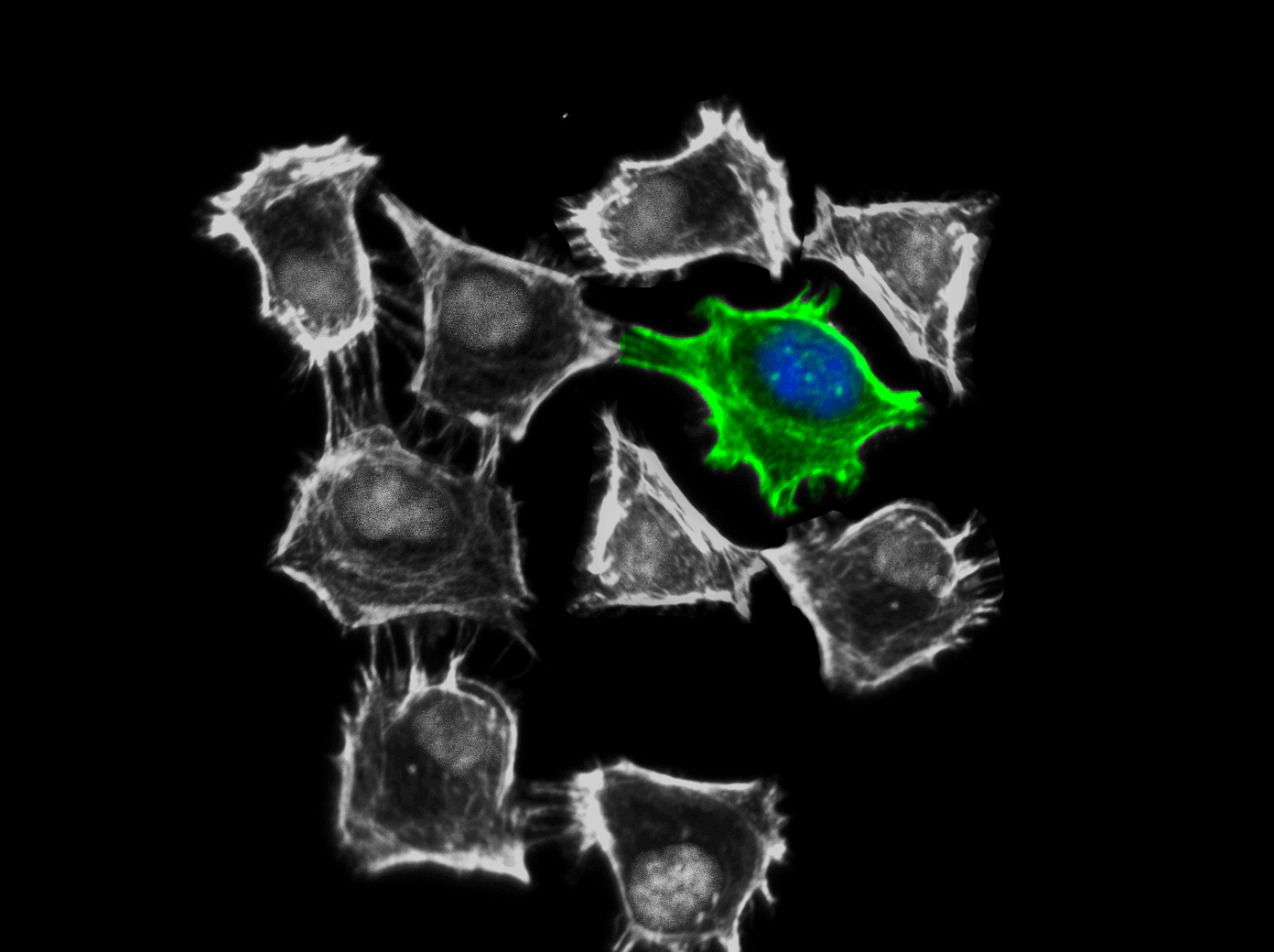
图1. 使用Cytoskeleton Inc.的Rac/Cdc42 激动剂 (Cat. # CN02)激活后的CDC42蛋白在HeLa细胞中表达
小G蛋白的异构体突变或水平改变,会直接与癌症的发展和预后有着直接关联。有研究指出,RAC1突变基因P29S/L 的出现会减弱人类黑素瘤细胞的趋触性和速率,同时会正向调节PD-L1蛋白(细胞程序性死亡-配体1 )1-3。相反地,乳腺上皮细胞中Cdc42表达水平的升高则增加了转移性乳腺癌的活性、侵略性和不良预后4(更多例子请参考文章最后的文献4-7)
值得注意的是,因为小G蛋白普遍存在于所有类型的哺乳动物细胞中,在进行癌症的干预治疗时就必须避开它们在细胞中的正常功能。 早期在进行药物开发时,许多候选药物的研究都因产生了毒性副作用而失败了,原因是它们会直接作用于Rac1和Cdc42(R&C)蛋白7。而如果我们将研究焦点转移到R&C信号通路的上游和下游时,将会给我们带来更多的研究思路(图2)。
如图2所示,可以看到Rho家族的小G蛋白位于通路的中央控制调节点位置,受到上游通路的影响并进而作用到下游通路。

图2. Rac和CDC42上游和下游通路示意图(图片源自https://www.cytoskeleton.com/nov-21-newsletter-the-rac-1-and-cdc42-pathway-axis-in-future-metastatic-cancer-therapy)
上游活化因子
鸟嘌呤核苷酸交换因子(guanine nucleotide-exchange factor/GEF)在上游通路中起到关键作用,
什么是GEF?GEF是可以增强小G蛋白活性的调节因子,它通过催化GDP与GTP的交换,生成活性状态的小GTPases以响应细胞外信号。
细胞表面受体(GPCRs, RTKs, integrins)首先会激活GEFs。接着,GEFs在结合位点通过增加GTP/GDP的交换率来激活小G蛋白。(Tiam, Vav1 和 Vav2 是Rac的调节因子;Dbl, Dbs, 和 ITSN是CDC42的调节因子;Tiam1, Vav1,2则可以同时激活Rac和CDC42蛋白)。
以下三种方式均会造成GEFs的上调:(1)增加GEFs在结合位点的亲和力;(2)GEF的磷酸化;(3)GEFs启动子区域的去甲基化(更多细节请参考文献8)
虽然GEFs常被认为是致癌基因,但发生突变的单个GEFs却仅占很小的部分。根据TCGA PanCancer Atlas中的数据显示,在黑素瘤中发生突变的Tiam和Vav2数量分别仅占到9.0%和3.6%,而瘤细胞中发生突变的RC GEF基因总数却高达80.7% 8。因此对其他的GEF基因(如Trio,P-Rex1,P-Rex2等)进行进一步的研究,也十分必要。
在药物开发中针对R&C GEFs的相关课题可以有很多的选择,在此列举一二:利用小分子与相关蛋白质的交互位点/变构位点结合,或通过遮蔽蛋白质的磷酸化位点等方式来抑制其活性9。
下游活化因子
比起上游通路,关于R&C下游通路中活化因子的认知相对较少。其中PAK激酶(p21-activated kinase),ACK 激酶(activated Cdc42-associated kinase ), 和 MRCK激酶 (myotonic dystrophy-related Cdc42 binding kinase )是药物开发中需要重点关注的蛋白。比如MRCK抑制剂就曾被证实能够在皮肤癌的临床治疗上发挥作用10。
Ras蛋白和R&C通路在转移性癌症中的相互作用
原发性癌症向转移性癌症转化的过程,与R&C通路的激活或抑制有着高度关联性,因为R&C通路会与原癌基因(如K-Ras和N-Ras)发生协同作用11,12。
关于Ras蛋 Ras蛋白是小G蛋白另一个重要的家族成员。当Ras基因发生致癌突变时会导致Ras蛋白异常持续激活。 Ras家族有3种主要亚型:K-Ras、H-Ras和N-Ras,其中K-Ras是最常见的突变基因,在肺癌和结直肠癌等恶性肿瘤中都有较高的发生率。
一些GEF因子,如P-Rex,已被证明在转移性癌症的晚期阶段发挥关键作用13,14,这为癌症晚期的特异性治疗提供了极大可能性。通过研究R&C通路中相关因子的变化来确定哪些GEFs发生了差异性表达或突变,可以有效助力癌症诊断方法的开发。这些研究成果也将进一步有助于肿瘤学家们为不同的癌症患者选择特定的匹配药物。
小结
目前正在进行的癌症研究中,只有16%的临床试验是针对转移性癌症的15,所以这个领域还有很大的空间等待研究。当癌症的转移在疾病早期并不明显时,以预防和转移治疗为目标的临床试验开展难度较大,但挑战往往会带来机遇。因此,研究者和临床肿瘤学家有必要抓住每一个可能的研究着手点,针对转移性癌症的治疗寻求更大的突破。
Cytoskeleton作为专业的细胞骨架和小G蛋白相关产品的生物科技公司,可以提供专业且高度可靠的Pulldown和GLISA检测试剂盒,在过去的20年里,无数各个领域的研究人员已经利用Cytoskeleton的产品产出许多优秀的实验成果。
文章相关产品推荐:
Pull-down活性检测工具:
Cdc42 Activation Assay Biochem Kit (Cat. # BK034)
Rac + Cdc42 Activation Assay Biochem Kit (Cat. # PAK02)
Rac1 Activation Assay Biochem Kit (Cat. # BK035)
Ras Activation Assay Biochem Kit (Cat. # BK008)
Rhotekin RBD beads (RhoA/B/C) (Cat. # RT02)
RhoA Activation Assay Biochem Kit (Cat. # BK036)
RhoA/Rac1/Cdc42 Activation Assay Combo Biochem Kit (Cat. # BK030)
肌动蛋白检测工具:
Arf1 G-LISA™ Activation Assay Kit (Colorimetric format) (Cat. # BK132)
Arf6 G-LISA™ Activation Assay Kit (Colorimetric format) (Cat. # BK133)
Cdc42 G-LISA™ Activation Assay Kit (Colorimetric format) (Cat. # BK127)
Rac1 G-LISA™ Activation Assay Kit (Luminescence format) (Cat. # BK126)
Rac1 G-LISA™ Activation Assay Kit (Colorimetric format) (Cat. # BK128)
RalA G-LISA™ Activation Assay Kit (Colorimetric format) (Cat. # BK129)
RhoA G-LISA™ Activation Assay (Luminescence format) (Cat. # BK121)
RhoA G-LISA™ Activation Assay Kit (Colorimetric format) (Cat. # BK124)
RhoA / Rac1/ Cdc42 G-LISA™ Activation Assay Bundle 3 kits (24 assays per kit) (Cat. # BK135)
Rac1,2,3 G-LISA™ Activation Assay (Colorimetric format) (Cat. # BK125)
Rac1 G-LISA™ Activation Assay (Luminescence format) (Cat. # BK126)
Rac1 G-LISA™ Activation Assay Kit (Colorimetric Based) (Cat. # BK128)
Ras G-LISA™ Activation Assay Kit (Colorimetric Based) (Cat. # BK131)
Total RhoA ELISA (Cat. # BK150)
Ref:
1. Maldonaldo MM, & Dharmawardhane S. 2018. Targeting Rac and Cdc42 GTPases in Cancer. Cancer Res. 78 (12), p3101–3111.
2. King SJ, et al. 2016. Lamellipodia are crucial for haptotactic sensing and response. J. Cell Sci. 129 p2329-2342.
3. Vu HL, et al. 2015. Rac1 P29S regulates PD-L1 expression in melanoma. Pigment Cell melanoma Res. 28, p590-598.
4. Bray K, et al. 2013. Cdc42 overexpression induces hyperbranching in the developing mammary gland by enhancing cell migration. Breast Cancer Research, 15, R91.
5. Svensmark JH & Brakebusch C. 2019. Rho GTPases in cancer: friend or foe? Oncogene, 38, 7447-7456.
6. Aspenstrom P. 2018. Activated Rho GTPases in cancer - The beginning of a new paradigm. Intl. J. Mol. Sci. 19, p3949-63.
7. Maldonaldo MM, & Dharmawardhane S. 2018. Targeting Rac and Cdc42 GTPases in Cancer. Cancer Res. 78 (12), p3101–3111.
8. Maldonaldo MM, et al. 2020. Targeting Rac and Cdc42 GEFs in metastatic cancer. Front. Cell Dev. Biol. 8, Article 201.
9. Murphy N. et al. 2021. Progress in the therapeutic inhibition of Cdc42 signalling. Biochem. Soc. Trans. 49, p 1443-1456.
10. Unbekandt M. et al. 2018. Discovery of potent and selective MRCK inhibitors with therapeutic effect on skin cancer. Cancer Res., 78(8), p2096-2114.
11. Cooke M. et al 2020. Rac-GEF/Rac Signaling and Metastatic Dissemination in Lung Cancer. Front. Cell Dev. Biol. 8, Article 118.
12. Kissil JL. 2007. Requirement for Rac1 in a K-ras induced lung cancer in the mouse. Cancer Res. 67(17), 8089-94.
13. Cardama et al. 2014(a). Preclinical Development of Novel Rac1-GEF Signaling Inhibitors using a Rational Design Approach in Highly Aggressive Breast Cancer Cell Lines. Anticancer Agents Med Chem. 14(6), p840–851.
14. Cardama et al. 2014(b). Proapoptotic and antiinvasive activity of Rac1 small molecule inhibitors on malignant glioma cells. Onco. Targets Ther. 7, p2021–2033.
15. Clinicaltrials.gov as of 2021-09-16, and search for “cancer” and limit to “active, not recruiting”. Then calculate percent of titles containing the word “metastatic”. Result: 1271 active, not recruiting, cancer trials, wherein 203 contained the word “metastatic” in the title.











 危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)
危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)  营业执照(三证合一)
营业执照(三证合一)