研究背景
肿瘤炎性微环境包含各种类型和亚型的细胞类群。细胞群的组成以及空间位置关系反映了宿主对炎症刺激的反应,并日益被理解为影响对肿瘤免疫治疗的反应。多重组织成像技术使得在组织结构的空间背景下可以识别不同的细胞类型和状态。本次的案例提供了一个分析工作流程,结合高分辨率、全组织多重免疫荧光成像以及先进的HALO数字病理图像分析工具,应用于1)分割组织、细胞并基于多种抗体标记物对细胞类群进行量化分析;2)确定细胞类群的密度以及不同细胞间的邻近距离关系。
研究人员将该工作流程应用于三种淋巴组织的比较性评估:扁桃体(follicular hyperplasia),淋巴结(quiescence),淋巴瘤(architectural effacement),证实该工作流程可以作为不同人群肿瘤微环境的可视化和量化评估强有力的研究方法,并且可用于临床的转化研究。
研究方法
福尔马林固定和石蜡包埋的扁桃体、淋巴结和慢性淋巴细胞白血病/小淋巴细胞淋巴瘤组织样本,使用17色免疫荧光panel进行染色,包含CD45(白细胞);CD20(B细胞);CD3d、CD4、CD8(T细胞);FOXP3(调节性T细胞);CD68、CD163(巨噬细胞);CD45RO(记忆T细胞);PD-L1、PD-1(免疫检查点标记);CD31(血管和淋巴内皮细胞);Cytokeratin,E-cadherin(上皮细胞);PCNA,Ki67(增殖性细胞)以及DAPI胞核染色。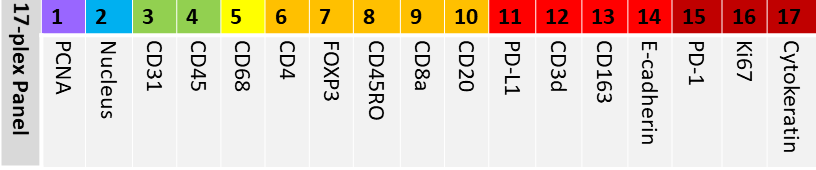
染色后的组织玻片在Orion设备(RareCyte)进行扫描成像(图1)。整个Panel的不同抗体标记用以评估淋巴样结构、增殖细胞、T细胞亚群和巨噬细胞。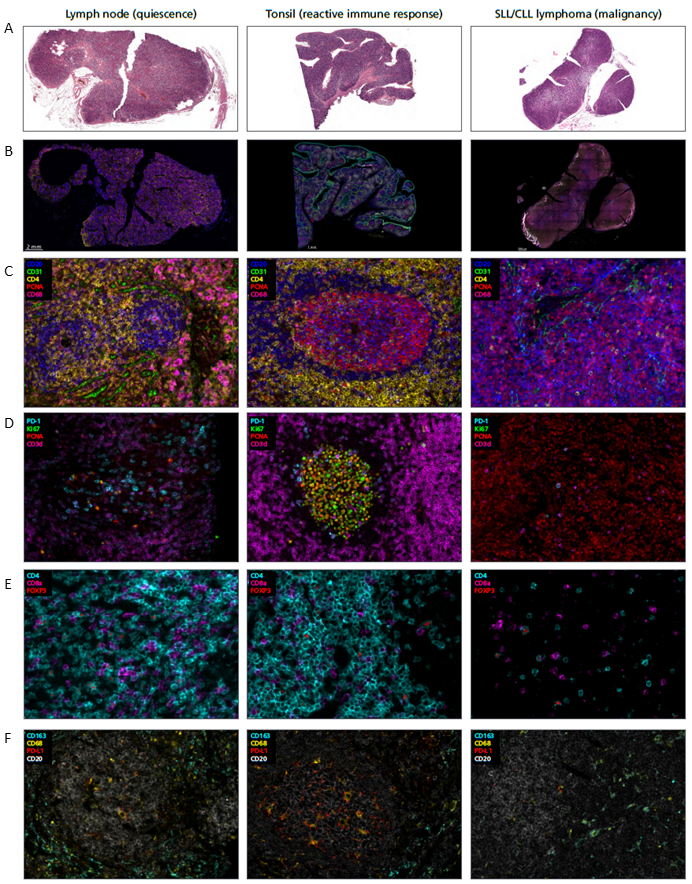
图1 三种不同淋巴结组织的17-plex Panel免疫荧光染色成像。
A.组织切片的H&E染色(对应于下列的多重免疫荧光染色);B.全组织切片的多重免疫荧光染色(淋巴结滤泡中含有B细胞(CD20,蓝色)和主要集中在滤泡之间的T细胞(CD4,左侧为洋红色,其他两个为白色)。扁桃体被粘膜隐窝包围(pan-cytokeratin,青色)。淋巴瘤显示肿瘤细胞对正常淋巴结结构的破坏);C.淋巴样结构(淋巴结有小滤泡,其中含有少量增殖细胞(PCNA,红色),增殖细胞存在于滤泡中。CD4 T细胞(黄色)之间分布着密集的血管(CD31,绿色)。巨噬细胞(洋红色)呈聚集状态。扁桃体有扩张的毛囊,生发中心几乎所有的B细胞(蓝色)都在增殖。CD4 T细胞大量存在于T细胞区域,也存在于卵泡中。几乎所有淋巴瘤细胞都在增殖;并且它们渗入血管壁(CD31绿色));D.细胞增殖(淋巴结滤泡中少量的增殖细胞和扁桃体滤泡中大量的增殖细胞表达PCNA和Ki67抗体。有趣的是,淋巴瘤细胞表达PCNA而不表达Ki-67。PD-1+细胞(青色)分散在毛囊中,没有增殖);E.T细胞亚群(CD4(青色)和CD8(洋红色)T细胞在淋巴结和扁桃体的T细胞区域被识别。FOXP3(红色),存在于CD4+细胞的一个子集中,将细胞核染成红色。虽然T细胞在淋巴瘤中稀少,但可以识别到调节性T细胞);F.巨噬细胞亚群(卵泡中含有CD68+的巨噬细胞(黄色)。这些巨噬细胞也表达PD-L1(红色),这在扁桃体的反应滤泡中更为明显。CD163(青色)在滤泡外分布更明显。淋巴瘤图像是组织切片中为数不多的残余滤泡之一)。
随后图像导入到HALO数字病理图像平台中进行分析。针对每个样本,使用HALO AI基于核分割的算法,在所有样本中进行细胞核的识别(图2A)。随后,使用HALO AI进行组织分类分析,识别全组织区域内的B细胞区域、T细胞区域、上皮细胞区域以及间质区域(图2B)。以上两个算法均被嵌入到HALO的Highplex FL模块中,应用于在不同组织类别中进行不同细胞类群的表征(图2C)。在分析中,根据用于自定义的阈值确定每个生物标记物,以确定适当的亚细胞定位(核、细胞质和/或膜)的阳性,以进行表型分析。
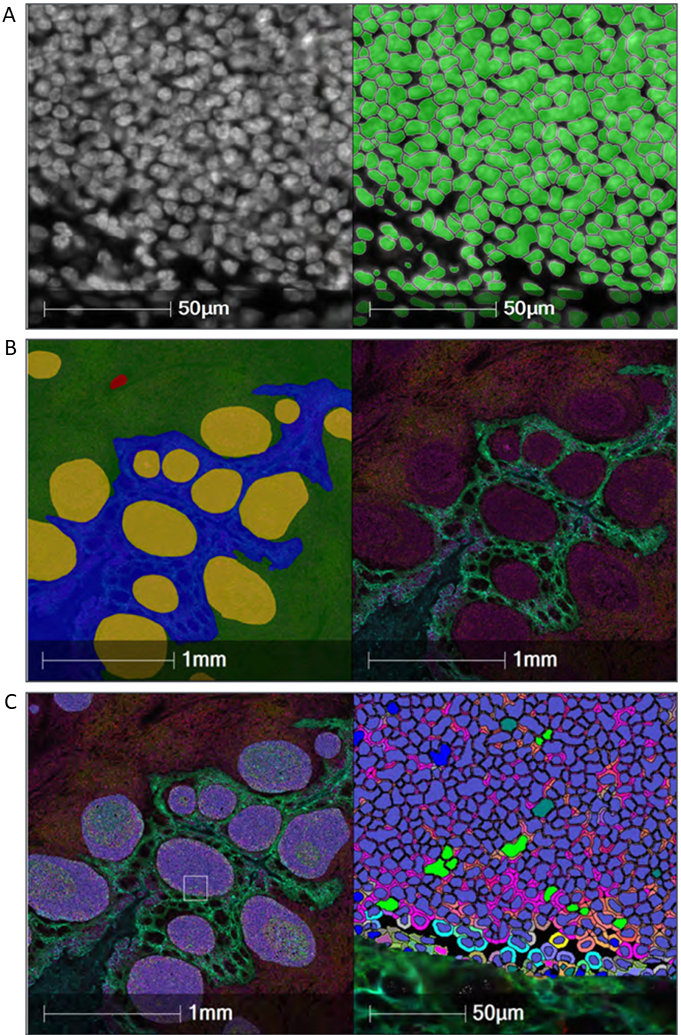
图2 HALO平台进行组织定量分析的工作流程。
A.细胞核分割。HALO AI用于创建一个自定义的胞核分割算法,用于分析扁桃体组织,以最好地分割高密度样本中的胞核;B.组织分类。创建HALO AI组织分类器算法并训练识别B细胞区域(黄色)、T细胞区域(绿色)、上皮细胞区域(蓝色)和间质区域(红色)。右图对应原始组织图像;C. 细胞表型。两种HALO AI算法被嵌入Highplex FL模块中,该模块通过细胞表型分析组织类。这里对卵泡区进行了表型分析。单个细胞的颜色是由表型决定的。
研究结果
在这三种淋巴组织的样本中,定量分析了B细胞、T细胞、巨噬细胞的细胞群体和微血管的密度,并且进行了组织间的比较。同时研究了在免疫肿瘤中具有潜在重要性的罕见细胞类型。结果表明,在表型水平上,组织之间的差异与光学显微镜下看到的形态学差异相对应。
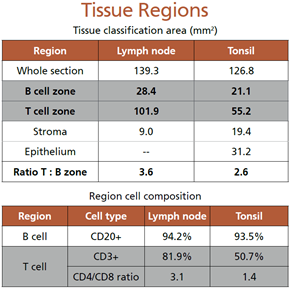
研究分析了整个组织区域内B细胞区域、T细胞区域、上皮细胞区域以及间质区域的面积并计算T细胞与B细胞区域的占比。发现反应性扁桃体的B细胞区域相对于淋巴结(quiescence)有所扩大。扁桃体中的T细胞和B细胞区域面积的比例相对于淋巴结减少了27%。此外,发现扁桃体T细胞区域内的非T细胞比淋巴结内更多;淋巴结内辅助性T细胞更多,而扁桃体中细胞毒性T细胞和辅助性T细胞分布相对较为均衡。
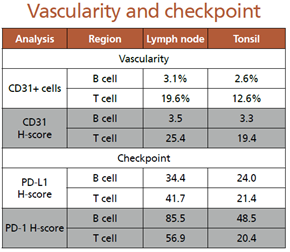
对三种淋巴结组织内微血管和免疫检查点标记细胞进行了比较,发现T细胞区域内微血管的数量高于B细胞区域;淋巴结组织中T细胞区域微血管的比例明显高于扁桃体组织;结合染色强度进行了微血管的H-score评分,同样得到了类似的结果。对免疫检查点标记的细胞进行评估,发现PD-L1和PD-1在淋巴结的T细胞区域或B细胞区域均高于扁桃体组织。
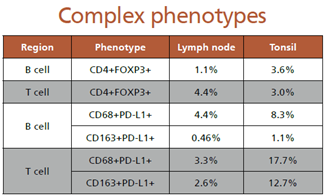
对更多复杂的细胞表型进行了分析,发现淋巴结组织中B细胞区域内调节性T细胞(CD4+&FoxP3+)低于T细胞区域,但在扁桃体组织中,调节性T细胞在B细胞和T细胞区域分布较为均匀;此外发现PD-L1在CD68+和CD163+(M2)巨噬细胞上均有表达,并且在反应性扁桃体的表达明显高于淋巴结组织。










 危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)
危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)  营业执照(三证合一)
营业执照(三证合一)