CD4+T淋巴细胞与自身免疫性疾病(如I型糖尿病、系统性红斑狼疮和类风湿性关节炎等)的发病和进展密切相关。Th17细胞是CD4+T淋巴细胞的一重要亚群,可表达特异性转录因子RORγT及分泌细胞因子IL-17。研究表明,Th17细胞具有致病和非致病两面性的不同功能,在自身免疫中发挥着重要调节作用。
因此,体外th17诱导分化实验是研究自身免疫疾病以及其他相关疾病机制的一重要途径。本期分享的是小鼠淋巴结中naive CD4+T细胞的体外诱导成Th17实验的具体流程:

Fig1. Th17细胞的分化和功能
实验前准备
|
小鼠淋巴结 单细胞悬液制备 |
体外诱导 Th17细胞 |
Th17细胞流式检测 |
|
1. 70%酒精 2. 剪刀、镊子、 3. 注射器,培养皿 4. 显微镜载玻片 5. 分选缓冲液 6. 15mL离心管 |
1. 40μm滤器 2. Miltenyi磁珠分选套装及磁珠or流式分选抗体(CD4/CD25/CD44/CD62L) 3. 功能抗体:anti-CD3,anti-CD28 4. 细胞因子:IL-6,TGF-β 5. 96微孔板 |
1. 细胞因子刺激及阻断剂 2. 24孔板 3. RPMI培养基 4. 胎牛血清 5. PBS 6. 固定破胞膜剂 7. CD4 、CD8 、CD25、 IL-17A流式荧光抗体 8. FACS缓冲液 |

Fig2. Th17细胞体外诱导分化实验简要流程图
1.小鼠淋巴结单细胞悬液制备
a. 获取小鼠淋巴结
①CO2窒息法处死小鼠,确认死亡后并立即进行颈椎脱位。用70%乙醇对小鼠解剖工具和腹部切口区域进行消毒。从腹侧,抓住尿道口前方的皮肤,用剪刀沿着腹侧中线开始切割,直到到达下巴区域;
②不同淋巴结的获取:
腋窝淋巴结:位于胸肌后,腋窝附近;
肱淋巴结:位于腋窝附近,结缔组织中;
颈浅淋巴结:位于颈部;
腹股沟淋巴结:位于臀部3条血管连接处;
肠系膜淋巴结:切开腹面中线的腹膜,位于连接肠道的结缔组织中
③收集的淋巴结将全部用镊子取出,并放置在无菌培养皿中,培养皿中含有5 mL autoMACS Running Buffer(Miltenyi Biotec);
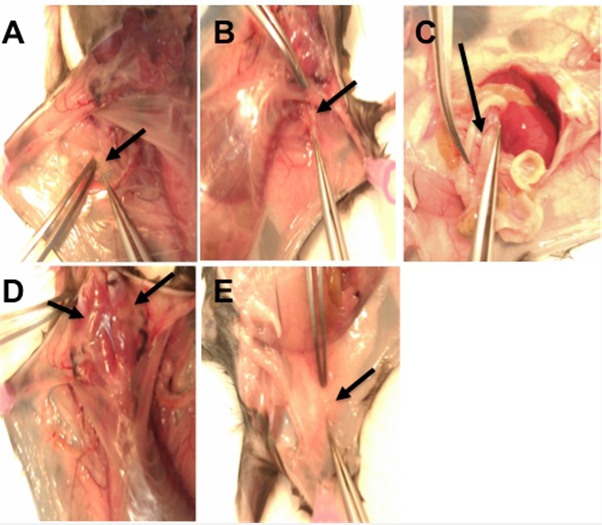
Fig3. 小鼠淋巴结解剖图,A 肱淋巴结B 腋窝淋巴结C 肠系膜淋巴结D 颈浅淋巴结E 腹股沟淋巴结
b. 淋巴结单细胞悬液制备
①使用2张磨砂显微镜载玻片研磨器官。将淋巴结放在一张显微镜载玻片的磨砂面上,并与第二张载玻片的磨砂面摩擦,直至分解。重复上述步骤,直到所有淋巴结磨平;
②用5mL注射器和21G的针头抽吸5mL淋巴结组织混合液;
③将淋巴结组织混合液用40 μm细胞过滤器过滤入15mL离心管中,滤液即为单细胞悬液。
注:获得的单细胞悬浮液,如果有固体残留,可用新的滤器再次过滤,保证单细胞悬液的均一性。
2. Th17细胞体外诱导
a. 分选naive CD4+ T细胞
方法一:Miltenyi磁珠分选出CD4+CD25-细胞亚群(货号130-091-041)或Naive CD4+ T 阴选试剂盒(货号130-104-453)(具体操作以及试剂用量可参考产品说明书,标注的非常详尽)
方法二:流式分选CD4+CD25-CD62L+CD44-细胞亚群
分选后,收集细胞,进行流式表面染色进行纯度鉴定。分选后的细胞纯度需要达到80%以上即为合格。
 Fig4. 分选后,naive CD4+T细胞纯度鉴定
Fig4. 分选后,naive CD4+T细胞纯度鉴定
b. Th17细胞的诱导分化
①分离收集CD4+CD25-细胞后,取出一小部分细胞悬液,用台盼蓝以1:1000的比例稀释,进行细胞计数;
②将细胞悬浮液稀释至1 x 106个细胞/mL细胞培养基;
③将30-100 μl anti-CD3(10 ug/mL)抗体添加至96孔 U形微孔板中,并轻敲培养板的侧面,使其混匀。在37°C下培养4 h,然后4℃冷藏备用(在获取CD4+CD25-T细胞至少前4 h,就开始包被anti-CD3 细胞培养板);
④用200 μl PBS清洗包被了CD3抗体的培养板。重复3次,吸掉多余的PBS;
⑤将100 μl的Th17诱导对照混合物(细胞培养基+1.5~2.5 μg/mL anti-CD28,不加入 IL-6和TGF-β细胞因子)和100μl的Th17诱导混合物(细胞培养基+1.5~2.5 μg/mL anti-CD28,20-30 ng/mL IL-6,3-5 ng/mL TGF-β)分别加入包被了CD3抗体的96孔板中,每组3个复孔。然后每孔加入100μl细胞悬浮液, 总体积为200μl/孔;
⑥放入37℃培养箱中,培养细胞至少72 h,最多5 d,通过细胞内染色和流式细胞术进行评估。
3. Th17流式检测前刺激活化(仅胞内因子染色需要)
①诱导结束后,从培养箱中取出96孔培养板;
②将加入Th17诱导对照混合物和Th17诱导混合物的两组细胞(每组3个复孔),转移到24孔细胞培养板的一个孔中;
③24孔细胞培养板中每个孔的总体积为600 μl。用细胞培养基将每个孔的终体积补充到1mL;
④在细胞培养孔中,加入2μl含有PMA、离子霉素和BFA的刺激剂(货号550583,BD),在37℃培养箱中,至少培养4 h(不超过8 h);
4. 流式检测(CD4 、CD8 、CD25、 IL-17A)
①将刺激活化后的细胞收集到1.5 mL离心管中,350 g离心5 min,去除上清;
②用1 mL的FACS缓冲液(PBS中2%的FBS)进行细胞重悬,350 g离心5 min,重复此步骤2遍;
③然后将细胞用100 μl FACS缓冲液重悬,按照抗体说明书加入适量的CD4, CD8, CD25抗体,室温避光孵育15 min;
④孵育完成后,350 g离心5 min,去除上清,用1 mL FACS缓冲液洗涤细胞两次,350 g,离心5 min,弃去上清;
⑤固定破膜处理:250 μl 的1X固定破膜液(Cytofix / Cytoperm Buffer)(货号554714,BD)重悬 细胞,室温避光反应20 min;
⑥将孵育后的样本进行500 g,离心5 min,弃上清,不洗涤;
⑦用去离子水将10×的Permeabilization Wash Buffer 稀释成1×的工作液。用1-2 mL 1×的Permeabilization Wash Buffer重悬固定的细胞,500 g离心5 min,弃上清,重复该步骤两次;
⑧用100 μl Permeabilization Wash Buffer 重悬固定破膜后的细胞,加入特定的荧光标记抗体IL-17A,室温避光孵育30 min;
⑨用 1-2 mL Permeabilization Wash Buffer重悬细胞,500g离心5 min,弃上清。加入200-300 μl的FACS缓冲液重悬细胞;
⑩流式上机检测,分析数据。
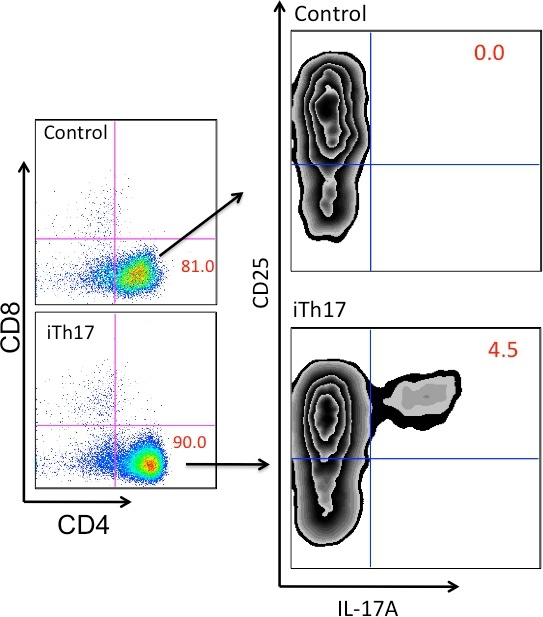
Fig.5 流式细胞术检测Th17细胞分化
参考文献
[1] Bing Wu, Song Zhang, Zengli Guo, Jian-liang Li, Silva Markovic-Plese,Yisong Y. Wan. The TGF-b superfamily cytokine Activin-A is induced
during autoimmune neuroinflammation and drives pathogenic Th17 cell differentiation[J]. , Immunity, 2021, 54, 308–323.
[2] Bedoya, Simone K.,Wilson, Tenisha D.,Collins, Erin L.,Lau, Kenneth,Larkin, Joseph. Isolation and Th17 Differentiation of Naïve CD4 T Lymphocytes[J]. Journal of Visualized Experiments : JoVE, 2013, 79, 12.
[3] Litmann, D.R. & Rudensky, A.Y. Th17 and regμlatory T cells in mediating and restraining inflammation. Cell. 2010,140, 845-858 .
[4] El-Behi M., Rostami, A., et al. Current views on the roles of Th17 and Th17 cells in experimental autoimmune encephalitis. J. Neuroimmune
Pharmacol. 2010, 5, 189-197 .










 危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)
危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)  营业执照(三证合一)
营业执照(三证合一)