血管生成及其研究策略
时间:2022-05-09 14:07:32 浏览次数:3322
早在2000年和2011年,Weinberg 和 Hanahan博士提出的肿瘤十大标志性特征中,其中一个标志性特征即为诱导血管新生。肿瘤血管新生是肿瘤发生发展、浸润与转移的重要条件。本文将从血管生成概念、肿瘤血管生成的过程、肿瘤微环境对肿瘤血管生成的调控、肿瘤血管生成的临床药物,以及血管生成的13个研究策略进行阐述。
血管生成
血管生成(Angiogenesis)是指从已有的毛细血管或毛细血管后静脉发展而形成新的血管。新生血管的生长和成熟是一个相当复杂和协调的过程,血管的形成与发展取决于血管生成促进因子和抑制因子的动态平衡(如图1)。
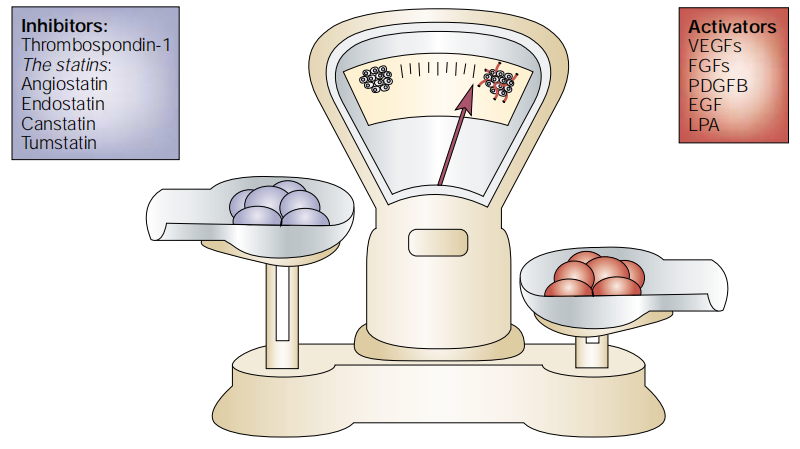
图1.血管生成平衡
肿瘤血管生成的过程
肿瘤细胞持续分裂和增殖,消耗大量的氧气和营养物质。当实体瘤的体积小于2mm3时,可以通过扩散获得氧气和营养物质。随着肿瘤组织的逐渐生长,肿瘤需要形成新的血管来获取营养和氧气,以确保肿瘤呈指数增长(如图2)。
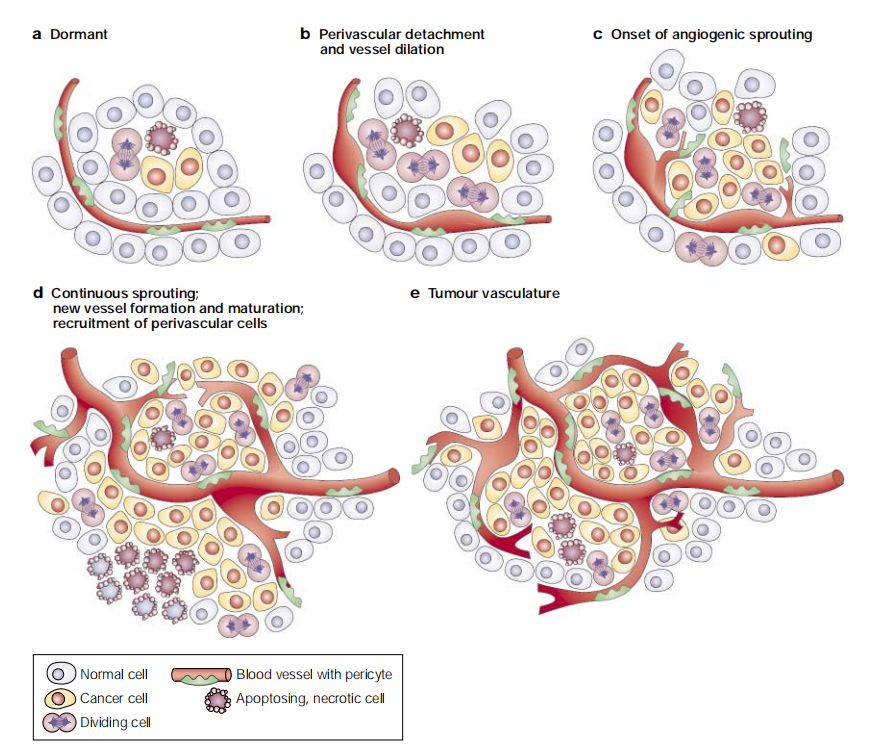
图2.经典的血管生成开关
肿瘤的血管生成起源于肿瘤中已存在的毛细血管或毛细血管后小静脉。首先,血管周细胞(绿色)脱落,血管扩张;接着内皮细胞(红色)迁移到血管周围空间,向肿瘤细胞或宿主细胞产生的血管生成刺激方向迁移;然后内皮细胞顺着血管生成方向增殖,这一过程可能由周细胞引导;内皮细胞相互粘附并形成一个管腔,并伴随着基底膜的形成和周细胞的附着。最后,血管芽会与其他芽融合,建立新的循环系统(如图3)。
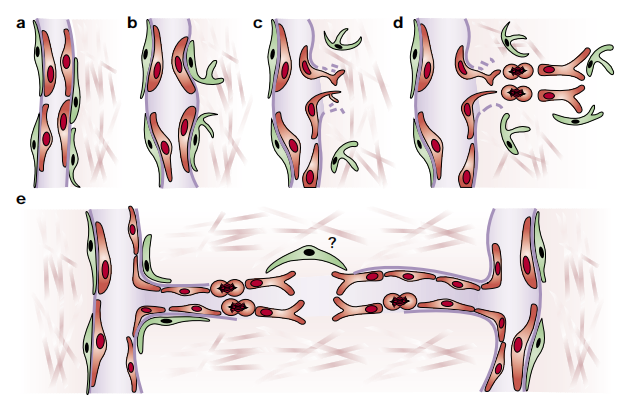
图3.新血管形成过程
肿瘤微环境对肿瘤血管生成的调控
·缺氧
实体肿瘤发生发展过程中,高耗氧量、营养缺乏和细胞中代谢物质的积累可能会产生不适合肿瘤细胞生长的缺氧微环境。在常氧条件下,HIF-1α和HIF-2α被PDH和FIH-1羟基化,并通过蛋白酶体介导的降解来降解。在肿瘤的缺氧环境中,FIH-1和PHDs的失活不能羟基化HIF-1/HIF-2α,降低HIFα-VHL结合,促进HIFα-HIFβ二聚体进入细胞核,激活血管生成相关基因,并促进肿瘤中的血管生成拟态(如图4)。
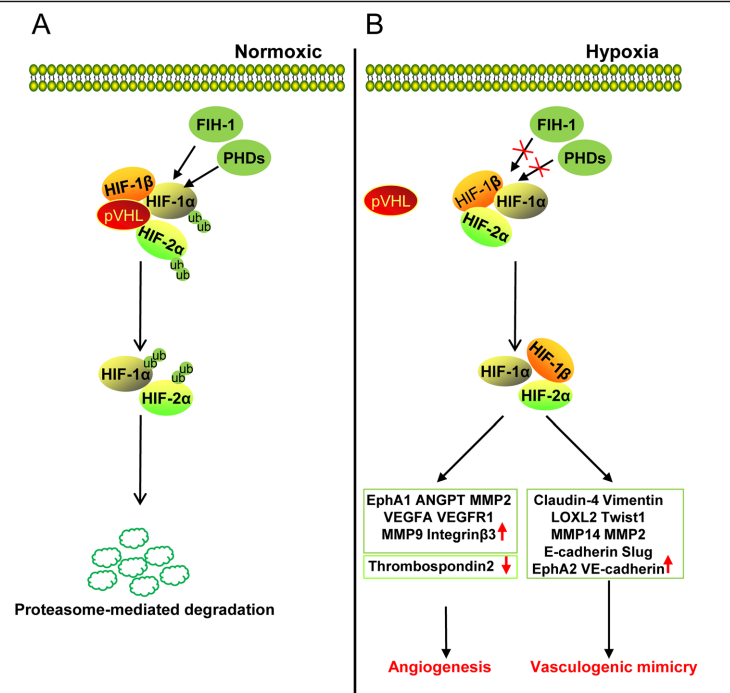
图4.缺氧在肿瘤血管生成中的作用
·血管生成因子
在肿瘤微环境中,多种细胞可以分泌促肿瘤血管生成因子,它们在调节正常和异常血管生成中发挥重要作用。其中VEGF在肿瘤血管生成中起关键作用。
VEGF通过与其受体(VEGF R1-3)结合调节肿瘤血管生成,激活细胞内信号通路(如图5)。
· 增殖:VEGFR可与Grab/Src/Gab1/Shb/PKCγ相互作用,激活RAF/MEK/MAPK和PI3K/AKT信号通路,促进内皮细胞的增殖。
·迁移和侵袭:VEGFR可以通过与cdc42、Rho和Rac GTPases结合,激活PI3K/AKT,促进内皮细胞的迁移和侵袭。
·通透性:VEGFR可以通过激活NFAT/β-catenin/VE-cadherin和eNOS来增强血管通透性。
·血管生成拟态:VEGFR可以通过上调EMT相关基因的表达来促进EMT诱导的血管生成拟态。
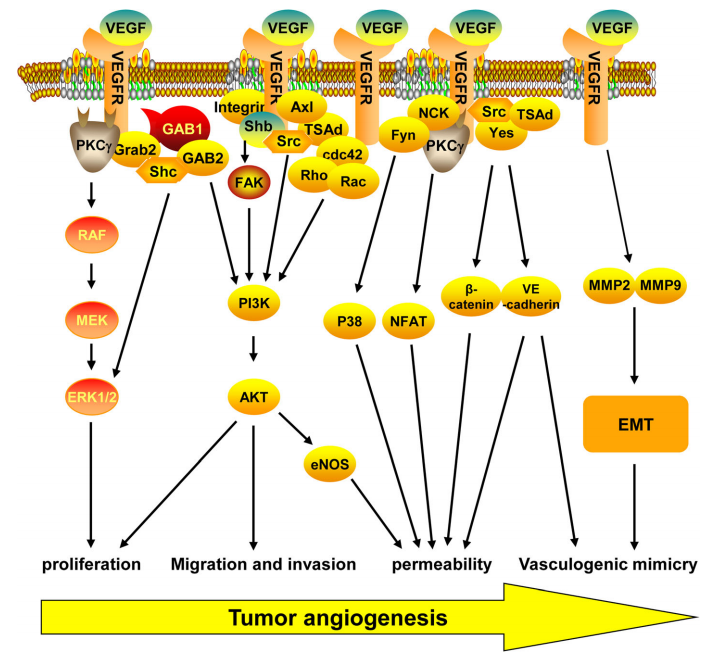
图5.VEGF/VEGFR信号转导通路
·细胞因子
肿瘤细胞在肿瘤微环境中分泌自分泌和旁分泌细胞因子。这些细胞因子在肿瘤的生长、侵袭和转移中起重要作用。近年研究发现,肿瘤微环境中的多种细胞因子在肿瘤血管生成中起重要作用(如图6)。
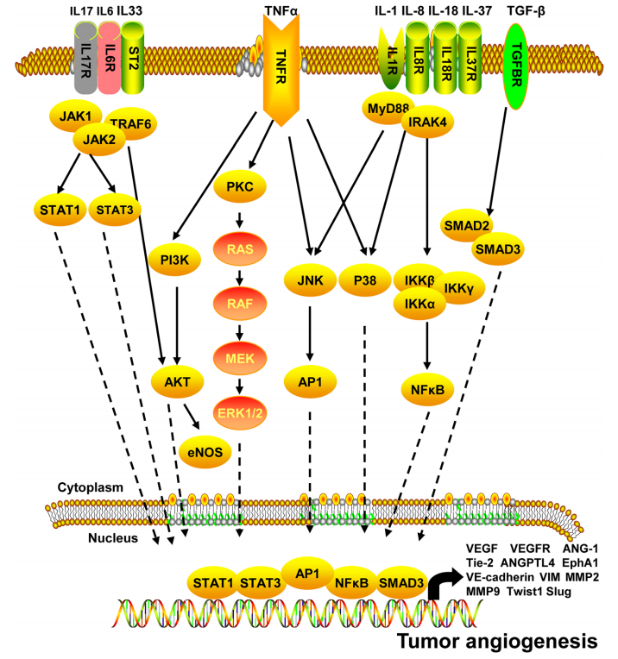
图6.细胞因子对肿瘤血管生成的调控
·非编码核糖核酸
肿瘤血管生成不仅受肿瘤微环境中血管生成因子和细胞因子的调控,还通过非编码RNA等多种细胞内成分进行调控。这些分子可以通过外体或非外体转运机制进入肿瘤细胞(如图7)。
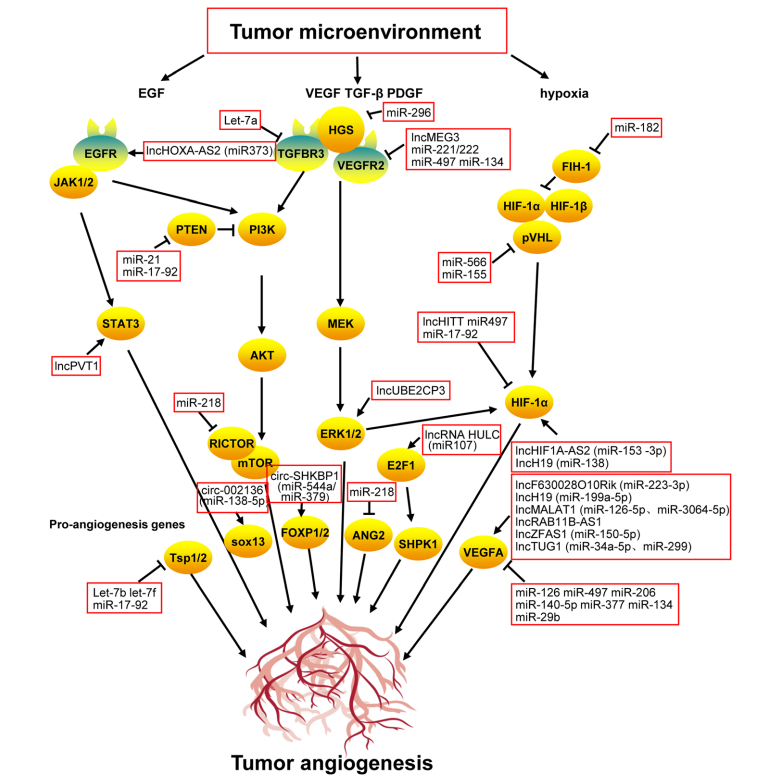
图7.非编码RNA在调节肿瘤血管生成中的作用
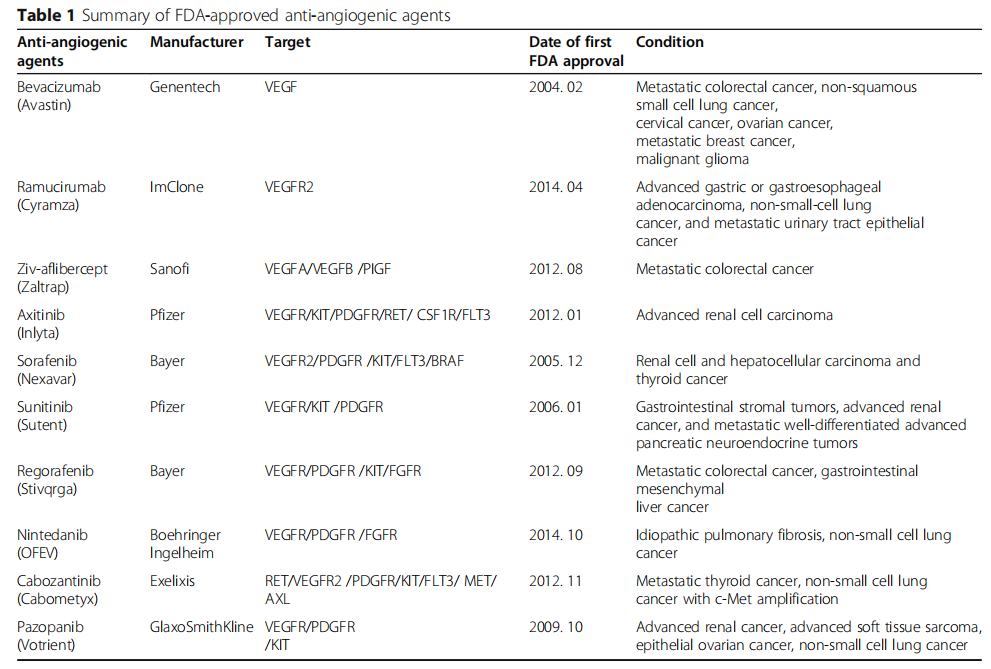
肿瘤血管生成的临床药物
血管生成是肿瘤进展的重要组成部分,在肿瘤生长和转移中起着关键作用。20世纪70年代,Folkman教授提出肿瘤的生长和转移依赖于血管生成,抑制血管生成可作为肿瘤治疗的一种治疗策略。近年来,靶向促血管生成基因已成为肿瘤治疗和预防肿瘤扩展的研究热点。目前FDA批准的抗血管生成药物根据靶点的数量分为两类:单靶点抑制剂和多靶点抑制剂。VEGF是抗肿瘤血管生成的重要靶分子(见表1)。
血管生成研究策略
(1)内皮细胞迁移试验
内皮细胞迁移是血管生成的标志之一,也是血管生成级联反应的早期步骤之一。
伤口愈合试验:细胞培养、伤口愈合试验是表征细胞迁移活性的基本读数之一。血管内皮细胞在培养皿中培养至融合,用刀片/移液管尖端在孔的中间形成一个直的间隙。洗涤并去除漂浮的细胞。将细胞培养一段时间后,在显微镜下观察细胞迁移图像。对细胞迁移的距离进行可视化,并通过image-Pro Plus分析软件捕获图像(如图8)。

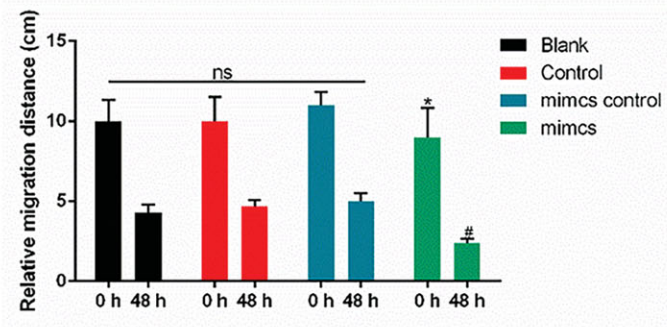
图8.采用伤口愈合法检测HUVECs的迁移情况。
(2)内皮细胞增殖试验
在过去的几十年里,已经发展出了许多不同的解决细胞增殖的方法。一般来说,这些方法包括细胞数量的评估、通过掺入标记的核苷酸类似物来检测DNA合成、DNA含量的测量、增殖标记物的检测和代谢分析(如图9)。
·细胞计数:自动细胞计数器或血细胞计数器
·DNA标记:3H-thymidine、BrdU、edu、PI、DAPI、Fucci
·增殖标志物:PH3、PCNA、Ki67
·代谢分析:MTT测定
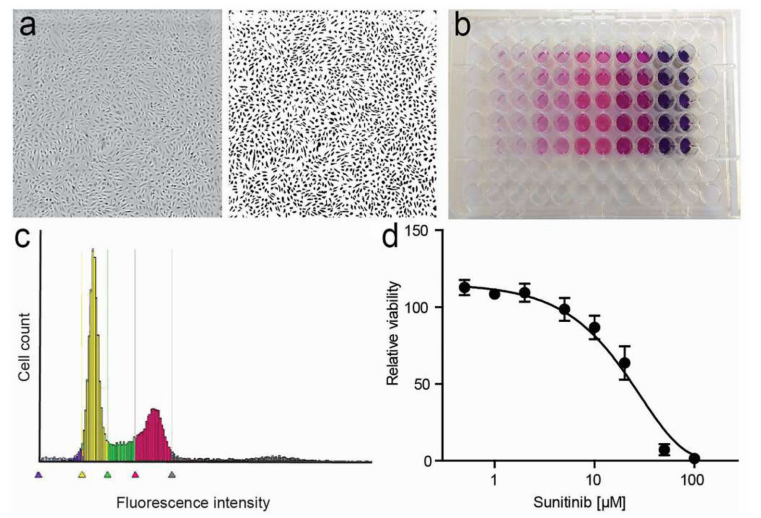
图9.内皮细胞增殖试验。a.在常规的96孔板上生长的HUVEC的相位对比度图像(左)和二值化图像。b.MTT检测的例子,颜色强度与细胞数量相关。c. PI检测HUVECDNA染色,平板细胞仪测量。d. HUVEC用sunitinib处理后的细胞活力,发光法测定。
(3)血管形态发生的3D模型
通过血管发生或血管生成,血管网络的出现需要细胞形成稳定的3D管,这一过程涉及这些细胞的分化、迁移、增殖、聚集和重排,形成索,然后形成管腔。综上所述,这个过程被称为血管形态发生。随后,EC招募血管周围的间质细胞(周细胞)来稳定这个新形成的网络,并减少血液灌注时的渗漏。血管形态发生的三维分析如图10所示。
·纤维蛋白珠测定
·胶原蛋白测定
·视网膜外植体测定
·血管化的微器官平台(VMO)
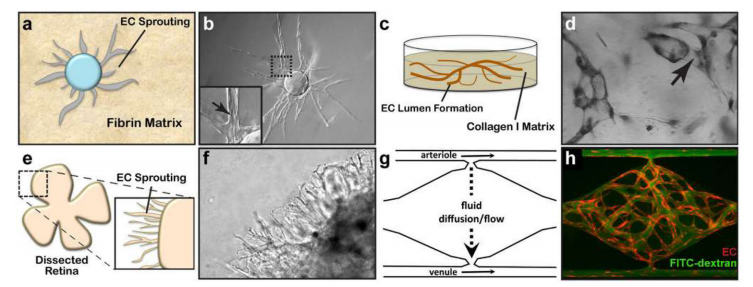
图10.血管形态发生的三维分析。a. I型胶原蛋白和EC包覆的细胞珠嵌入在3D纤维蛋白凝胶基质中,以测量EC的发芽和管腔形成。b. 相差显微镜观察EC发芽和管腔形成。c. EC管的形成可以通过将EC嵌入I型胶原基质中来测量。d.一旦形成,这些管腔可以通过甲苯胺蓝染色和亮视野显微镜观察到。e.将出生后小鼠的完整的解剖视网膜包埋在I型胶原-基质胶混合基质中,并在促血管生成培养基中培养,以刺激EC发芽。f.相差显微镜观察小鼠视网膜血管形态发生。g.VMO平台利用了“小动脉”(高压)和“小静脉”(低压)微流控通道,这些通道通过在介入的组织室内通过血管生成形成的活微血管网络连接。h. 用70kDa的FITC-dextran(绿色)灌注,可以测量形成的微血管系统(EC,红色)的渗漏。
(4)主动脉环试验
大鼠或小鼠主动脉外植体在ECM凝胶中时,具有体外发芽和形成分支微血管的能力(图11)。该系统中的血管生成是由主动脉释放的内源性生长因子及其在解剖过程中响应损伤时的生长所驱动的。主动脉壁的这种特性在20世纪80年代早期首次被描述,并导致了主动脉环检测的发展,现在被广泛用于研究血管生成的基本机制和测试促血管生成或抗血管生成化合物的疗效。
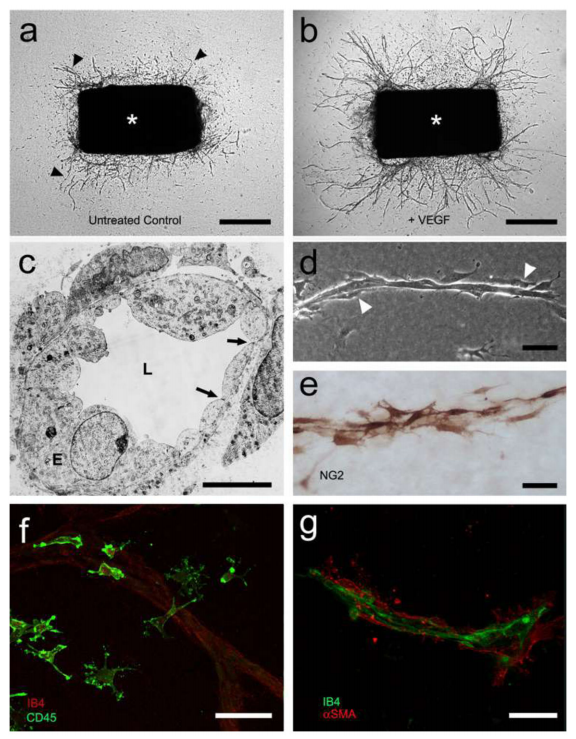
图11.主动脉环实验。a.第6天拍摄的大鼠主动脉无血清胶原凝胶培养(星号)(箭头标记的微血管)。b.用VEGF(5ng/ml)处理的主动脉培养显示微血管数量增加(第6天)。c.主动脉来源的微血管(E)、未闭腔(L)和周围周细胞(P)的电镜图;内皮紧密连接用箭头表示。d.由内皮细胞的内核和周围的周细胞组成的微血管的相位对比显微图(白色箭头)。e.NG2免疫过氧化物酶染色突出显示周细胞。f.主动脉来源的巨噬细胞的免疫荧光图像;在背景中可见一个植物凝集素IB4标记的内皮芽。g.内皮细胞(IB4)和周细胞(αSMA)双染色的微血管共聚焦图像。
(5)肿瘤微血管密度及肿瘤中的组织病理学生长模式
微血管密度(MVD)常被认为是肿瘤血管生成的替代标志物。组织病理学生长模式(HGPs)是根据肿瘤与周围正常组织界面处的形态学特征来定义的。
非血管生成肿瘤的流行及其对抗VEGF治疗的耐药性需要识别一种准确反映这种类型肿瘤生长的生物标志物。HGPs是一个很好的候选生物标志物。用泛内皮抗体免疫染色的肿瘤切片上的血管模式和使用标记内皮细胞参与新生血管生成的抗体是其他潜在的区分非血管生成和血管生成肿瘤的组织病理学方法。通过CD31对正常肝(a)组织、结直肠癌肝转移(b)和(c)组织进行染色,通过不同方法计算微血管密度模式,发现与血管生成、结缔组织增生的肝转移形成对比,后者显示的血管热点数量明显高于正常肝组织和非血管生成的肝组织(如图12)。
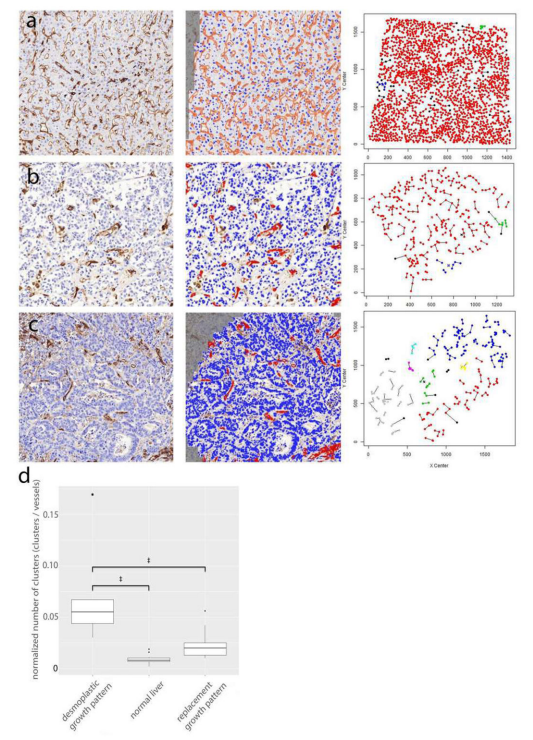
图12.微血管密度和组织病理学生长模式a.正常肝脏中血管模式的无监督空间建模显示,每个血管轮廓的簇数量很低。b.具有替代生长模式的结直肠癌肝转移患者的血管模式的无监督空间建模显示,每个血管轮廓的簇数量较低。c.对具有结缔组织生长模式的结直肠癌肝转移中的血管模式的无监督空间建模显示,每个血管轮廓中都有大量的簇。a-c.相同的颜色表示相同的微血管密度模式。d.结缔组织生长模式、替代生长模式和正常肝脏的标准化血管物体簇的数量的Tukey箱形图。
(6)肠套叠血管生成试验
血管生成是血管的从头形成,可以跟随发芽或非发芽的过程。一个重要的非发芽机制是肠套叠(自身生长;也称为血管分裂)。
血管铸造已被广泛用于三维显示肠套叠血管生成。该方法是基于创建一个微血管系统的血管复制品。采用甲基丙烯酸甲酯或PU4ii作为铸造介质,灌注后几小时,切除器官,转移到15%的KOH中2-4周,以溶解组织。洗涤后,铸件在一系列不断增加的乙醇浓度中脱水,并在真空干燥器中干燥,并用扫描电镜检测(如图13)。
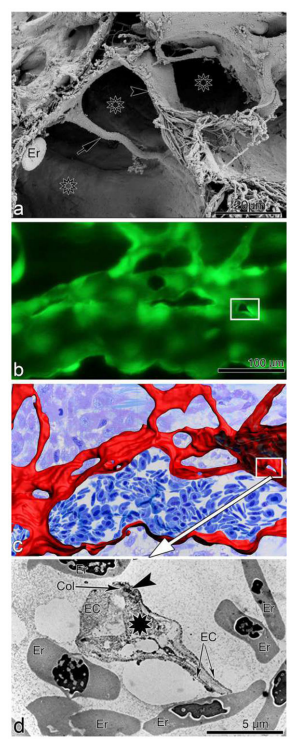
图13.肠套叠血管生成—方法上的挑战。a.扫描电镜观察血管的管腔(星号)的形成。b.对再生斑马鱼鳍血管系统的动态体内观察显示了一个新形成的柱(矩形)。c.来自b图的三维重建模型。d.透射电镜显微图显示了在超微结构水平上的腔内组织柱(b,c中的矩形)。黑色星号表示柱状细胞的核心,箭头表示内皮细胞(EC)之间的细胞-细胞接触。
(7)血管内皮生长因子c (VEGFC)的体内萌芽淋巴管生成实验及AAV介导的基因转移
淋巴系统在体内维持组织液稳态、脂质吸收和免疫细胞运输中起着关键作用。指导淋巴细胞生长的最重要的受体信号转导系统是VEGF-C/VEGFR-3系统。通过转基因过表达或病毒基因传递系统提高VEGF-C的组织浓度会导致淋巴过度生长。研究淋巴管生成的技术有耳海绵试验和病毒基因传递技术(如图14).
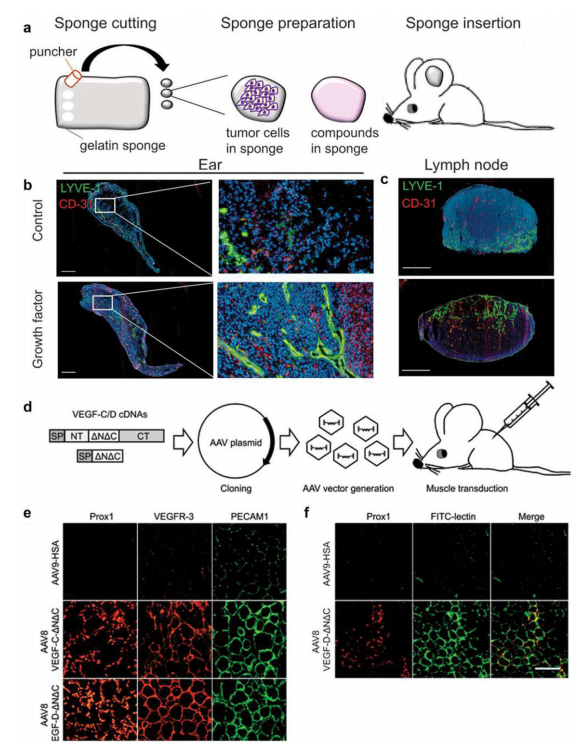
图14.体内淋巴管和血管的生长。a-c.淋巴管生成的明胶海绵的制备。d-f.AAV的制备和骨骼肌的转染。
(8)人内皮细胞和周细胞无血清3D共培养
该分析模型的主要好处和优势在于其高再现性和高重复数,因为它是在半面积96孔板中进行的。周细胞招募到EC管的结果可以通过检查基底膜沉积(通过免疫荧光染色或透射电子显微镜),或通过测量毛细管的宽度和长度来揭示。最后,实时视频分析可以用于监测周细胞和内皮细胞的运动,因为它们在三维基质中与异常招募的周细胞共同组装形成管状网络(如图15)。
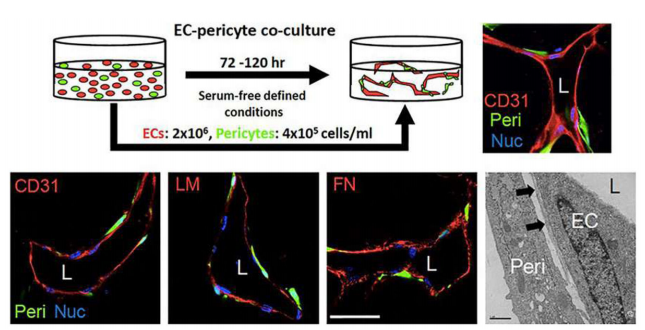
图15.人内皮细胞-周细胞管与3D胶原基质共组装的无血清培养体系。120h固定的培养物用CD31、层粘连蛋白(LM)和纤维连接蛋白(FN)的抗体进行免疫染色,并用共聚焦显微镜成像或透射电镜检查。箭头表示毛细血管基底膜。L表示管腔,Nuc表示细胞核标记。
(9)内皮细胞共培养球体实验
体外2D单层细胞培养及其向临床环境的转化/延伸的研究有其局限性,因为它们不能模拟体内环境中的营养和氧梯度。临床前3D共培养球体分析有助于细胞内/细胞间串扰模拟体内血管结构,例如管腔形成和极化,并且在两种或多种细胞类型具有自然粘附和分层特性的情况下,对于探索这些相互作用特别有价值。
多细胞三维球状体可以通过多种方法生成,包括:(1)使用(超)低结合板自发形成球状体;(2)“吊坠”技术;(3)悬浮培养(例如,通过旋转烧瓶或生物反应器);(4)基于支架的模型(例如,水凝胶);(5)磁力悬浮技术。其中自发球体形成和悬滴法的方法是最经济有效的(如图16)。
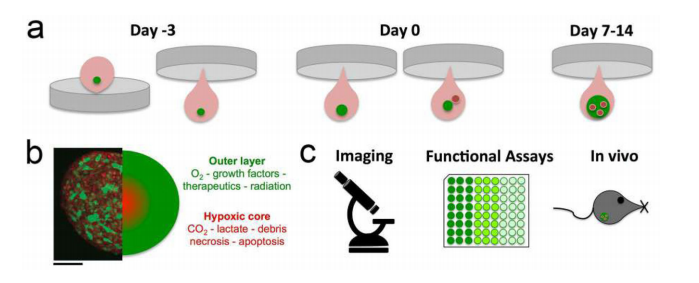
图16.EC共培养球体测定。a.悬滴球状体生长试验随时间的变化的过程概述。在开始共培养之前,肿瘤细胞(绿色)先建立自己的微球状体,然后在72小时后引入内皮细胞(红色),并在14天内监测它们的掺入情况。7天后,肿瘤球细胞球状体可以通过各种技术进行定量和定性评估,如c(荧光)显微镜、组织学、功能分析或植入体内。
(10)内皮细胞代谢实验
大多数内皮细胞会保持数年的静息状态,但在暴露于促血管生成刺激(如VEGF)时,它们可以在健康和疾病状态下迅速转换为增殖和迁移状态。在这种转换的基础上,是一个受到严格调控的代谢网络,为内皮细胞做出相应反应提供必要的能量和构建模块。目前已建立的监测EC代谢活性的方法有:(1)示踪剂代谢组学,(2)基于放射性示踪剂的代谢测定,(3)通过海马XF分析仪测量细胞外酸化率和线粒体呼吸。如图17。
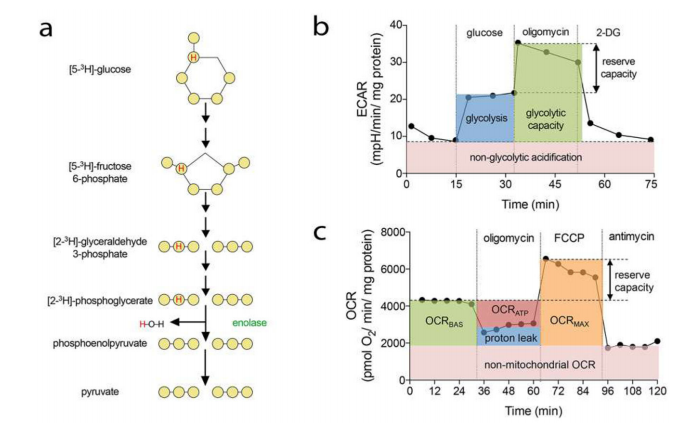
图17.用放射性示踪剂和海马XF分析仪测定EC代谢。a.用葡萄糖测量糖酵解通量的示意图。b.改良糖酵解应力试验的示意图。c.改进的海马细胞线粒体应力试验示意图。
(11)微流控分析
微流控细胞培养系统的使用改变了我们研究和处理活细胞的方式,许多研究人员利用这些系统来推进和完善我们对血管生成和微血管功能的理解。用于研究血管生成的尖端微流控细胞培养模型已经成功地结合了血管功能定量分析、体外流动室、微制造技术和3D组织支架的原理。因此,微流控方法已经实现了很好地控制化学梯度、流体流动、基质组成和细胞-细胞相互作用水平,所有这些都可以整合起来,为研究血管生成提供生理学相关的背景(如图18)。
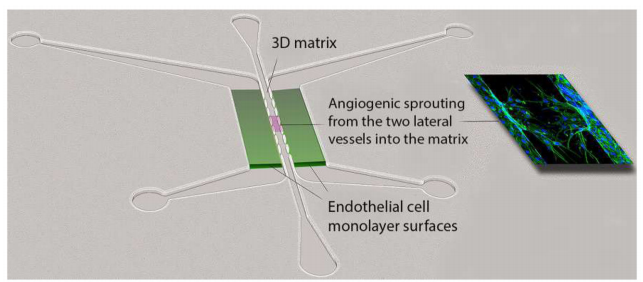
图18.分析血管生成的PDMS微流控装置。
(12)流式细胞术和细胞分选分析
癌细胞改变原发部位的微环境,有利于肿瘤的生长和扩散。肿瘤微环境(TME)由许多不同类型的细胞组成。肿瘤血管生成通过提供氧气和营养物质、细胞因子和生长因子(血管分泌效应),以及倾向转移的逃逸途径,促进局部肿瘤的生长和侵袭。在对肿瘤产生的因子的反应中,被招募的CD11b+髓系细胞向另一种激活状态(M2)极化,而不是经典的激活状态(M1)。M2极化的CD11b+细胞通过释放生长和运动因子,包括VEGF、FGF、肿瘤坏死因子(TNF)、血小板源性生长因子(PDGF)和趋化因子,促进肿瘤生长、侵袭、转移和血管生成。
传统上,TME是通过组织切片的免疫组织学染色来分析。虽然组织学技术在渲染组织形态方面具有优势,但它们也有一些相关的局限性:(1)检测指标有限;(2)染色细胞无法用于进一步分析;(3)对于大量样本,费时费力;(4)无法对细胞数量和染色信号强度精确定量。而流式细胞术可以规避组织染色的局限性。如图19所示。
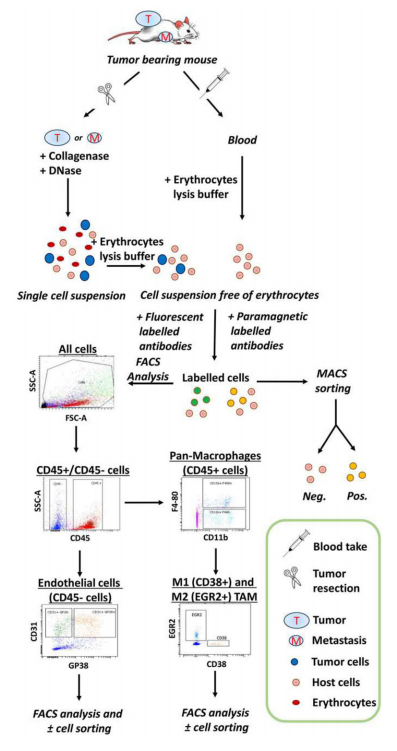
图19.流式细胞术和细胞分选实验的代表性流程图。
(13)鸡胚胎的尿囊绒膜实验(CAM)
尽管Rous 和 Murphy在1911首次报道了鸡绒毛尿囊膜(CAM)分析法,以研究哺乳动物肿瘤的异种生长,鸡胚胎本身一直是从亚里士多德开始的科学研究的目标。由于受精卵很容易获得,胚胎也很容易可视化,鸡胚胎成为实验生物学家最喜欢的目标。由于这些优越的性能,CAM不仅广泛应用于直接的血管生物学研究,还广泛应用于生物工程、化妆品检测、移植生物学、药物和疫苗开发、血管闭塞疗法或癌症研究等。鸡胚的绒毛膜尿囊膜实验如图20所示。
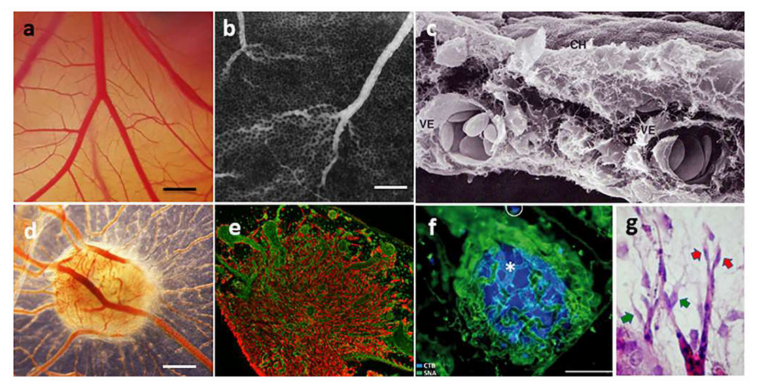
图20.鸡胚的绒毛膜尿囊膜试验(CAM)。
更多血管生成相关实验,请参考文献“Consensus guidelines for the use and interpretation of angiogenesis assays”。
优宁维可提供的相关产品:
相关抗体
| 货号 | 品名 |
| 2478 | Phospho-VEGF Receptor 2 (Tyr1175) (19A10) Rabbit mAb |
| 4060 | Phospho-Akt (Ser473) (D9E) XP® Rabbit mAb |
| 6943 | Phospho-Src Family (Tyr416) (D49G4) Rabbit mAb |
| 8556 | Phospho-FAK (Tyr397) (D20B1) Rabbit mAb |
| 4511 | Phospho-p38 MAPK (Thr180/Tyr182) (D3F9) XP® Rabbit mAb |
| 8713 | Phospho-PLCγ1 (Ser1248) (D25A9) Rabbit mAb |
| 4370 | Phospho-p44/42 MAPK (Erk1/2) (Thr202/Tyr204) (D13.14.4E) XP® Rabbit mAb |
| 8696 | Angiogenesis Antibody Sampler Kit |
| 9740 | FGF Receptor 1 (D8E4) XP® Rabbit mAb |
| 36169 | HIF-1α (D1S7W) XP® Rabbit mAb |
| 15792 | Hypoxia Pathway Antibody Sampler Kit |
| 4370 | Phospho-p44/42 MAPK (Erk1/2) (Thr202/Tyr204) (D13.14.4E) XP® Rabbit mAb |
| 8480 | β-Catenin (D10A8) XP® Rabbit mAb |
| 2500 | VE-Cadherin (D87F2) XP® Rabbit mAb |
| 9782 | Epithelial-Mesenchymal Transition (EMT) Antibody Sampler Kit |
| 3174 | PDGF Receptor α (D1E1E) XP® Rabbit mAb |
| 2519 | TGF-β Receptor III Antibody |
| 3377 | Phospho-Histone H3 (Ser10) (D2C8) XP® Rabbit mAb |
| 13110 | PCNA (D3H8P) XP® Rabbit mAb |
| 9129 | Ki-67 (D3B5) Rabbit mAb |
| 2893 | VEGF Receptor 1 Antibody |
| 33566 | VEGF Receptor 3 (D1J9Z) Rabbit mAb |
| 9586 | eNOS (49G3) Rabbit mAb |
| 77699 | CD31 (PECAM-1) (D8V9E) XP® Rabbit mAb |
细胞因子
| 货号 | 品名 |
| 42430 | Human FGF-basic/FGF2 (147 aa) Recombinant Protein |
| 75362 | Human TGF-β1 Recombinant Protein |
| 7754-BH-025 | Recombinant Human TGF-beta 1 (Human Cell-expressed) Protein |
| 210-TA-020 | Recombinant Human TNF-alpha Protein |
| 201-LB-010 | Recombinant Human IL-1 beta/IL-1F2 Protein |
| 206-IL-050 | Recombinant Human IL-6 Protein |
| 208-IL-010 | Recombinant Human IL-8/CXCL8 Protein |
| 8134-IL-025 | Recombinant Human IL-17E (Human Cell-expressed) Protein |
| 293-VE-050 | Recombinant Human VEGF 165 Protein |
| 220-BB-050 | Recombinant Human PDGF-BB Protein, CF |
| 233-FB-025 | Recombinant Human FGF basic/FGF2/bFGF (146 aa) Protein |
| 236-EG-200 | Recombinant Human EGF Protein, CF |
| 215-GM-050 | Recombinant Human GM-CSF Protein |
| 2197-AD-020 | Recombinant Human ADAMTS1 Protein, CF |
| 926-AS-050 | Recombinant Human Angiostatin Fc Chimera Protein, CF |
| 1098-ES-050 | Recombinant Human Endostatin Protein, CF |
| 971-TM-010 | Recombinant Human TIMP-2 Protein, CF |
| 3074-TH-050 | Recombinant Human Thrombospondin-1 Protein, CF |
细胞增殖检测试剂盒
| 货号 | 品名 |
| abs50010 | MTT细胞增殖及细胞毒性检测试剂盒 |
| 6813 | BrdU Cell Proliferation Assay Kit |
| 48444 | Cell Proliferation Tracer Kit (Fluorometric, Violet 450) |
细胞培养相关
| 货号 | 品名 |
| CC-3202 | EGM-2 MV BulletKit (CC-3156 & CC-4147) |
| 3445-005-01 | Cultrex 3D Cult Mat (5 mL) |
| 3632-005-02 | Cultrex PathClear BM (5 mL) |
| 3432-005-01 | Cultrex BME (5 mL) |
| 3433-005-R1 | Cultrex RGF BME Type (5 mL) |
参考文献:
[1] Bergers G , Benjamin L E . Tumorigenesis and the angiogenic switch[J]. Nature Reviews Cancer.
[2] Domenico, Ribatti, Angelo, et al. The role of microenvironment in tumor angiogenesis[J]. Genes & Nutrition, 2008, 3(1):29-34.
[3] Su D . Up-regulation of MiR-145-5p promotes the growth and migration in LPS-treated HUVECs through inducing macrophage polarization to M2[J]. Journal of Receptor and Signal Transduction Research, 2020(3):1-8.
[4] Consensus guidelines for the use and interpretation of angiogenesis assays[J]. Angiogenesis, 2018, 21(3):1-108.
上海优宁维生物科技股份有限公司
试剂 | 耗材 | 仪器 | 软件 | 定制 | 实验服务 | 供应链
免费热线:4008-168-068
咨询邮箱:info@univ-bio.com
订购商城:www.univ-bio.com
微信公众平台:优宁维抗体专家,欢迎关注!
小优博士(小程序):5大课堂, 让你的科研不再难!









 危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)
危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)  营业执照(三证合一)
营业执照(三证合一)