抗体药物是生物技术制药领域的一个重要方面。抗体具有识别抗原的特异性,因而利用抗体诊断与治疗疾病是医药研究者长期以来追求的目标。抗体与靶抗原结合具有高特异性、有效性和安全性,临床用于恶性肿瘤、自身免疫病等各种重大疾病,抗体药物的发展并不是一蹴而就的,抗体的发现以及抗体药物的临床应用经历了一段漫长的历史进程。
本期将从抗体药物的筛选,抗体免疫原性检测,单细胞筛选以及稳转细胞系的构建来讲解一下抗体药物研发的部分过程。
一、抗体筛选:
生物药的市场需求逐年扩容,其中抗体药物因其靶向性好,治疗效果显著,在生物药中占据着举足轻重的地位,目前已经进入了抗体药物发展的黄金时代。随着抗体药的需求越来越大,抗体筛选技术的发展也是日新月异,目前应用较普遍的常规技术包括有杂交瘤技术、抗体文库筛选技术、B细胞克隆技术,但是仍然有一些新型技术的出现可以更好地筛选抗体。
本文作者借助MSD平台评估了作为 SARS CoV-2 S 糖蛋白的捕获和检测抗体的性能

首先通过3 轮测试的 MSD U-PLEX 免疫分析,以及96 孔 U-PLEX 板中的每个孔可容纳 10种抗体,评估每孔 10 种捕获抗体能够快速筛选多种组合,以确定最有希望的候选对将能够敏感和特异地捕获和检测 SARS CoV-2。
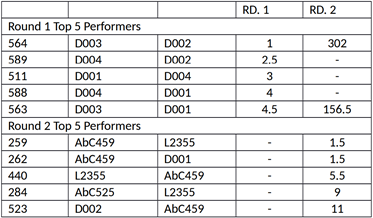
通过研究621个单独的抗体对在LFA的2轮筛选中的表现与信号/噪声和信号-噪声的关系,得出以下线条强度显示为第一轮(A)和第二轮(B)的散点图。

研究结论:
液体检测法确定了对S抗原的分析灵敏度为低皮克范围,相比以前报道的SARS的N 蛋白检测更为精准,MSD的电化学发光检测技术也提供了比传统比色法更高的灵敏度,MSD检测形式对确定的最佳候选抗体识别配对有明显的影响。
二、抗体免疫原性检测:
随着精准医学时代的到来,单克隆抗体药物因其高度的特异性和有效性成为生物类药物治疗的热点。随着单抗类药物的种类增多及广泛的应用,与其相关的免疫原性问题也逐渐浮出水面。对病人来说,免疫原性影响了药物的安全性和有效性、甚至会因为ADA和内源蛋白交叉给病人带来致命的新疾病;对企业来说,研发风险大大增加、如果到了临床开发后期才发现ADA问题,会损失惨重;对药监部门来说,免疫原性也成为头等大事,所有生物药上市前必须有免疫原性评价来确保药物的安全性和有效性。抗药抗体 (Anti-drug antibody, ADA)是抗体药物免疫原性评价的主要方式。

(抗药性抗体浓度曲线,灵敏度和钩子效应)
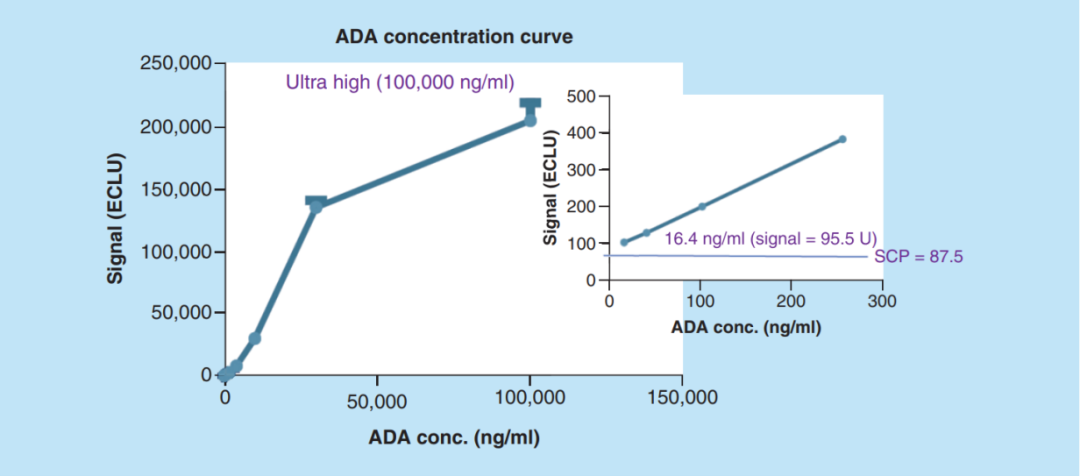
抗药物抗体浓度曲线从1,00,000 ng/ml(超高)到16.4 ng/ml。16.4 ng/ml的信号比SCPfloating高,而免疫测定的灵敏度低于16.4 ng/ml。超高的信号并没有减少,而且在1,000毫升的浓度下也没有观察到钩子效应,在1,00,000 ng/ml的浓度下没有观察到。
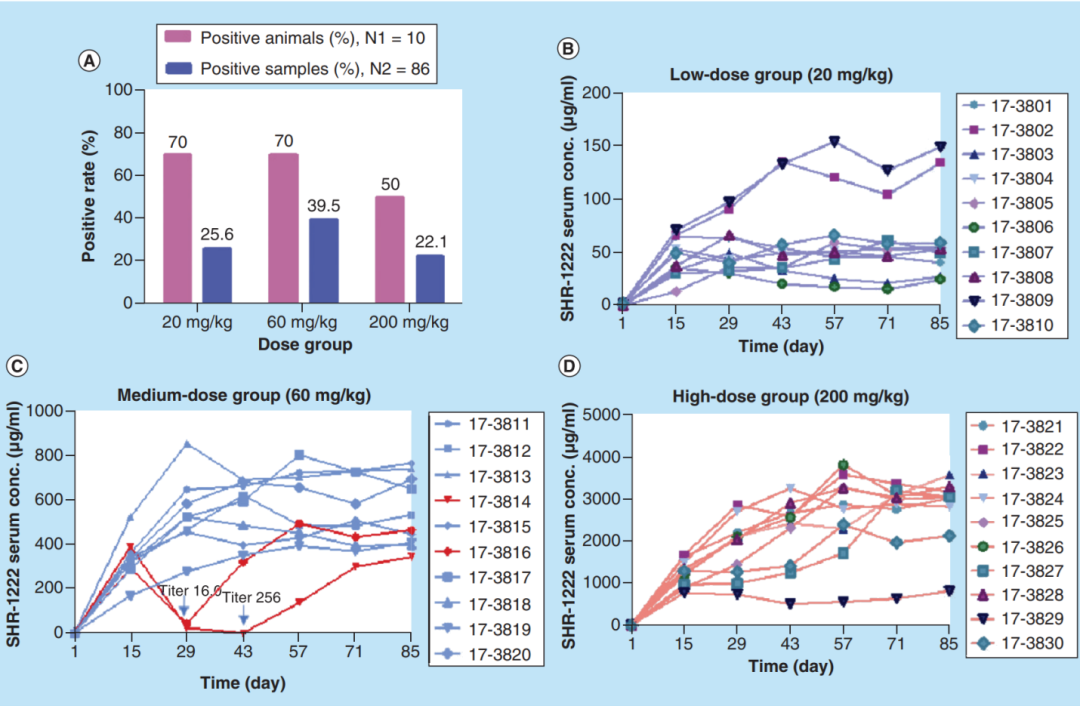
猴子皮下注射SHR-1222,剂量为20mg/kg(低剂量组)、60mg/kg(中剂量组)和200mg/kg(高剂量组),每2周一次(第1天、第15天、第29天、第43天、第57天和第85天)。57,第71天和第85天),每组10只犬猴。(A) 抗药物抗体样本分析。共收集了86份血清样本,用于ADA检测。低、中、高剂量组分别有70%(7/10)、70%(7/10)和50%(5/10)的阳性动物。中剂量和高剂量组的循环SHR-1222浓度超出了药物耐受范围,可能导致假阴性的。结果。观察到的抗药性抗体率可能不能准确反映中剂量和高剂量SHR-1222动物中ADA的真实发生率。
目前有多种方法可用于检测ADA,如ELISA、放射免疫测定、ECL测定、表面等离子体共振测定等。MSD的ECL(电化学发光技术)检测已被广泛用于ADA的检测,因为它具有极好的灵敏度,最小的样品量。因为它具有灵敏度高、对样品基质影响小、高通量和高耐药性等优点。ECL(电化学发光技术)方法包括桥接免疫原性和直接免疫原性方法。直接免疫法直接免疫原性方法通常用于小肽的检测。桥接免疫原性方法的优点是具有物种非特异性,能够检测多种类型的ADA,而直接免疫原性方法无法做到这一点。同时,桥接具有无物种特异性,能够检测多种类型的ADA,而直接免疫原性方法无法做到这一点。虽然很难区分骨架特异性的或互补性决定的区域特异性ADA,但ADA的评估仍能为治疗提供有价值的信息。
单细胞筛选技术:
单细胞的筛选有很多方法,包括有限稀释法,流式细胞术以及人磁珠分选等等,但是单细胞的分选是非常困难的,这也是普遍认同的观点,所以BD单细胞的出现给到了分选技术的又一次新的变革。
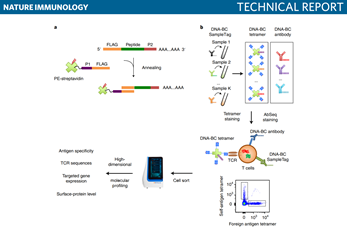
TetTCR-SeqHD的工作流程图
TCR受体技术:TetTCR-SeqHD合成了带有3ʹpoly(A)尾巴的pMHC四聚体的DNA条形码,带有荧光剂标记物,然后用与四聚体DNA条形码5'端互补的寡核苷酸序列连接的链霉亲和素与每个独特的四聚体DNA条形码退火。四聚体DNA条形码,以产生编码的链霉蛋白。编码的链霉菌素被进一步用来与负载肽的MHCs形成四聚体。每个人类T细胞样本都用一个独特的DNA编码的抗CD50抗体作为SampleTag,一组DNA编码的pMHC四聚体和一组59个DNA编码的抗CD50抗体进行染色。59种DNA编码的抗体。染色的细胞被分类,然后加载到BD Rhapsody单细胞分析平台上,进行高通量的和高维度的分子分析,包括认知抗原特异性、TCR序列、目标基因表达和表面蛋白水平。
BD单细胞不仅可以进行细胞的分选,并且可以进行mRNA的提取,以及获取高通量分子分析,获取的基因可以对包被细胞进行验证,同时测定蛋白表达水平。
与此同时,为了更好的促进抗体药物的发展,稳定构建细胞系也是至关重要的,常见的转染方法包括化学方法和磷酸钙转染,但是相关的化学试剂对细胞的损伤很大,不利于制备细胞治疗药物,那么电转染的方法将会变的有利,电转技术主要是通过电击将细胞膜穿孔,从而将目的基因转入细胞内。
三、稳转细胞系方法
Lonza电转仪技术和核感染的方法,对细胞的转染效率和存活率进行了比较:
用传统的电孔法和核感染法对人类自然杀伤细胞系NKL进行转染。5x10个NKL细胞用2.5 ug的pmaxGFPm载体进行转染;核感染:Nucleofector Solution V;Program 0-017.Competitor B electroporation :25 mV ,96 uF
用Nucleofection转染的细胞与用传统电穿孔法转染的细胞相比,显示出明显的转染效率,细胞存活率,在转染后18小时测量,在转染后18小时内,使用核转染的细胞活力更好,但是电转染的制备方法更加简单,所以应用会更加普遍。
[数据由Dr John Coligan提供,免疫遗传学实验室,NIH / NIAID, Rockvile, MD, USA。JImmunol Methods [2004] 284:133-140.]

同时,我们在我们构建好稳定细胞系之后,我们可以通过生物反应器来扩大培养,使得抗体药物规模化,产业化,我们提供迪必尔、IKA等不同规格的生物反应器来供您自由定制选择。


四、应用总结:
抗体筛选是开发单克隆抗体药物、双特异抗体药物、ADC药物和CAR-T等细胞治疗药物的必经之路。筛选出优质的候选抗体,能大大提高这些药物开发成功的可能性。近年来,我国恶性肿瘤发病、死亡率逐年上升,每年恶性肿瘤所致的医疗花费超过2200亿元。而恶性肿瘤是目前抗体药、CAR-T等细胞治疗药物治疗的最大适应,需求巨大。据统计,2021年我国抗体药物产业总市场规模已超200亿元,2015-2020年平均年增长率超20%。
相比于传统小分子药物,抗体药可作用的靶点种类更多,且出现耐药性的比例相对更低,另外还可通过提升抗体药的亲和性从而降低药物毒副作用。自1986年第一个治疗性抗体莫罗单抗-CD3被批准上市,到目前为止已经有100多个抗体批准上市。在2018年,全球药品销售额Top10中,抗体药就占据了8个,包括6个单抗药物和2个抗体融合蛋白,并且销售额占比呈上升趋势,所以利用新型免疫检测方法MSD进行抗体药筛是大势所趋,MSD不仅具有高灵敏宽线性范围,分辨率高,精度准确,样本量节省,并且高重复性,操作简单,节省时间。










 危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)
危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)  营业执照(三证合一)
营业执照(三证合一)