黑色素瘤具有高度免疫原性,免疫检查点抑制剂治疗大大提高了晚期黑色素瘤患者的生存率,但原发性黑色素瘤的肿瘤免疫微环境(TIME)特征仍不明确。病理学评估肿瘤浸润淋巴细胞(TILs)的存在和分布与原发性黑色素瘤患者的预后密切相关,表明对原发性黑色素瘤中TIME的全面表征变得越来越重要,并且基于组织原位的空间分析方法为TIME中肿瘤和免疫细胞相互作用提供了进一步的见解。
最近的研究结合了免疫特征和临床病理特征,建立了更准确的预测模型。来自澳大利亚黑色素瘤研究所的研究人员试图表征原发性黑色素瘤的TIME,并确定患者预后的预测因素。研究中使用多重荧光免疫组化(mIHC)的方法对原发性黑色素瘤免疫微环境进行了空间表征,特别针对CD8+ T细胞、B细胞、NK细胞、Langerhans细胞和MHC I类分子的表达,使用HALO进行了组织病理学的定量评估,并将这些特征与肿瘤临床病理学特征和患者结果数据相关联。
一 研究方法
研究首先使用流式细胞术对II期原发性黑色素瘤新鲜组织(n=6)中的CD8+ T细胞进行表型分析,鉴定出富含PD-1表达的CD39+肿瘤驻留CD8+ T细胞亚群。然后对来自长期随访患者的II期原发性黑色素瘤样本(n=66)使用两个抗体Panel进行mIHC染色(T Cell Panel:PD-1、CD103、CD8、CD3、CD39、SOX10;Immune Cell Panel:CD56、CD1a、C20、HLA-ABC、Langerin、SOX10),分别标记CD8+ T细胞亚群以及B细胞、NK细胞、Langerhans细胞和MHC I类分(图1)。组织成像后基于HALO进行定量病理学的免疫分析,包括细胞表达量评估、细胞间邻近距离的分析以及免疫细胞的浸润程度分析,最后并根据初次诊断后5年的复发状态比较患者的预后情况。
1)基于HALO的细胞定量评估
首先基于HALO组织分型算法,对肿瘤、周围的表皮和间质区域进行分类。随后基于每个标记物的细胞质或核染色强度,为每个样品单独设置阳性阈值。同时在HALO中根据标记表达进行表型分型,CD8+ T细胞根据CD39、CD103和PD-1的表达进行表型分型(图1),将它们分为8个表型不同的群体(P1到P8)。每个细胞的标记表达和X、Y位置的数据存储在HALO中。HALO图像配准算法用于对两个Panel染色的连续切片的图像进行对齐。这允许在同一图上绘制两个Panel的表型,并分析来自不同Panel的细胞之间的空间关系。
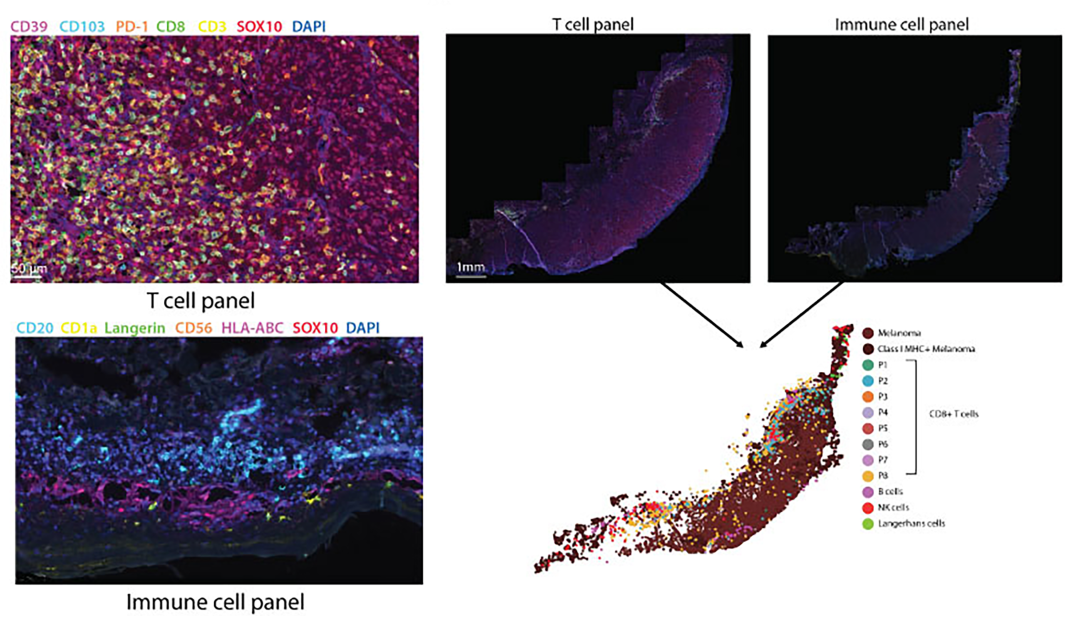
图1原发性黑色素瘤mIHC染色示例及免疫细胞亚群表型分型
2)基于HALO进行细胞间距离的空间位置分析
此外,基于HALO空间分析算法进行细胞间邻近距离分析、细胞浸润程度分析。邻近距离分析用于确定每个表型与黑色素瘤细胞的平均距离以及黑色素瘤细胞20µm范围内每个表型的百分比(图2A)。20µm截止值是根据先前研究的分析选择的。浸润程度分析用于研究肿瘤边缘的免疫细胞亚群的分布特征。由HALO组织分类算法确定的肿瘤和表皮/间质之间的边界,并通过手动调整以提高准确性。分析边缘周围400µm宽的区带,分为50µm宽的部分,延伸到间质(0到50µm、50到100µm、100到150µm、100到200µm)和肿瘤(0到-50µm、-50到-100µm,-100至-150µm,-150至-200µm),在每个区带内分别量化免疫细胞(图2B)。
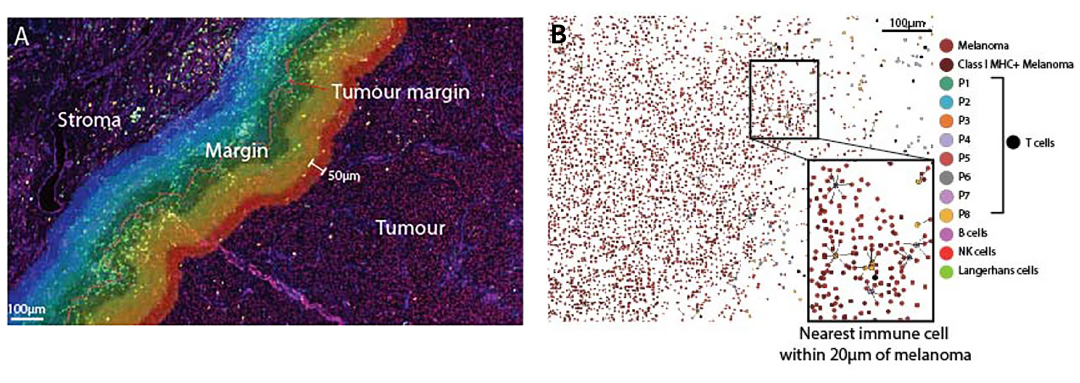
图2 基于HALO进行细胞间距离的空间位置分析
二 研究结果
1)P2免疫细胞群的表征与原发性黑色素瘤的良好结果密切相关
为了研究CD8+ T细胞亚群在TIME的空间分布和患者预后结果的关联,在肿瘤和间质区域中对免疫细胞的密度进行定量,并在不同组之间进行了比较。发现预后良好和不良的患者肿瘤内不同免疫细胞亚群的表达具有较大差异,并且P1、P2、P4和P6的肿瘤内密度增加与良好的结果相关(图3A)。肿瘤内免疫细胞之间的相关性分析确定了3个不同的免疫细胞簇,它们更有可能存在于同一肿瘤中(图3B)。具有良好结果的患者黑色素瘤细胞的I类MHC表达增加,但不显著(图3C)。评估CD8+ T细胞表型占总CD8+ T细胞的比例(图3D-F),发现预后良好的患者P2免疫亚型密度更高,并且是唯一与预后显著相关的细胞亚群。同时,经病理学家评估,在任何间质组织中均未观察到三级淋巴样结构(TLS)。
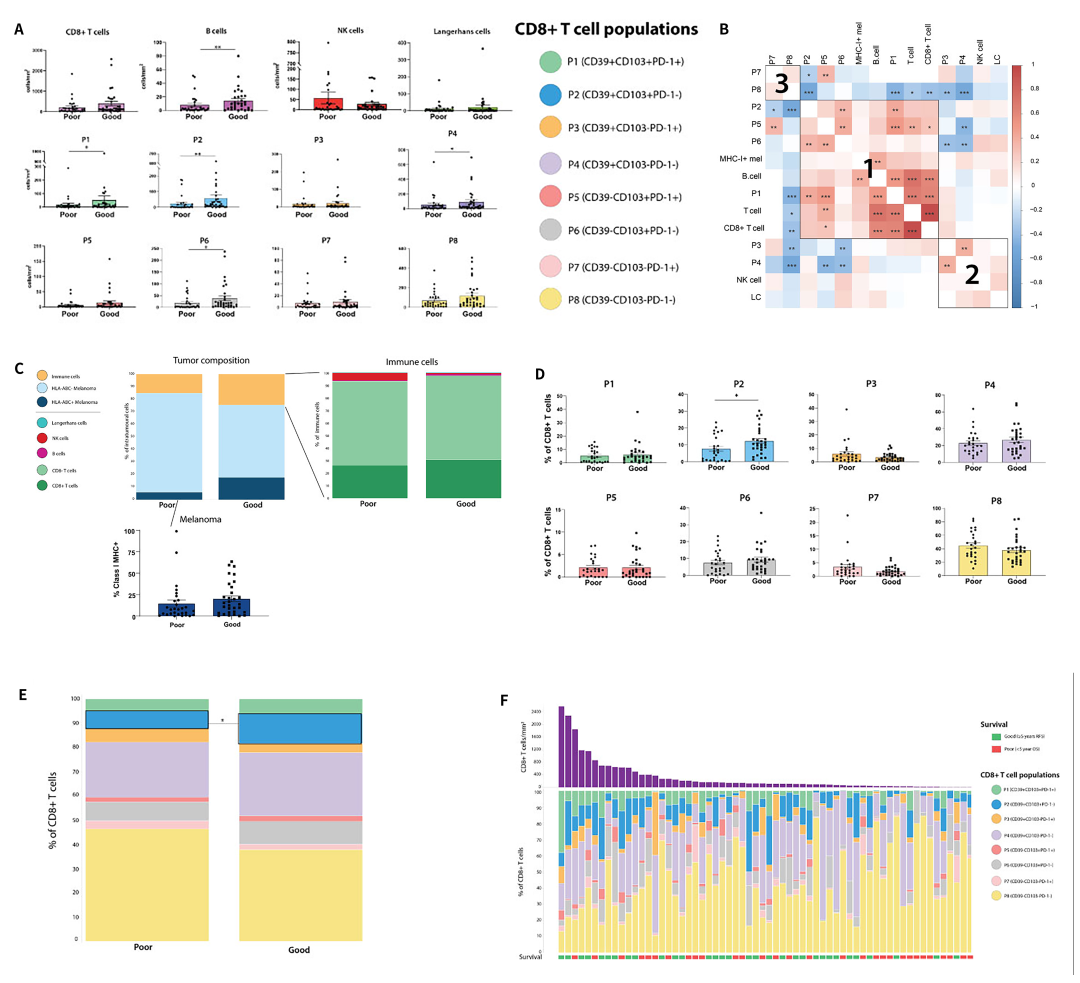
图3 原发性黑色素瘤内免疫细胞的组成及与患者预后的关联
2)B细胞和CD103+PD-1-CD8+ T细胞与黑色素瘤细胞的邻近程度预测患者预后
对所有免疫细胞类型进行空间分析以确定它们与黑色素瘤细胞的接近程度。首先检测了从黑色素瘤细胞到最近的免疫细胞的平均距离(图4A)。发现CD39+ CD8+ T细胞表型(P1-P4)、P6(CD39-CD103+PD-1-)和B细胞明显更接近于黑色素瘤,患者预后越好(图3A)。然后基于20µm截止值量化每种免疫表型20µm内黑色素瘤细胞的百分比,发现在预后良好的患者中,P2和P6与黑色素瘤细胞的距离明显更近(图4B)。
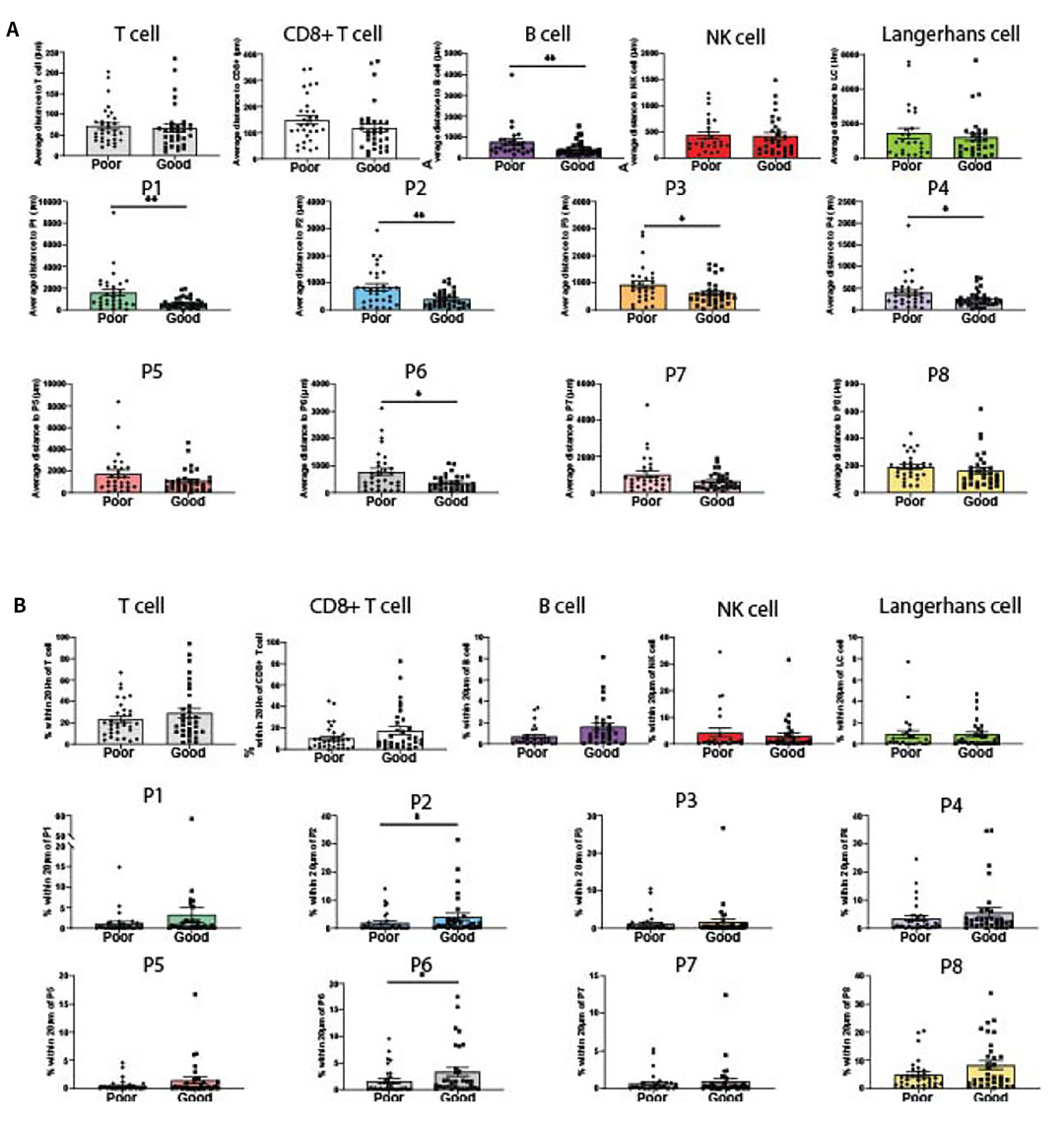
图4 黑色素瘤细胞与免疫细胞亚群的邻近距离分析
3)肿瘤/间质交界面免疫细胞亚群的浸润程度与患者预后的相关性分析
研究同时对肿瘤/间质交界面或边缘免疫细胞的相互作用进行了观察。发现B细胞、NK细胞、T细胞和CD8+T细胞,以及单独的P3、P4、P7和P8更有可能定位于边缘的间质侧。比较不同组之间肿瘤边缘组成的差异,并在每50µm边缘区域内单独进行比较,发现除Langerhans细胞外的所有免疫细胞群中均观察到显著差异(图5)。
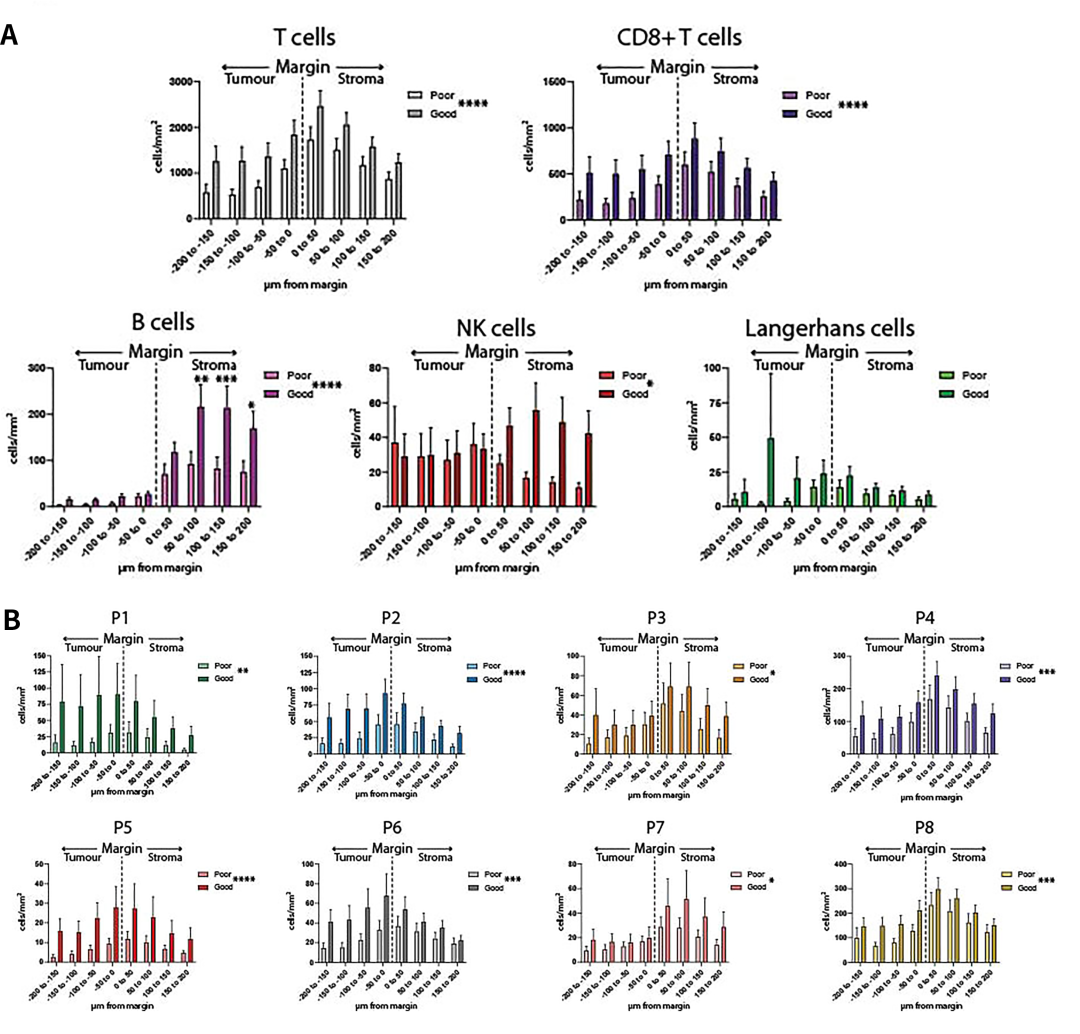
图5肿瘤/间质交界处不同免疫细胞亚群的浸润情况
三 研究结论
本研究使用HALO对mIHC染色的组织样本进行定量评估,调查原发性黑色素瘤的肿瘤微环境,并确定定量病理学和免疫表型是否可以作为临床病理学特征的补充,以识别处于疾病复发高风险的患者。研究强调了原发性黑色素瘤中TIME的特征如何为免疫系统和肿瘤的复杂相互作用,并如何改变疾病结果提供新的见解。在目前对高危II期原发性黑色素瘤进行辅助抗PD-1治疗的临床试验的背景下,对B细胞和P2细胞亚群的评估可以识别有复发风险的患者,并有助于在原发性黑色素瘤诊断点做出长期治疗决策。
关于我们
Indica Labs为您提供病理图像分析的全套解决方案,包括可进行高通量、全切片式的组织分析的图像分析的病理图像分析平台HALO®和人工智能系统HALO AI™,以及可以实现数据管理和与外界共享的HALO Link™系统。凭借无与伦比的易用性和可扩展性,在免疫肿瘤学、肿瘤学、移植科学、神经科学、眼科、代谢、呼吸和毒性病理学等领域有着广泛的应用。目前用户遍布于全球的生物制药公司、医疗和研究组织。











 危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)
危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)  营业执照(三证合一)
营业执照(三证合一)