众所周知肿瘤微环境是及其复杂的,空间异质性是其基本特征。特定的免疫细胞直接或间接地与肿瘤细胞相互作用,这种不断发展的关系会影响肿瘤的生物学。空间原位信息对于揭示细胞行为和相互作用的关系至关重要。通过识别免疫微环境中生物标志物的位置,可以更加有效的评估癌症风险和预后。
为了获得关于肿瘤免疫微环境(TIME)的多样化信息,不仅需要关注其组成和分子特征,更需要关注其组成成分的空间位置,即TIME的空间结构。细胞与细胞之间的距离,由细胞与最近邻的其他细胞之间的距离或定义为细胞一定范围内其他细胞的密度来评估(图1)。测量免疫细胞与其他细胞之间的距离可以提供更加细致、精确和直接的视图来理解免疫细胞的空间结构。免疫细胞和肿瘤细胞之间的距离可能直接反映免疫细胞对肿瘤的杀伤力,或者相反,肿瘤细胞对免疫细胞的编辑。不同免疫细胞之间的距离可能反映了免疫细胞群中普遍存在的相互作用,并有助于研究人员更好地了解所有免疫细胞的整体。

图1 免疫细胞和肿瘤细胞之间邻近距离分析示例图
研究TIME中细胞间相互作用的空间邻近关系已经成为临床研究领域的重要一环。我们汇总整理了基于HALO空间邻近距离分析的方法以及近期发表的应用案例,将通过两期为大家进行分享。
01 空间邻近距离与宫颈癌转移的潜在机制研究(PD-1与PD-L1细胞)

SPOP蛋白与宫颈癌患者的盆腔淋巴结(pLN)转移和预后相关。研究根据SPOP蛋白的表达将患者分为两组(Low-Group及High-Group),比较不同免疫细胞浸润的差异,探讨宫颈癌转移的机制。结果表明PD-L1及PD-1的表达在High-Group及Low-Group的表达无显著差异,表明SPOP蛋白不影响PD-L1或PD-1的表达。然而,Low-Group中PD-L1 100μm范围内的PD-1的平均数量显著高于High-Group(P<0.01),表明随着SPOP表达的增加,PD-1在空间距离方面明显远离PD-L1。因此,SPOP可能通过使PD-1在空间距离上远离PD-L1来促使宫颈癌的转移。这可能是SPOP促进宫颈癌转移的潜在机制。

图 SPOP可能通过抑制PD-1和PD-L1之间的空间接近度来促进迁移。A, B. SPOP不影响PD-L1表达(A)或PD-1(B)表达;C. 随着SPOP表达的增加,PD-1在空间距离上显著远离PD-L1。
02 空间邻近距离与肾细胞癌中抗肿瘤机制研究(浆细胞PCs与成纤维细胞)

肿瘤内三级淋巴结构(TLS)的存在与积极的临床结果和对癌症免疫治疗的反应有关。为了分析肿瘤内浆细胞(PCs)和成纤维细胞的位置以及CXCL12的原位表达,研究评估PCs和成纤维细胞之间的空间关系。首先基于HALO AI对DAPI、MUM1、IgG、IgA荧光染色的样本上的成纤维细胞核进行检测,成纤维细胞核的检测映射了COL1+成纤维细胞轨迹。结果发现绝大多数PCs与成纤维细胞核非常接近,两个细胞的平均距离分别为17.5μm和19μm。在44个肿瘤样本上测得的平均距离为25.7μm。这些数据概括了免疫球蛋白(Ig)和成纤维细胞转录物的共表达,以及成纤维细胞转录物和CXCL12的共表达,并验证了PCs在TLS内的位置以及空间转录组学确定的成纤维细胞网状细胞(FRC)空间上的位置。
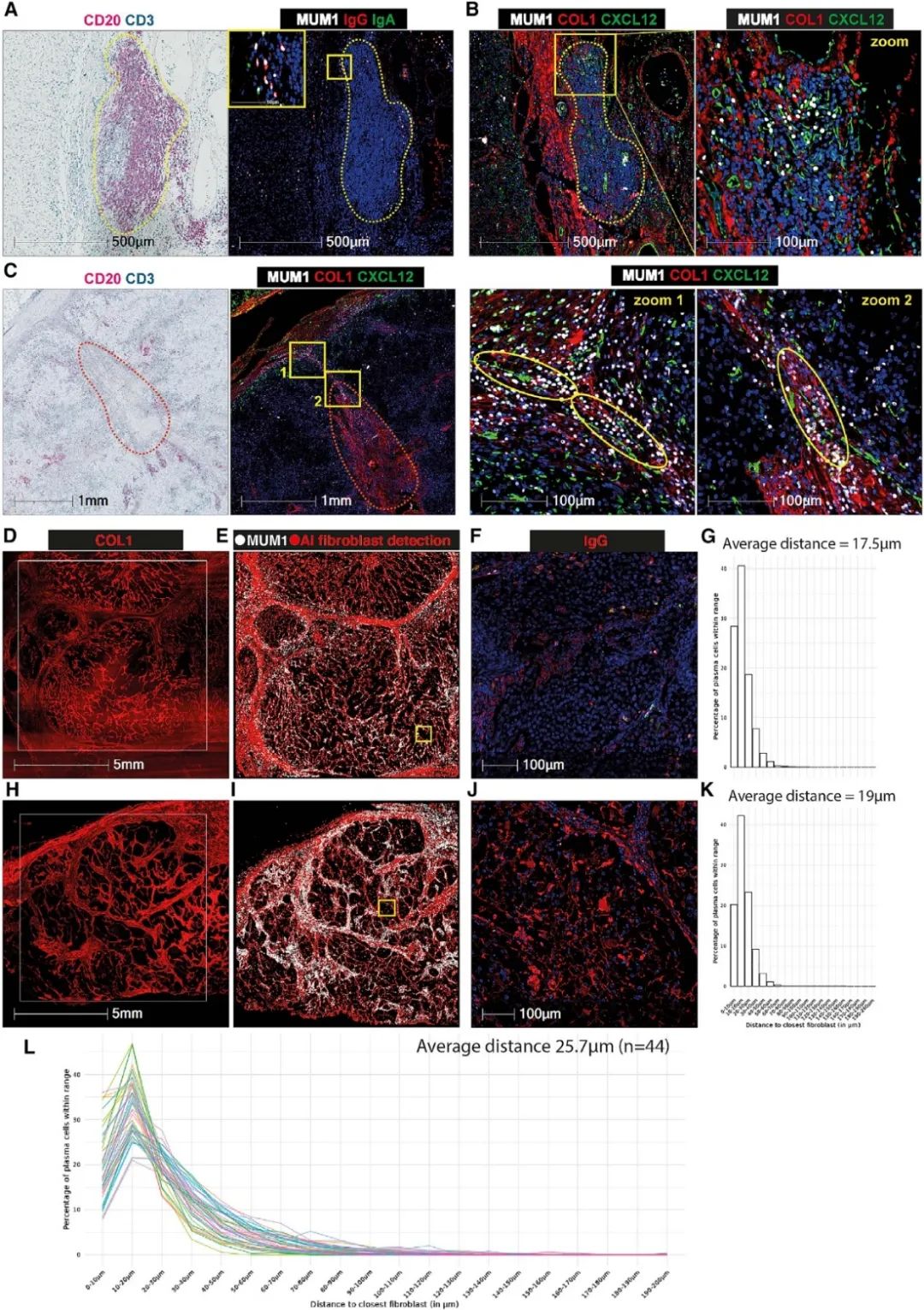
图 在TLS+肿瘤中,PCs与成纤维细胞的共定位及IgG染色。G、K. MUM1+ PCs与肿瘤成纤维细胞核之间距离的直方图;L. 44个肿瘤的MUM1+ PCs与成纤维细胞细胞核之间的距离分布。
03 空间邻近距离揭示胃癌免疫抑制微环境(TIGIT+CD20+B细胞与PD-1+CD8+T细胞)

为了探讨含免疫球蛋白和ITIM结构域的T细胞免疫受体(TIGIT)在B细胞上的表达及TIGIT+CD20+B细胞在胃癌(GC)中的作用,利用多重免疫荧光染色探讨TIGIT+ CD20+ B细胞与CD8+T细胞耗竭之间的关系。其中PD-1+CD8+T细胞可以通过在多种恶性肿瘤中形成免疫逃逸微环境来促进肿瘤进展。先前的研究表明TIGIT+B细胞可以影响T细胞的功能,进而参与免疫调节。因此基于HALO检测TIGIT+B细胞和PD-1+CD8+T细胞之间的距离。结果发现PD-1+CD8+T细胞比TIGIT-CD20+B细胞更接近TIGIT+CD20+B细胞。表明TIGIT+CD20+B细胞可能通过参与CD8+T细胞的耗竭在胃癌的进展中起关键作用。

图 胃癌组织中TIGIT+CD20+ B细胞的空间分布及其与PD1+CD8+ T细胞的相关性。A. 多重荧光免疫组化染色(DAPI-蓝色、TIGIT-绿色、CD20-紫色、PD1-黄色和CD8a-红色)染色的代表性图像;B, C. TIGIT+ CD20+ B细胞、TIGIT-CD20+ B细胞和PD1+CD8+ T细胞的空间分布;D. 代表性的HALO空间邻近距离直方图,显示距离TIGIT 中心30μm半径范围内的PD1+CD8+ T细胞CD20+ B细胞(左)和TIGIT+CD20+ B 细胞(右); E. 从PD1+ CD8+ T 细胞到TIGIT-CD20+ B细胞和TIGIT+ CD20+ B细胞的平均距离。
04 胃癌分子亚型中肿瘤和免疫细胞的空间分布与PD-L1表达相关(CD8+ T细胞与肿瘤细胞)

EBV阳性和错配修复缺陷(MMRd)胃癌(GCs)显示出更高水平的肿瘤浸润淋巴细胞(TILs)和PD-L1表达,因此对免疫治疗的反应更深刻。研究分析了与EBV阳性和错配修复缺陷型肿瘤相比,EBV阴性错配修复能力强的胃癌中PD-L1表达、肿瘤浸润淋巴细胞及其与肿瘤细胞的空间关系,以确定易受感染的免疫原性表型。
根据患者EBV和MMR状态(对所有病例互斥)分为三个亚型:EBV+、MMRd和EBV-MMRp。计算每个TMA芯点的CD8+肿瘤内和肿瘤周围淋巴细胞的数量及其与肿瘤的距离。下图A,B显示了通过CD8和Pan-CK的双重免疫组化染色的肿瘤的代表性图像,以及基于HALO定量分析后的图示。图C、D显示了三个亚型中所有肿瘤内和肿瘤周围CD8+淋巴细胞(CD8all)或仅肿瘤内CD8+细胞(上皮内或紧邻,即距肿瘤上皮≤1μm;CD8int)的分布图示。发现与EBV-MMRpGCs相比,EBV+和MMRd胃癌患者还显示CD8+TILs与肿瘤细胞的数量和接近度增加。

图 肿瘤内和肿瘤周围CD8+细胞的空间邻近距离分析。A. 胃癌TMA双重免疫组织化学染色; B. 基于HALO空间邻近距离分析图示,证明了细胞检测和肿瘤边界的准确性;C,D. 所有上皮内和肿瘤周围(CD8all)或在不同GC亚型中每个TMA芯点仅肿瘤内(CD8int)CD8+细胞的分布。










 危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)
危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)  营业执照(三证合一)
营业执照(三证合一)