在过去的几个世纪里,肿瘤的概念已经从一个异常增殖细胞的简单聚集演变成一个高度组织的“器官”。构成肿瘤的各种成分被称为肿瘤微环境,在肿瘤发生发展过程中,包括但不限于巨噬细胞、DC(dendritic cell)、中性粒细胞、B细胞、T细胞、CAF(tumor associated fibroblast)等多种细胞被招募到肿瘤细胞周围的微环境中,与ECM(extracellular matrix)等元素共同构成TIME(tumor immune microenvironment)(图1)。

图1 TIME的组成
在Binnewies M等人的报告中,将TIME分为三种类型 (图2):I类,在肿瘤核心中广泛存在免疫细胞但CTLs(细胞毒淋巴细胞)相对缺乏的TIMEs称为I-E(infiltrated-excluded)TIMEs,缺乏激活标记物的表达和肿瘤核心的排斥是免疫忽视的特征,在这种免疫状态下,适应性免疫无法识别或对病原体或恶性肿瘤做出反应,该肿瘤也称为”冷”肿瘤;II类,I-I(infiltrated-inflamed)TIMEs被认为是免疫“热”肿瘤,其特征是表达PD-1的CTLs和表达免疫抑制PD-1配体PD-L1的白细胞和肿瘤细胞的高度浸润;III类 I-I TIMEs的一个子类,称为TLS-TIMEs,该类型显示出了TLSs(tertiary lymphoid structures)的组织学证据,其细胞组成类似于淋巴结中的淋巴结,TLSs通常但并不总是与良好的预后相关。
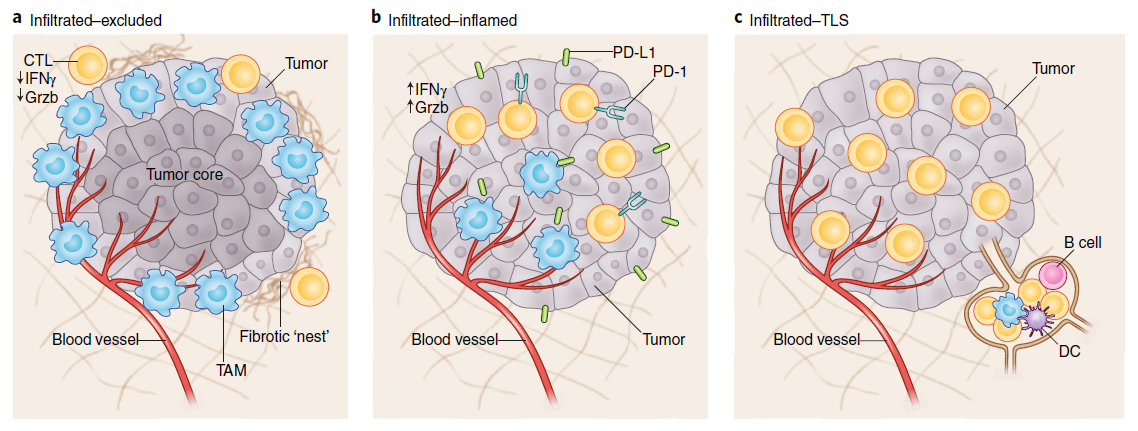
图2 三种类型的TIME结构图。a, I-E类型TIMEs的特征是肿瘤核心排除CTLs。I-E TIMEs中的CTLs沿肿瘤外周出现,与Ly6Clo F4/80+肿瘤相关巨噬细胞接触或“卡在”纤维化巢中。b, I–I TIMEs由大量的表达PD-L1的肿瘤和髓系细胞,及以Grzb、IFNγ和PD-1表达为特征的高度激活的CTLs定义。c, TLS-TIMEs具有含有TLSs的组织学证据,聚集了多种免疫细胞,其成分与淋巴结中的相似,包括B细胞、树突状细胞和Treg细胞。
TIME的复杂性是由于不受控制的癌细胞增殖、代谢和缺陷的血管发育等一系列过程引起的。酸性pH条件、缺氧、内源性H2O2和ECM蛋白表达的改变是TIME的重要标志,它在肿瘤发生中起着关键作用。酸性pH值通过促进VEGFA(vascular endothelial growth factor A)和IL‐8(interleukin-8)等血管生成因子的表达,是癌细胞迁移和侵袭的主要参与者之一,酸性pH来自于膜蛋白如ATP酶等的厌氧糖酵解排泄质子(H+)和乳酸。另外,低氧这一特征也在许多TIME中发现,位于肿瘤中心位置的细胞由于与现有血管的距离远出现缺氧情况,导致营养供应被剥夺,因此,肿瘤细胞会上调缺氧诱导的血管生成因子,如VEGF,以克服增殖限制,然而,新生血管正常血管相比具有一定的缺陷,肿瘤血管内皮细胞具有间隙,导致血管渗漏和非层流,进而导致灌注的不连续性,使血液凝固和局部组织水肿。
肿瘤免疫微环境像一个肿瘤免疫促进与抑制的战场,肿瘤免疫的过程包括(图3):1)肿瘤细胞发生死亡并释放细胞相关抗原;2)树突状细胞捕获抗原经加工后通过MHC(Major histocompatibility complex)将抗原呈递至·细胞外;3)在多种细胞因子的作用下使T细胞启动和激活;4)在趋化因子如CX3CL1、CXCL9等的作用下T细胞招募至肿瘤部位;5)活化后的T细胞浸润到肿瘤位置;6)活化的T细胞对相应肿瘤细胞进行识别;7)T细胞通过分泌颗粒酶、穿孔素等杀死肿瘤细胞。在这一过程中,肿瘤细胞也通过各种作用衍生出了对抗免疫的机制,如a减少最具免疫原性抗原的表达;b通过多种机制如分泌免疫抑制因子IL-6,IL-10使DC功能紊乱抑制其抗原递呈能力;c抑制T细胞向肿瘤的浸润;d 免疫抑制细胞如M2类型的巨噬细胞、MDSC(myeloid‐derived suppressor cell)的调节作用;e免疫抑制信号通路的激活及免疫抑制方面的代谢的增强如无氧糖酵解引起的酸性环境等等,这些过程最终导致了肿瘤细胞的免疫逃逸。

针对肿瘤的治疗方面,在过去的十年里发生了一场新的变革,肿瘤药物,广泛的从例如化疗和放疗转向使用基于抗体的免疫疗法,调节针对肿瘤的免疫反应。第一代基于抗体的免疫疗法,即所谓的ICB(immune-checkpoint blockade),通过阻断分子的受体和/或配体相互作用起作用,如PD-1和CTLA-4,这些分子参与削弱T细胞的激活及功能。ICB疗法对少数患者显示出显著的临床获益,这些患者表现出持久的反应。对接受ICB治疗的患者群体的回顾性分析显示,有不同类型的TIME与那些更容易发生ICB反应的肿瘤相关。不幸的是,对于大多数对ICB无反应的患者,仍有未满足的临床需求。
基于化疗药物的免疫调节作用,如一些细胞毒性化疗药物可诱导免疫原性细胞死亡,刺激抗肿瘤免疫应答;还可以促使TAM从免疫抑制的M2型向免疫促进的M1型的巨噬细胞的复极化,化疗可能是α-PD-1/PD-L1的合适搭档,以实现快速和长期的癌症控制。目前,化疗联合α-PD-1/PD-L1已成为一些癌症患者的标准治疗选择,目前有数百项临床试验正在探索化疗联合α-PD-1/PD-L1的疗效和安全性,如阿特珠单抗联合化疗免疫疗法。另外,与一些化疗药物一样,放疗也可以诱导免疫原性细胞死亡,增强抗肿瘤免疫反应,而且放疗还可以促进了T细胞浸润,增加TILs的数量,并扩大TIME中的T细胞受体(TCR)库,增加肿瘤细胞上的MHC-I,与α-PD-1/PD-L1联合治疗可减轻对后者的耐药性。α-PD-1/PD-L1抗体联合VEGF抑制剂的治疗,也显示出良好的效果,但目前均处于临床阶段。除此之外,其它联合免疫检查点治疗的方案还有多种,比如双免疫检查点抗体,联合CAR-T治疗等等。
尽管许多联合方案在临床前研究中表现出强大的抗肿瘤活性,但一些积极的临床前发现无法在临床中得到验证。目前,FDA或NMPA仅批准α-PD-1/PD-L1与化疗、血管生成抑制剂或α-CTLA-4联合使用。对于大多数组合,显著的抗肿瘤活性在动物肿瘤模型中是有限的。因此,如何选择最优的临床前模型是确定联合方案活性的一大挑战。随着双功能或双特异性抗体等下一代α-PD-1/PD-L1药物的开发,α-PD-1/PD-L1治疗的适应症将大大扩展,希望更多患者可以从新的药物研发中受益。
12月20日下午1:30,优宁维应用科学家Chaya将在小优大学堂给大家分享肿瘤微环境相关背景、相关机制和药物治疗及相关案例.
识别下方图片二维码即可提前报名

参考文献
1 Tang T, Huang X, Zhang G, et al. Advantages of targeting the tumor immune microenvironment over blocking immune checkpoint in cancer immunotherapy[J]. Signal transduction and targeted therapy, 2021, 6(1): 1-13.
2 Binnewies M, Roberts E W, Kersten K, et al. Understanding the tumor immune microenvironment (TIME) for effective therapy[J]. Nature medicine, 2018, 24(5): 541-550.
3 Liu Y, Guo J, Huang L. Modulation of tumor microenvironment for immunotherapy: focus on nanomaterial-based strategies[J]. Theranostics, 2020, 10(7): 3099.
4 Fu T, Dai L J, Wu S Y, et al. Spatial architecture of the immune microenvironment orchestrates tumor immunity and therapeutic response[J]. Journal of hematology & oncology, 2021, 14(1): 1-25.
5 Yi M, Zheng X, Niu M, et al. Combination strategies with PD-1/PD-L1 blockade: current advances and future directions[J]. Molecular cancer, 2022, 21(1): 1-27.










 危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)
危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)  营业执照(三证合一)
营业执照(三证合一)