肝脏疾病是世界范围内导致人类死亡的主要原因之一,并且呈逐年上升趋势。几种形式的程序性细胞死亡,包括凋亡,坏死和铁死亡,都与各种肝病的发病机制有关,因此,阻断肝细胞死亡可以为保护肝脏免受损伤和相关疾病提供一种有效的策略。
铁死亡是一种铁依赖性的细胞死亡形式,小优之前也整理过几篇铁死亡相关文章,从研究历程到正式命名,再到通路研究,不清楚的同学可以戳链接再了解。越来越多的研究表明,铁死亡在血色素沉着病、酒精相关性肝病(ALD)、丙型肝炎病毒(HCV)感染、非酒精性脂肪性肝炎(NASH)和肝细胞癌(HCC)等多种肝病的发病机制中起着重要作用。因此,靶向铁死亡可能为治疗肝病患者提供一种有前途的新治疗策略。
一、肝脏主要代谢途径

图1:肝脏中葡萄糖、脂类和氨基酸代谢通路
肝脏作为人体糖、脂类和氨基酸等营养物质的代谢中心,其代谢功能异常会导致细胞氧化应激、肝脏代谢性疾病甚至死亡。在这一过程中,许多代谢通路和代谢产物都与铁死亡发生密切相关,例如NADPH的生成和脂肪酸代谢等。在诱发铁死亡后,NADPH水平会显著降低,代谢NADPH途径通过介导GSH和CoQ10的合成来抑制铁死亡。因此,NADPH可以被用作铁死亡的生物标志物。有些氨基酸通过调节氧化应激也与铁死亡直接相关。例如,半胱氨酸是谷胱甘肽合成的限制性氨基酸,通过胱氨酸/谷氨酸反转运蛋白SLC7A11抑制其输入,就可通过消耗谷胱甘肽水平从而诱发铁死亡。
二、肝脏中的铁代谢

图2:肝脏中的铁代谢
铁通过TFR1和SLC39A14运输到肝细胞内参与各项生理过程和代谢过程,多余的铁储存在铁蛋白(ferritin)中,最后由铁泵蛋白(ferroportin,FPN)外排。铁调素(hepcidin)、RNF217和IRP等众多调控因子构成了胞内精密且复杂的调控网络。核受体共激活剂(NCOA4)可以作为一种与铁蛋白结合的受体,将其输送到自溶酶体可释放游离铁。过量的游离铁就会介导芬顿反应,引起多不饱和脂肪酸的脂质过氧化和最终的铁死亡。
“脂质过氧化”是一个模糊的概念,因为其产物可以通过自氧化(由碳和氧中心自由基介导)或酶催化过程自发形成。含有双烯丙基碳的多不饱和脂肪酸 (PUFAs) 对脂质过氧化非常敏感,且多种PUFAs可能参与铁死亡途径。而细胞是否发生铁死亡很大程度上取决于来自亚细胞器(如线粒体、溶酶体和过氧化物酶体)的交织信号,它们在铁死亡过程中会调节ROS的产生和脂质氧化,例如线粒体可以通过对ROS产生、TCA循环、铁代谢和线粒体DNA的整合调节,是铁死亡的重要调节因子。
三、肝脏中铁死亡的调控
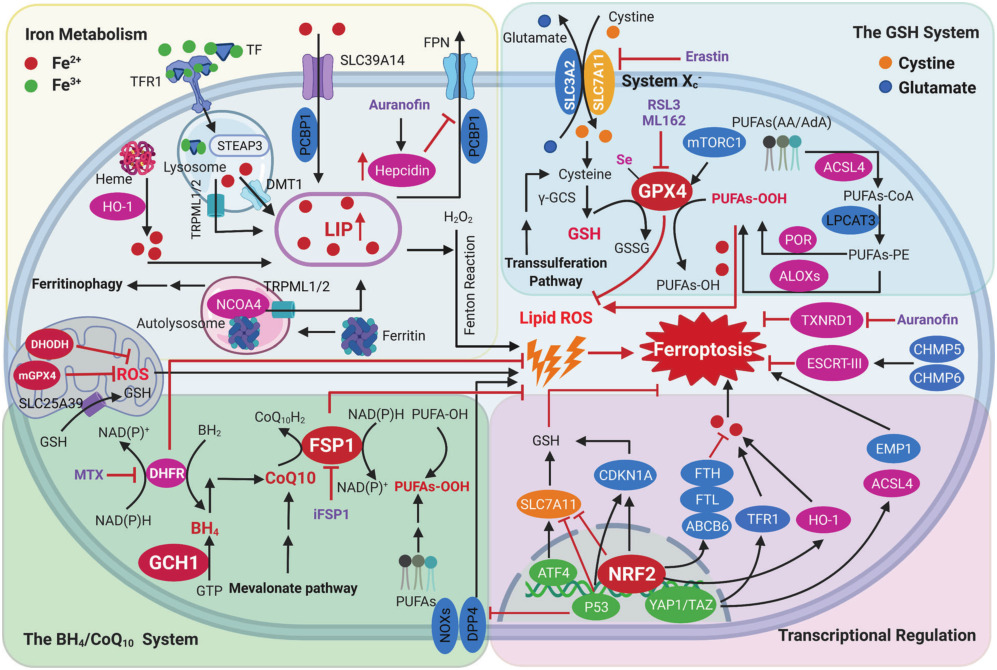
图3:铁死亡过程中的调控信号通路和防御机制
除铁代谢通路参与了铁死亡调控以外,还有多条代谢通路和抗氧化系统参与铁死亡发生,这些通路包括GSH/GPX4轴、NAD(P)H/FSP1/CoQ10系统和GCH1/BH4/DHFR系统。在线粒体中,mGPX4和DHODH会参与ROS清除,一些转录因子如ATF4、NRF2、p53和YAP1/TAZ在调控铁死亡过程中发挥了重要的作用。
GSH/GPX4 axis 抑制铁死亡
在催化活性铁存在的情况下,GSH/GPX4在抑制特定磷脂氢过氧化物的生成中起着重要作用。该系统的上游部分是XC-系统,它是一个由SLC7A11通过二硫键连接到调控亚基SLC3A2形成的谷氨酸反转运蛋白。当细胞内缺乏半胱氨酸,抑制XC-系统会激活细胞发生铁死亡。细胞中GPX4表达下调则会对铁死亡更敏感,敲除GPX4即可诱导铁死亡发生;相反,若上调GPX4的表达,则会产生对铁死亡的耐受。
NAD(P)H/FSP1/CoQ10系统抑制铁死亡
研究发现,FSP1通过促进ESCRT-III以不依赖CoQ10的方式介导膜修复,从而防止铁死亡,因此,FSP1-CoQ10和ESCRT-III在铁死亡过程中都在修复膜损伤中发挥作用。鉴于CoQ10是线粒体电子传递途径中必不可少的辅助因子,同时也是脂溶性抗氧化剂,那我们可以推测FSP1-CoQ10和ESCRT-III具有互补功能。综上所述,这些发现表明FSP1可以通过调控途径之间复杂的相互作用阻止铁死亡。
线粒体和 DHODH 抑制铁死亡
线粒体对于维持细胞活力至关重要,因为它们在生物能量学、新陈代谢和各种信号通路中发挥关键作用。线粒体呼吸过程中会产生ROS,ROS通过与脂质双分子层中的PUFAs反应触发脂质过氧化诱导细胞死亡。DHODH和线粒体GPX4构成了另外两种防御酶,可以解毒线粒体中的脂质过氧化物。作为一种含铁的黄素依赖酶,DHODH可以将嘧啶生物合成途径与线粒体呼吸链结合,这为靶向DHODH治疗GPX4low癌症提供了可能的策略。
氧化应激相关转录因子调节铁死亡
铁死亡是一个高度复杂且可修改的过程,需要转录因子来抑制或激活铁死亡相关基因的表达。TP53、NRF2、ATF4、YAP1、TAZ 等多种转录因子在铁死亡中的作用总结于图3。在这些转录因子中,NRF2是铁死亡的关键负调节因子,其活性由KEAP1/CUL3/RBX1/E3泛素连接酶复合物介导。在被激活之后,NRF2可调节 FTH1、FTL1、SLC40A1、ABCB6 和 HMOX1 等铁相关基因,进而促进 GSH 的合成,限制 ROS 的产生,并再生 NADPH。
四、铁死亡与多种肝脏疾病
铁死亡引发急性肝损伤(ALI)
ALI的特点是患者的肝细胞功能迅速下降。在大多数情况下,ALI是由药物、酒精、缺血/再灌注损伤(IRI)或病毒性肝炎引起的肝毒性所导致的。多种可导致肝毒性的药物中,APAP是研究最多的,在APAP诱导的ALI动物模型中,铁下垂抑制剂UAMC-3203和VDAC1寡聚化抑制剂VBIT-12均显示出通过保护线粒体功能来减少铁死亡。另外,铁死亡抑制剂Lip-1可显著降低肝脏IRI和肾脏 IRI,这表明铁死亡在IRI中起重要的致病作用。一项涉及人类受试者的研究发现,肝脏供体中升高的血清铁蛋白水平与移植受者的肝损伤风险显著升高有关,并且,使用Fer-1、α-生育酚和DFO等化合物可阻断铁死亡,预防肝IRI。综上所述,这些研究表明铁死亡可以作为一个治疗靶点。
铁死亡增加慢性肝损伤和纤维化
肝纤维化是肝硬化的早期可逆阶段,是各种病因引起慢性肝损伤后的疤痕修复反应。其发生的中心环节是肝星状细胞(HSC)激活后导致的细胞外基质大量积累。靶向活化的HSC死亡是治疗肝纤维化的重要目标之一。使用异甘草酸镁、青蒿琥酯或蒿甲醚作为治疗药物,可以诱导HSC发生铁死亡。因为异甘草酸镁可上调细胞铁死亡的关键调控因子血红素加氧酶1(HO-1)表达,进而促进转铁蛋白、转铁蛋白受体、铁蛋白重链过表达,铁外排泵—膜铁转运蛋白低表达,导致细胞内铁沉积,脂质过氧化物集聚,诱发HSC铁死亡,抑制肝纤维化形成。此外,HSC中的某些铁死亡调节因子,包括p53、ELAV样蛋白1(ELAVL1)和锌指蛋白36 (ZFP36)是预防肝纤维化的有希望的靶点。
铁死亡和脂肪性肝炎
脂肪变性和脂肪性肝炎是肝病的两种病理表现。通过小鼠模型研究发现,在NASH的早期阶段,铁死亡与脂肪性肝炎的炎症发作有关,抑制铁死亡可显著降低NASH的严重程度。此外,12/15-脂氧合酶在功能上与过氧化氢-磷脂酰乙醇胺相关的铁死亡有关。花生四烯酸12-脂氧合酶 (ALOX-12) 通过与乙酰辅酶A羧化酶1(ACC1)的相互作用可促进NASH的进展。但铁死亡是否在ALOX-12介导的NASH中起作用仍是一个未解之谜。
靶向铁死亡治疗肝细胞癌HCC
HCC是造成全球严重疾病负担的恶性肿瘤之一。索拉非尼,是首个获批用于晚期HCC患者的全身疗法的一种多激酶抑制剂。相较于索拉非尼激酶抑制活性的促凋亡效应,其通过抑制system XC-诱发肝癌细胞铁死亡效应更加显著。有研究报道,索拉非尼或许是通过调节肝细胞核因子4α(HNF4A)和肿瘤高甲基化基因1(HIC1)转录调控进而促进肝癌细胞铁死亡。铁死亡上调因子由HIC1调控,而铁死亡下调因子由HNF4A调控。与正常肝组织相比,肝癌中HNF4A上调,而HIC1下调,证实铁死亡在肝癌中确实是受到抑制。越来越多研究支持激活铁死亡可能有效地抑制HCC细胞的生长,从而为靶向铁死亡作为一种新的HCC治疗策略提供了科学依据。
五、铁死亡诱导剂及抑制剂
诱导剂

图4:铁死亡的遗传和药理学诱导剂
铁死亡诱导化合物(FINs)被广泛认为是开发新型癌症药物的有前景的方法。根据其作用方式,FIN可分为四类。I 类 FINs 通过抑制system xc-消耗细胞内GSH来激活铁死亡;II类FINs通过与GPX4共价结合导致有毒脂质过氧化物的积累并诱导铁死亡;III类FINs通过角鲨烯合成酶-甲羟戊酸途径间接抑制和灭活GPX4,该途径参与线粒体电子传递链,并且还具有内源性亲脂性抗氧化剂的功能;IV类FINs 通过引起铁过载或激活HO-1诱导铁死亡。
抑制剂

图5:铁死亡的遗传和药理学抑制剂
目前主要使用三种方法抑制铁死亡:铁螯合、防止脂质过氧化和清除脂质过氧化物。在这三种方法中,铁螯合剂和亲脂性抗氧化剂是被广泛接受的铁死亡抑制剂。铁螯合剂如去铁胺(DFO)、去铁酮和环吡酮螯合铁,并通过限制芬顿反应来防止脂质过氧化的传播。迄今为止,只有少数铁螯合剂获得FDA批准或进行临床试验治疗铁过载相关疾病。亲脂性抗氧化剂,包括α-生育酚、fer-1和Lip-1,作为自由基清除剂,可减少脂质过氧化物,并可有效阻断铁死亡。但是,不足的药代动力学和药效学特征可能会阻碍fer-1和Lip-1在临床环境中的使用,例如,fer-1的生物半衰期只有几分钟,这对于临床应用来说通常是不可接受的。对于慢性疾病患者长期使用铁死亡抑制剂,以前未定义的副作用也可能出现。
六、总结

图6:铁死亡治疗肝病的策略
铁代谢失调与多种肝病的发展有关,包括病毒感染性肝病、铁过载病以及从NAFLD到HCC的进展。这些肝脏疾病可以使用铁死亡抑制剂或铁死亡诱导剂进行治疗。感染性肝病可以分别使用宿主细胞和病毒的铁死亡抑制剂和铁死亡诱导剂来治疗。
看到这里,相信各位看官也是收获满满。其他如细胞凋亡、焦亡、自噬、程序性坏死以及铁死亡等,相关信号通路解读、文章和视频讲座等资源,我们也都汇总到了小优的学术中心的细胞死亡大合集,爱学习的你戳链接自取。
部分相关产品
| 货号 | 产品名称 |
| 29650 | Ferroptosis Antibody Sampler Kit(检测指标:GPX4、NCOA4、KEAP1、NRF2、4F2hc/CD98、FTH1、xCT/SLC7A11、DMT1/SLC11A2) |
| 4577 | Phospho-FLT3 (Tyr842) (10A8) Rabbit mAb |
| 13113 | CD71 (D7G9X) XP® Rabbit mAb |
| 8661 | Axl (C89E7) Rabbit mAb |
| 67138 | DPP4/CD26 (D6D8K) Rabbit mAb |
| 8455 | IFN-γ (D3H2) XP® Rabbit mAb |
| 37909 | p53 Antibody Sampler Kit |
| 41896 | TGF-β Receptor II (E5M6F) Rabbit mAb |
| abs50003-50ml(5000T) | CCK-8试剂盒 |
| abs50010-500T | MTT细胞增殖及细胞毒性检测试剂盒 |
| abs580105-96T | Iron Microplate Assay Kit |
| abs580219-96T | Total Iron-binding Capacity Microplate Assay Kit |
| FSP1和GPX4抑制剂药物筛选试剂盒 | 性能 |
| 701900-96wells | FSP1 Fluorescent Inhibitor Screening Assay Kit |
| 701880-96wells | GPX4 Inhibitor Screening Assay Kit |
参考文献
Chen J, Li X, Ge C, Min J, Wang F. The multifaceted role of ferroptosis in liver disease. Cell Death Differ. 2022;29(3):467-480. doi:10.1038/s41418-022-00941-0








