在肿瘤发生发展过程中,包括但不限于巨噬细胞、DC(dendritic cell)、中性粒细胞、B细胞、T细胞、CAF(tumor associated fibroblast)等多种细胞被招募到肿瘤细胞周围的微环境中,与ECM(extracellular matrix)等元素共同构成肿瘤免疫微环境TIME(tumor immune microenvironment)。
在TIME中的多种成分,包括T细胞、B细胞以及分泌的相关因子等虽然对肿瘤起着免疫作用,但还有许多其它成分,如细胞方面包括M2型巨噬细胞、Treg细胞、Th2细胞及MDSC (Myeloid‑derived suppressor cell)等发挥着免疫抑制的作用,细胞因子方面IL-4、IL-5、IL-10、TGFβ、MMP9和VEGF等等也通过特定的机制起着促进免疫逃逸和肿瘤发生发展的作用。在免疫的过程中,肿瘤细胞也衍生出了各种对抗免疫的机制,例减少抗原的表达,抑制DC细胞的抗原递呈能力,抑制细胞毒性T细胞的浸润等等。
在过去的十年里,虽然关于TIME的研究文章呈逐年递增的状态,TIME方向作为国自然研究的热点,提供了大量的基金支持,但鉴于TIME的复杂性以及癌症治疗的困难性、高复发率,对TIME的研究仍任重道远。在这里,小优博士又整理了两篇近期发表的关于TIME的高分文章,分别从研究背景、主要研究结果方面分享给大家,并对相关的研究思路做了部分总结,希望对大家的科学研究起到帮助作用。
一、单细胞转录组学揭示癌症相关成纤维细胞在复发性骨肉瘤肿瘤免疫微环境中的调节作用

研究背景:
骨肉瘤是最常见的骨肿瘤之一,主要发生在青少年。尽管在手术和化疗方面取得了很大的成就,但骨肉瘤患者的预后仍不理想。复发性骨肉瘤是临床的一大挑战,复发性骨肉瘤患者预后较差。因此,迫切需要深入探讨骨肉瘤的进展机制,加强对复发性骨肉瘤的认识。
肿瘤微环境(Tumor microenvironment, TME)主要由多种细胞类型和细胞外基质组成,与癌细胞相互作用,促进癌症进展。癌症相关成纤维细胞(CAFs)是TME中最常见的细胞,可通过癌症干细胞更新、免疫治疗疗效减弱和化疗耐药性导致癌症进展。然而,CAFs免疫抑制特征在OS中的作用和机制值得进一步研究。
单细胞RNA测序(scRNA-seq)是一种强大的新工具,可以检测遗传和功能异质性,重建细胞成分及其相互作用,并检测罕见的TME亚群。ScRNA-seq用于识别和分析OS的精确细胞簇和组成。然而,这些研究都集中在细胞成分上,并没有明确阐明TME在OS进展中的作用和机制。
本研究在前期研究GSE152048和GSE162454的基础上,利用scRNA-seq和生物信息学技术揭示CAFs在复发性OS TME中的调控作用。这可能在单细胞水平上促进对CAFs在复发性骨肉瘤TME中的作用和机制的理解,为骨肉瘤的治疗提供新的靶点。
首先,为了便于大家理解本文的研究思路,作者精心制作了一个研究流程图,如下:根据GSE152048 (BC)和GSE162454 (OS)的数据集,作者进行了scRNA-seq分析,以研究原发性、复发性和肺转移性骨肉瘤病变的细胞构成。GSE152048 (BC)包括来自7个原发、2个复发和2个肺转移性OS病变的100987个细胞。GSE162454 (OS)包括29278个细胞,这些细胞来自6个原发性OS患者在接受新辅助化疗之前。此外,作者又使用三个配对的原发性和复发性OS样本,通过免疫荧光、预后分析等方法来验证scRNA-seq的结果。

文章研究路线图
主要结果部分:
1 复发性OS中,CAFs的浸润水平较高
经过数据分析发现,原发性、复发性和肺转移性OS病灶中鉴定出14种细胞类型(A),且三种OS病灶的t-SNE图叠加,发现复发性OS病变的Div-CAFs(diverse CAF)较突出(B)。虽然细胞种类在三种类型的OS病灶中没有大的差异,但部分比例变化非常大,尤其是肿瘤相关成纤维细胞CAF,原发性与复发性的比例为3.58%和96.42% (C),说明了复发性OS中,CAFs的浸润水平比较高。

2 在复发性OS患者组织中,CAFs与EMT相关
对原发性和复发性OS病灶中对差异表达的HALLMARK基因进行通路富集分析,发现EMT(上皮间充质转化)通路相关基因在复发性OS组织中明显激活。

3 遗传学方面证明CAFs在复发性OS中具有较高的浸润性
(a) WB检测发现与OS细胞相比,CAFs具有较高的N-cadherin ( EMT 的marker )表达和较低的E-cadherin表达。同样在复发性OS中,由于CAFs的浸润较多,N-cadherin表达也较高(A)。
(b) CAFs激活marker:(a-SMA:recombinant stromal cell derived factor 1,FAP: fibroblast activation protein) a-SMA和FAP在复发性OS组织中显著升高(B)。
(c) 通过TIMER数据库分析,FAP与EMT 的marker E-cadherin显著负相关,而与N-cadherin显著正相关(C)。
(d) IF实验补充表明复发性OS组织中的a-SMA表达高于原发骨肉瘤组织,E-cadherin表达较低(D)。

4 CAFs表达的LOX的表达模式及临床意义
LOX: lysyl oxidase,赖氨酸氧化酶,是细胞外基质中分泌的一种酶,底物是胶原蛋白和弹性蛋白(骨和肺的主要成分),这也是为什么骨肉瘤容易向肺部转移的一个主要原因。
通过对CAFs和Div-CAFs细胞中差异表达的基因数据分析(A, B)及IHC实验(C, D)验证表明LOX在复发性OS组织中较原发性高,预后分析也表明LOX的高表达导致明显的预后较差(E)。

5 在体外LOX 促进复发性OS
接下来,作者用LOX的抑制剂BAPN (β-氨基丙腈是一种特异性的不可逆LOX抑制剂,作用于LOX或LOXL同工酶的活性位点)进行处理,发现:CAF细胞降低,OS及TAM细胞无明显变化(A);CAF的基质激活marker a-SMA和FAP表达量降低(B);N-cadherin ( EMT 通路的marker )表达降低(C, D);OS 细胞的迁移率及伤口愈合速率均明显降低篇(E);另外检测到起促进免疫反应的M1类型的巨噬细胞(INOS)明显升高而抑制免疫反应的M2型巨噬细胞(CD163)降低(F)。
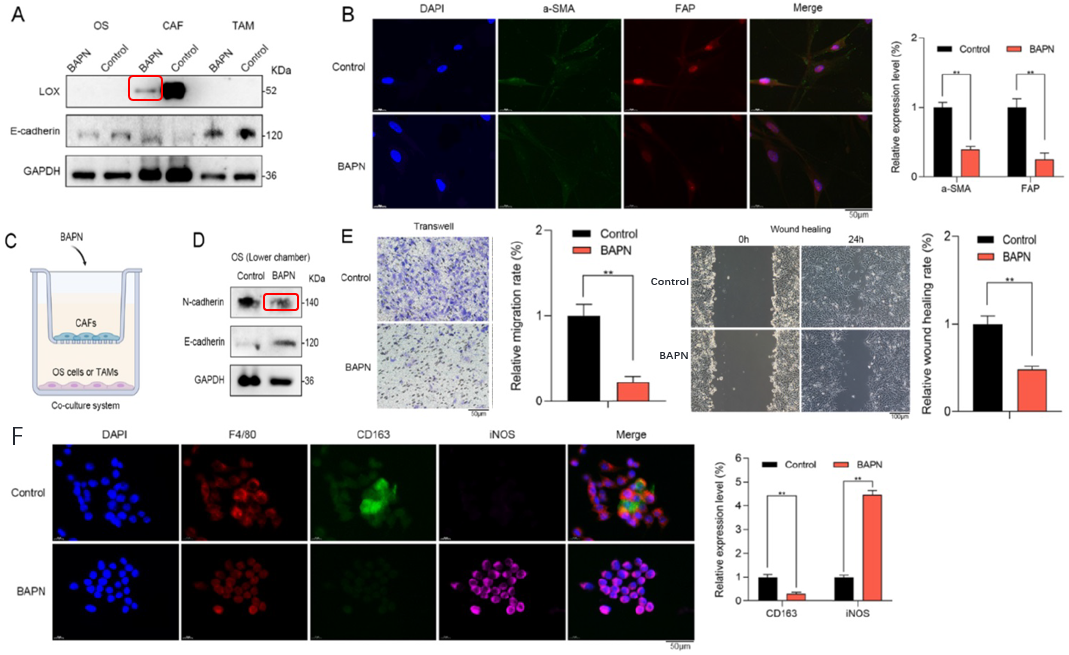
6 在体内,LOX抑制产生抗OS作用
接下来在体内验证LOX的作用,对肿瘤进行异种移植,经BAPN处理后,检测到肿瘤体积降低, LOX表达水平降低(A,B);CAF的基质激活marker a-SMA和FAP表达量也降低(C);同样的与体外检测结果一致,M1类型的巨噬细胞明显升高而M2型巨噬细胞降低(D);最后,CD8细胞有所升高但不明显(E)。

最后,作者制作了一张示意图,对本文的研究做出总结。即在复发性骨肉瘤中,CAFs浸润水平较高,在复发性OS的细胞类型中,LOX在CAFs中表达量最高,BAPN抑制LOX可调节CAFs功能,诱导巨噬细胞向促进免疫的M1类型极化,进而抑制OS。

二、MUC1-C在三阴性乳腺癌中整合IFN-γ通路的激活和肿瘤免疫微环境的抑制

Doi:10.1136/jitc-2020-002115
研究背景:
三阴性乳腺癌(TNBC)是一种侵袭性疾病,治疗选择有限。TNBC患者通常采用新辅助或辅助化疗。TNBC患者对化疗反应的生存期改善与肿瘤浸润淋巴细胞(TILs)的存在有关。因此,肿瘤免疫微环境(TIME)中TILs (特别是CD8+ T细胞)的增加可以预测早期TNBC患者对治疗的反应和预后的改善。
MUC1-C是一种在TNBC细胞中异常表达的致癌蛋白。MUC1-C通过诱导上皮细胞-间充质转化(EMT)、表观遗传重编程、干性、自我更新能力来驱动TNBC细胞进展中的谱系可塑性。EMT和癌症干细胞状态与免疫逃避有关,尽管机制尚不清楚。
本文对大量和单个TNBC细胞RNA-seq数据集的分析进一步表明,MUC1与JAK1、STAT1、IRF1、IDO1和PTGES的内在表达有关。在TNBC的肿瘤免疫微环境中,MUC1与CD8+ T细胞的衰竭和功能障碍有关。这些发现为MUC1-C在TNBC中整合谱系可塑性和免疫抑制提供了新的见解。
主要结果部分:
1 MUC1-C激活IFN-γ→JAK1→STAT1信号通路富集的整个转录程序
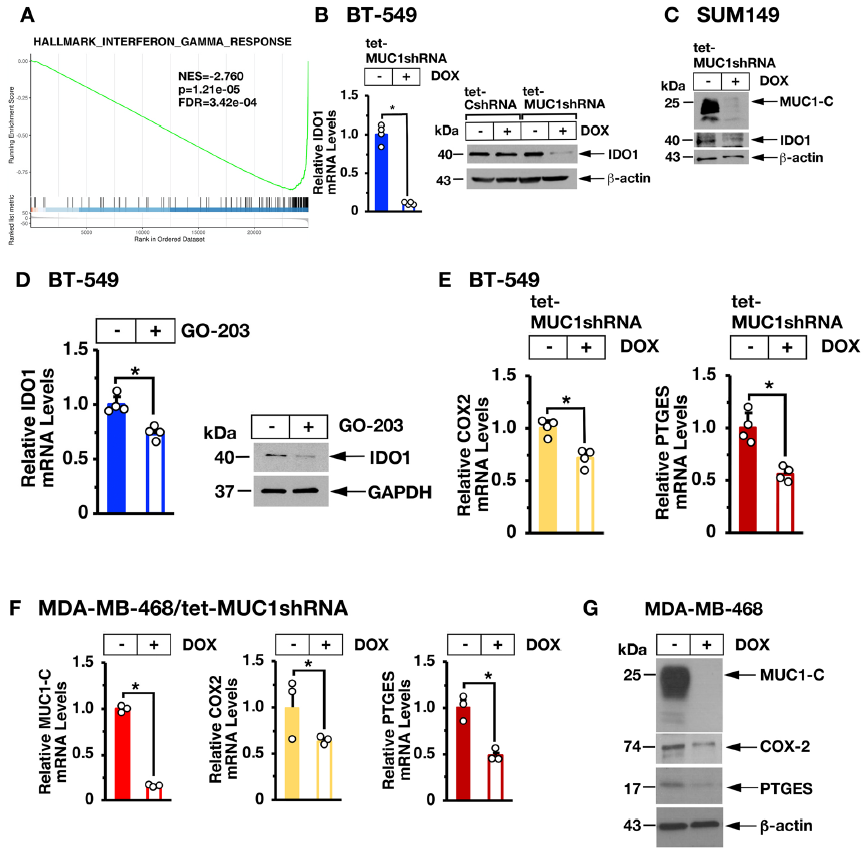
对BT-549 TNBC细胞的整体转录谱分析表明,诱导MUC1-C沉默可导致基因表达的广泛变化,约有2300个基因的表达产生了下调,1100多个基因的表达有所上调(A)。进一步分析发现沉默MUC1-C会导致(1)STAT1和IRF1(B)以及(2) IFN通路反应基因的下调(C),与MUC1-C诱导的表达模式相关的主要调控因子包括STAT1和IRF1,证实MUC1-C通过STAT-IRF转录因子活性介导信号传导(D)。Motif评估进一步验证了MUC1-C诱导的差异表达基因在STAT和IRF Motif中高度富集(E)。总之,这些发现表明STAT-IRF因子是MUC1-C诱导的TNBC细胞转录应答的主要驱动因素。

2 在TNBC细胞中MUC1-C激活JAK1→STAT1→IRF1信号
接下来,在BT-549和SUM149细胞中降低MUC1-C基因的表达,发现STAT1和IRF1基因在mRNA及蛋白水平的表达均有所降低(A-C)。通过对MUC1-C基因的蛋白序列分析,发现MUC1-C包含分别结合JAK1和IRF1的两个motif,JAK1作为激酶,当MUC1-C结合两种蛋白时,便会对STAT1进行磷酸化,因此在前面的实验结果中,由于MUC1-C基因的下调,磷酸化的pSTAT1蛋白也降低(A-C)。接下来,通过用MUC1-C的抑制剂GO-203抑制MUC1-C的表达,同样检测到了JAK1,STAT1,pSTAT1, 及IRF1蛋白表达的下调,再次验证了之前的结果。

3 下调MUC1-C 抑制IRF1下游基因 IDO1 和 COX2/PTGES
MUC1-C下调后,作者又对下游基因IDO1在BT-549及COX2/PTGES的表达情况进行了检测。检测到在BT-549、SUM149细胞中及抑制剂GO-203处理后,IDO1表达水平均降低(B-D)。 此外,作者发现MUC1-C驱动COX2/PTGS2和PTGES (E)的表达,它们共同合成PGE2 (一种与TNBC肿瘤生存率降低相关的T-cell功能抑制剂)。为了支持这些结果,对MDA-MB-468 TNBC细胞的研究证实MUC1-C驱动COX2和PTGES的表达(F-G)。
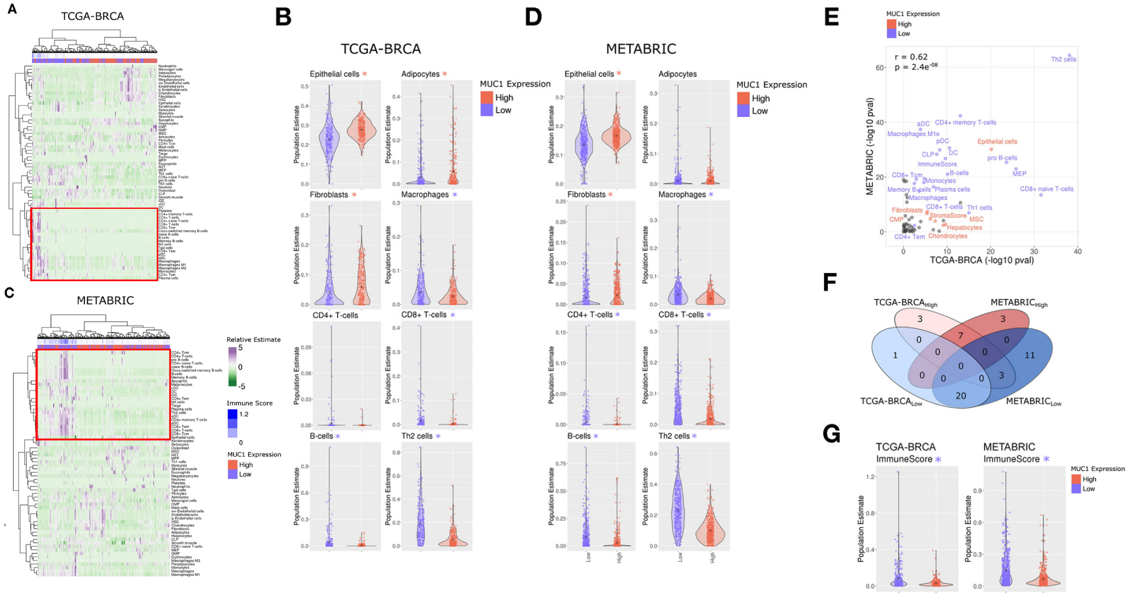
4 MUC1 与免疫细胞浸润的减少有关
接下来,为了检测MUC1-C对免疫细胞浸润的影响,作者对两种RNA-seq数据TCGA-BRCA cohort(A)及METABRIC cohort (B)进行了分析,结果显示,相对于MUC1-C表达低的肿瘤,MUC1-C表达高的肿瘤中的免疫细胞浸润明显减少,特别是CD8 + T细胞、CD8 + naive T细胞、B细胞和Th2细胞等(C, D)。在MUC1-C表达低和MUC1-C表达高的情况下,细胞类型富集的总体模式在TCGA-BRCA和METABRIC队列中显著相关(E, F)。此外,在两个数据中,基于所有免疫细胞类型估计的总免疫活性的定量在MUC1-C表达高的情况下显著降低(G)。
5 MUC1-C在TNBC肿瘤中的表达与IFN-γ通路的激活和CD8+ T细胞的衰竭和功能紊乱有关
结合实验结果及通过对TNBC肿瘤中TCGA-BRCA和METABRIC数据分析,发现MUC1与IFN-γ通路的激活有关(A, B);MUC1-C的表达与CD8+ naive T细胞的耗竭显著相关(C, D);IFN-γ通路在t细胞功能紊乱的TNBCs中高度富集(E, F);此外还发现MUC1-C在两种TNBC数据集中都与T-cell功能障碍显著相关,这表明MUC1-C诱导的IFN-γ通路激活导致CD8+ T细胞排斥和功能障碍。
最后,对本文的研究做出总结,MUC1-C通过诱导IDO1和COX2激活IFN-γ→STAT1→IRF1通路(I),这为MUC1-C在TNBC的肿瘤免疫微环境中驱动CD8+ T细胞排斥和/或功能紊乱的潜在重要性提供了支持。

总结,在看了一些关于肿瘤免疫微环境相关的文章后,对于一些研究思路,小尤博士做了一些总结,并形成了一个流程图,当然不能代表所有相关的思路,希望为各位小伙伴的研究带来一些参考作用。

部分产品推荐:
| 货号 | 名称 |
| 2146 | β-tubulin antibody |
| MAB5718 | Human/Mouse/Rat GAPDH Antibody |
| 4061 | N-Cadherin Antibody |
| 3195 | E-Cadherin (24E10) Rabbit mAb |
| 66562 | FAP (E1V9V) Rabbit mAb |
| 58135 | LOX (D8F2K) Rabbit mAb |
| 4443 | CD3ε (CD3-12) Rat mAb |
| 93518 | CD4 (D2E6M) Rabbit mAb |
| 98941 | CD8α (D4W2Z) XP® Rabbit mAb |
| 93498 | CD163 (D6U1J) Rabbit mAb |
| 16564 | MUC1-C (D5K9I) XP® Rabbit mAb |
| 3332 | Jak1 Antibody |
| 9172 | Stat1 Antibody |
| 8478 | IRF-1 (D5E4) XP® Rabbit mAb |
| 4842 | Cox2 Antibody |
| 51851 | IDO (D8W5E) Rabbit mAb |
| 670057 | EMEM |
| SH30022.01 | DMEM |










 危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)
危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)  营业执照(三证合一)
营业执照(三证合一)