流式细胞术是通过用荧光信号去区分不同蛋白表达的,那么我们在进行荧光配色时,就需要考虑,在处理样本或做一些外源刺激时,是否会引入一些荧光信号。比如做质粒转染、病毒感染、药物处理等,都是会引入一些荧光信号的。这些荧光信号就会在流式检测中存在一定干扰,本期内容,就给大家讲一下这些常见的荧光蛋白的特征和其他可能引起外源荧光信号的因素。
Part 1:常见的人为引入荧光蛋白特征
荧光:GFP(绿色荧光蛋白), EGFP(增强型绿色荧光蛋白);RFP(红色荧光蛋白),mCherry(樱桃色萤光蛋白),mStrawberry.
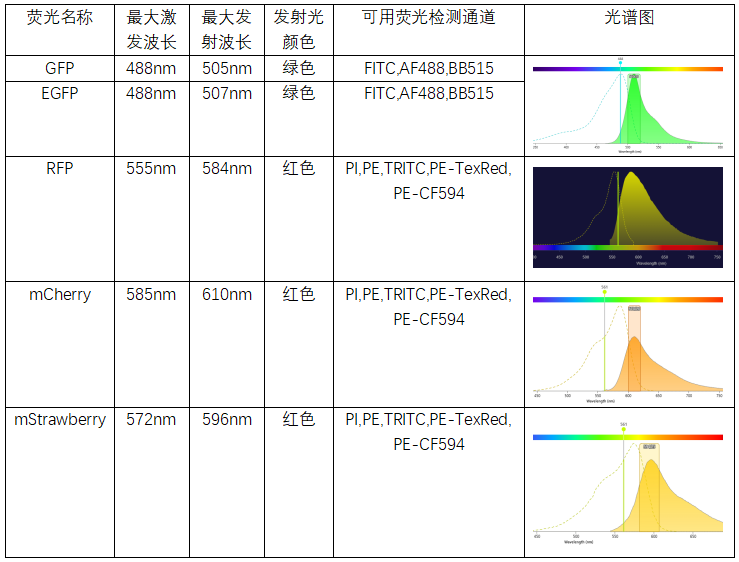
在传统流式仪器中,当样本引入如上荧光蛋白后,走相同通道的荧光是不能同时染色的,会区分不开。如果荧光蛋白的表达量过高,超过30%以上时,由于发射光谱的区间很宽,相邻通道的荧光抗体,也要慎重选择,经常会出现靠调节补偿,依然无法进行有效分群的现象。
PS:更多荧光光谱信息可以在流式专家公众号-流式工具-荧光素光谱(点击查看)查看中搜索,或在BD官网的光谱查看器检索https://www.bdbiosciences.com/zh-cn/resources/bd-spectrum-viewer。
Part 2:如何确认细胞的自发荧光
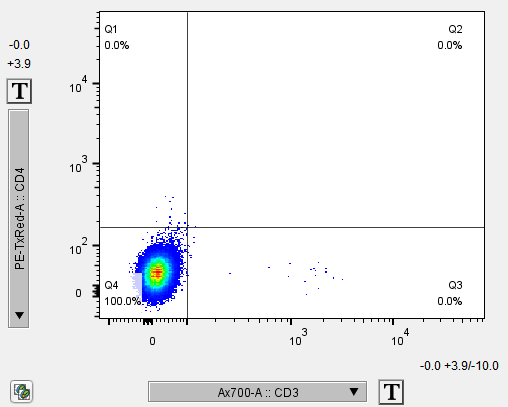
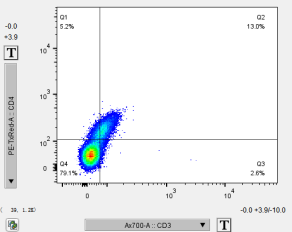
正常未染色的空白细胞,在参数调节合适后,每个通道都基本没有阳性信号(低于0.5%),但是如果细胞有自发荧光,就会在能接收到信号的通道看到比较明显的分群或整个群体的向右偏移(跟染色管阳性差不多)。
当细胞有自发荧光时,未染色细胞在一些通道也会有明显的阳性分群,哪个通道阳性明显,在流式配色时就不能再用同通道的各种荧光去做检测了。有少量自发荧光的通道可以通过补偿调节,排除干扰。
Part 3:自发荧光的可能来源
1. 细胞转染带荧光蛋白的质粒,并被细胞正常表达;
2. 细胞感染带荧光蛋白的病毒,并被细胞稳定表达;
3. 药物处理,药物或试剂所带的背景荧光,尤其是含芳香环苯环结构的药物;
4. 细胞体外共培养实验,导致细胞状态受到影响,出现细胞本底荧光的变化;
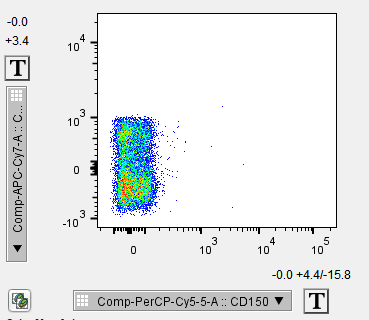
5. 染色前样本本底水平或处理过程中产生的死亡的细胞,自身会有荧光信号,在几乎所有荧光通道都能看到阳性信号,双参数散点图能看到对角线上的群体(如图所示,此为空白对照数据)。
可以通过染死活染料进行区分排除。
常用死活染料清单:
| 染料 | 不固定细胞 | 固定细胞 | 检测通道 | 激光器 | 货号 |
| PI | V | X | PE | Blue/YG | 556463 |
| 7-AAD | V | X | PerCP | Blue/YG | 559925 |
| DAPI | V | X | BV421 | UV/Violet | 564907 |
| Via-Probe Green | V | X | FITC | Blue | 565799 |
| DRAQ7™ | V | X | APC | Red | 564904 |
| Via-Probe Red | V | X | APC | Red | 565803 |
| FVS450 | V | BV421 | Violet | 562247 | |
| FVS510 | V | BV510 | Violet | 564406 | |
| FVS575V | V | BV605 | Violet | 565694 | |
| FVS520 | V | FITC | Blue | 564407 | |
| FVS570 | V | PE | Blue/YG | 564995 | |
| FVS620 | V | PE-CF594 | Blue/YG | 564996 | |
| FVS660 | V | APC | Red | 564405 | |
| FVS700 | V | AF700 | Red | 564997 | |
| FVS780 | V | APC-H7 | Red | 565388 |
在做流式方案设计之前,如果有细胞自发荧光干扰的风险,就需要各位Flower做一下预实验,用未染色的细胞上流式,看看各个通道细胞散点图的信号是否正常,是否有分群的情况,以此避免配色后出现干扰的情况,减少来回调整方案的消耗。










 危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)
危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)  营业执照(三证合一)
营业执照(三证合一)