L型电压敏感性钙离子通道(CaV)分布在不同类型细胞的细胞膜上,CaV离子通道在钙离子信号传导和细胞功能中发挥着重要作用。在许多情况下,CaV通道的信号均与基因转录有关。这类信号具有独特的特性,例如在进入细胞后的亚细胞定位、振幅和持续时间。CaV1如何将特定的放电模式转化为定性或定量核功能呢?本文会对此机制中的钙信号的调控做简要阐述。
引言
在神经系统和外周组织(如内分泌、骨骼肌、心肌和平滑肌)中已经描述了许多类型的钙离子通道(表1) 。CaV1通道将膜去极化与细胞表面受体刺激相结合,以调节多种过程,包括基因表达、突触效力、mRNA稳定性和细胞存活。它们只在可兴奋细胞中表达,如骨骼肌、心肌、平滑肌、神经元和内分泌细胞1-6。CaV1通道被激活,电刺激或受体刺激引起胞内钙离子浓度增加,这种增加通常表现为迅速增加或者反复振荡。钙离子波的振幅、频率、胞内位置和速度受同一细胞内刺激的类型和强度调控7,8。这些不同的钙离子进入细胞的方式起着非常关键的作用,它可以确定哪些信号通路被激活,从而明确细胞反应,诱导不同的细胞功能。9
| 靶点基因 | 靶点蛋白 | 通道类型 | 主要组织分布 |
| CACNA1S | Cav1.1 | L-型钙通道 | 骨骼肌、心肌、心脏窦房结及耳蜗内毛细胞、视网膜突触 |
| CACNA1C | Cav1.2 | ||
| CACNA1D | Cav1.3 | ||
| CACNA1F | Cav1.4 | ||
| CACNA1A | Cav2.1 | P/Q-型钙通道 | 中枢突触与神经肌肉接头(NMJ) |
| CACNA1B | Cav2.2 | N-型钙通道 | 中央和外周突触 |
| CACNA1E | Cav2.3 | R-型钙通道 | 中央和外周突触(非同步释放) 突触前末端,包括小脑颗粒神经元以及海马体中的锥体神经元 |
| CACNA1G | Cav3.1 | T-型钙通道 | 可兴奋细胞,如神经细胞、腺细胞、肌细胞 |
| CACNA1H | Cav3.2 | ||
| CACNA1I | Cav3.3 |
表1. 电压门控离子通道类型及其主要组织分布
钙离子如何激活
细胞主要采用两种策略将钙离子刺激与转录结合起来。首先,钙离子在进入的位置激活细胞质信号分子,将信号传递到细胞核。使用CaV1特异性抑制剂(FS-2 (#F-700), Calciseptine (#C-500) and Calcicludine (#SPC-650), Alomone)可阻断这类信号。此外,CaV1激活剂(±)-Bay K8644 (#B-350)已被证明可在许多细胞类型中调节由丝氨酸/苏氨酸激酶(ERK)/介原活化蛋白激酶(P42/44 MAPK)级联调控的细胞外信号(图1,2)。10-12 例如,在人胰岛中,葡萄糖诱导的钙离子过度激活是导致β细胞功能障碍和诱导细胞凋亡的原因(图2)13。
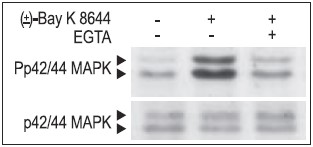
图1:(±)-Bay K8644是CaV1(L型通道)的调制剂,可促进丝裂原活化蛋白激酶(MAPK-ERK 1/2)的磷酸化。
用或不用2 mM EGTA螯合钙离子预培养Jurkat T细胞20分钟,然后用50 μM (±)-Bay K8644 (#B-350,Alomone)刺激10分钟。细胞蛋白经SDS PAGE胶分离,用Phospho-p42/44 MAPK(上图)或Anti-p42/44 MAPK(下图)抗体检测。
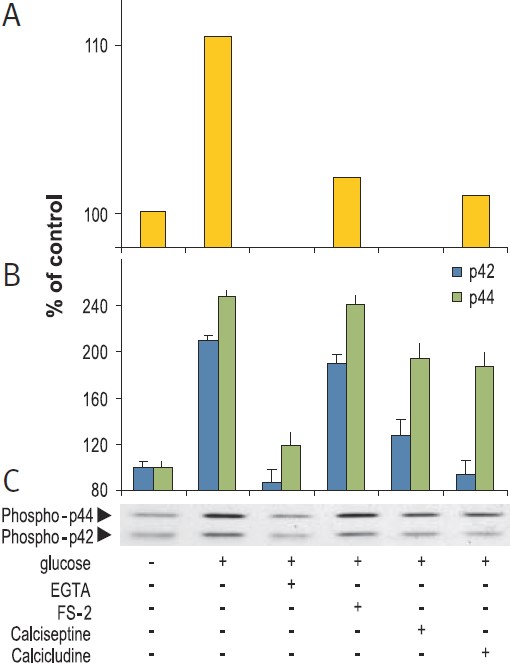
图2. CaV1(L型通道)促进RIN细胞p42/44 MAPK的活化
在5 mM EGTA、2 μM FS-2 (#F-700,Alomone), 10 μM Calcicludine ( #SPC-650,Alomone)或10 nM Calciseptine (#C-500,Alomone) 加和不加,用20 mM葡萄糖刺激RINβ细胞15分钟。图A显示了Fura-2 AM负载细胞在刺激后10秒钟的细胞内钙离子水平。图C是用抗磷酸-p42/44 MAPK抗体对活性p42/44 MAP激酶的Western分析,图B是p42和p44条带的强度。
其次,钙离子可直接作用于细胞核。例如,CaV1的激活和钙离子的流入已被证明可激活转录因子环腺苷酸3',5'-单磷酸反应元件结合蛋白(CREB)(图3)。这个转录因子调节即刻早期基因的表达15,被认为在大脑长期记忆的形成过程中起着重要作用。
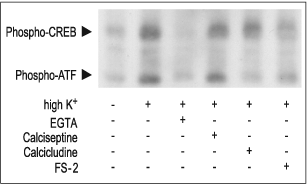
图3. CaV1(L型通道)促进PC12细胞中转录因子的活化
在5 mM EGTA、2 μM FS-2(#F-700,Alomone)、10 μM Calcicludine(#SPC-650,Alomone)或10 nM Calciseptine(#C-500,Alomone)存在或不存在的情况下,用35 mM High K+刺激PC12细胞10分钟。细胞提取物可用抗磷酸化CREB抗体检测,抗磷酸化CREB抗体也可识别磷酸-ATF。
钙调蛋白介导钙离子信号至细胞核
胞内的钙离子受体是钙调素。钙调蛋白是一种非常敏感的钙离子浓度传感器,在对各种钙调蛋白结合蛋白产生影响的过程中,能够区分波峰频率、振幅和持续时间的不同。细胞内钙离子浓度的变化以三种不同的方式影响钙调蛋白:改变其亚细胞分布;引导钙调蛋白的各种构象状态,导致靶标特异性激活;与许多靶标蛋白产生不同的结合模式17。
钙离子与钙调素的结合使细胞能够通过激活多功能钙离子/钙调素依赖性蛋白激酶(CaMK,图4)将钙离子的变化与磷酸化联系起来。CaMK的频率响应和激活状态受到钙离子的严格调控,它反映了钙离子波峰的频率和振幅。CaMK已被证明在突触可塑性、学习和记忆中发挥关键作用,在心脏中还与基因表达调控有关18。
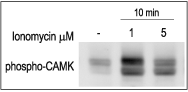
图4. 细胞内钙离子的增加诱导激活3T3-L1细胞中钙离子钙调蛋白依赖性激酶II(CAMK II)的磷酸化
将3T3-L1细胞饥饿2小时,然后用1或5 μM Ionomycin(#I-700,Alomone)刺激10分钟。细胞提取物用磷酸化-(Thr268)-CAMKII抗体检测。
CaV1包含两个钙调蛋白结合位点,一个是 "IQ "基团,另一个是羧基末端的上游钙调蛋白结合域-"LA "基团。在静息状态下,不含钙离子的钙调素被拴在LA基团上,并靠近孔区域。在CaV1激活过程中,当钙离子通过孔进入时,会被钙调素捕获。钙离子/钙调蛋白复合物切换到下游的IQ基序,该基序对复合物具有高亲和力位点。钙离子/钙调蛋白复合物是将信号从CaV1孔口传递到细胞核的关键。钙离子/钙调蛋白与CaV1.2的IQ区结合是其激活和Ras/P42/44 MAPK通路运输的必要条件,该通路通过激活转录因子将信号传递到细胞核(图5)。在大脑中,这种激活对突触小泡蛋白突触素I的再磷酸化和几种转录因子的激活至关重要23。

图 5. CaV1激活的信号转导示意图
CaV离子通道活化和钙离子通过孔进入,促进钙调蛋白与钙离子结合,并引起钙调蛋白构象变化,使其从LA基序向下游迁移至COOH末端的IQ基序。这一过程反过来调节通道的开放,同时促进信号通路的激活。
内部钙离子储存库中释放可能由两种方式介导,一是内部钙离子储存库的释放,另一个是钙离子/钙调蛋白复合物从细胞表面向细胞核转运14(特别是在神经中逆行树突动作电位),以支持CREB的激活,CREB与树突发育、神经元存活和认知密切相关23,24。钙离子/钙调蛋白的核动员完全由CaV1和谷氨酸受体活性促进14,但它受其他细胞信号调控,这些信号控制钙调蛋白的磷酸化状态。磷酸化钙调蛋白与非磷酸化钙调蛋白的作用不同。
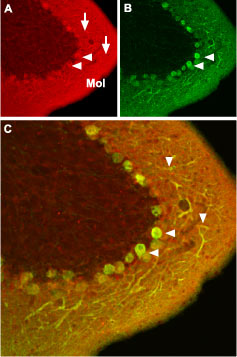
图6. 小鼠脑中CaV1.2的表达
小鼠小脑中的CaV1.2离子通道用抗CaV1.2 (CACNA1C)抗体(#ACC-003,Alomone)免疫组化染色。(A)CaV1.2离子通道(红色)出现在Purkinje细胞(水平箭头),并弥漫分布在分子层(Mol),包括Purkinje树突(垂直箭头)。(B)小鼠神经细胞切片用抗钙结合蛋白抗体(绿色)染色Purkinje,显示树突在分子层的位置。(C)CaV1.2和CBD28K的共聚焦合并。
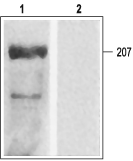
图 7. 大鼠心室膜中 CaV1.2a 的检测
大鼠心室膜WB实验: 1. 抗 CaV1.2a (CACNA1C) 抗体 (#ACC-013,Alomone) (1:200). 2. 抗CaV1.2a (CACNA1C)抗体与阴性对照抗原预孵育。
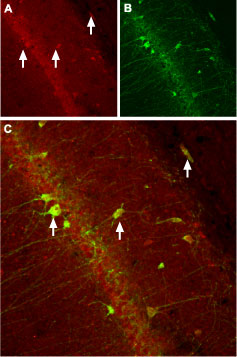
图8. CACNB3 (CaVβ3)在大鼠海马中的表达
抗CACNB3抗体(#ACC-008,Alomone)对大鼠海马中CaVβ3通道的免疫组化染色。(A) 神经元中出现CaVβ3通道(红色)(箭头)。(B)用小鼠抗parvalbumin(一种钙结合蛋白,绿色)染色神经细胞,显示CaVβ3局限于细胞体。(C)CaVβ3和parvalbumin的共聚焦合并显示了这些蛋白的共定位。
结论
在生物系统中,钙离子信号是一种通用的细胞内信使,可调节多种钙离子调控过程。解码钙离子信号的细胞内机制非常复杂,依赖于多种酶活性的参与过程。CaV1信号是一种独特的信息,它涉及细胞内钙离子的波动,通过启动特定的信号转导途径和基因转录直接控制钙离子结合蛋白-钙调蛋白。
文章部分相关产品:
| 产品名称 | 货号 | 产品描述 | 规格 |
| Anti-CaV1.2 (CACNA1C) Antibody | ACC-003 | CaV1.2 (CACNA1C)抗体 | 25ul/50ul/200ul |
| Anti-CaV1.2a (CACNA1C) Antibody | ACC-013 | CaV1.2a (CACNA1C)抗体 | 25ul/50ul/200ul |
| Anti-CACNB3 Antibody | ACC-008 | CaVβ3(CACNB3)抗体 | 25ul/50ul/200ul |
| FS-2 | F-700 | L型 CaV 离子通道阻断剂 | 70ug/5*70ug |
| Calciseptine | SPC-500 | L型 CaV 离子通道阻断剂 | 70ug/0.25mg/0.5mg/1mg/5mg/10mg |
| Calcicludine | SPC-650 | L型 CaV 离子通道阻断剂 | 70ug/0.25mg/0.5mg/1mg/5mg/10mg |
| (±)-Bay K8644 | B-350 | CaV1型离子通道激活剂 | 5mg/10mg/25mg/50mg/100mg |
| Ionomycin calcium salt | I-700 | 选择性的Ca2+载体 | 25ul/50ul/200ul |
| Phospho-p44/42 MAPK (Erk1/2) (Thr202/Tyr204) (D13.14.4E) XP® Rabbit mAb | 4370 | 磷酸化p44/42 MAPK (Erk1/2)抗体 | 20ul/200ul/600ul |
| p44/42 MAPK (Erk1/2) (137F5) Rabbit mAb | 4695 | p44/42 MAPK (Erk1/2)总蛋白抗体 | 20ul/200ul |
| Phospho-CaMKII (Thr286) (D21E4) Rabbit mAb | 12716 | 磷酸化CaMKII (Thr286)抗体 | 20ul/100ul |
关于Alomone
Alomone是来自以色列的离子通道专家,提供与离子通道和膜蛋白(TRP通道、钠/钾/钙通道、水通道、GPCRs)相关的抗体、拮抗剂/激动剂(小分子化合物和毒素)、神经生长因子等。
优宁维作为Alomone在中国区的独家授权代理商,建立了中国现货库,为广大客户带去更快的物流,更好的服务。
References
1.Ashcroft, F.M. et al. (1994) J. Cell Biochem. 55, 54.
2.Bading, H. et al. (1993) Science 260, 181.
3.Bean, B.P. (1989) Annu. Rev. Physiol. 51, 367.
4.Charles, A.C. et al. (1999) J. Biol. Chem. 274, 7508.
5.De Koninck, P. and Cooper E. (1995) J. Neurosci. 15, 7966.
6.Christie, B.R. et al. (1997) J. Neurophysiol. 77, 1651.
7.Berridge, M.J. et al. (2000) Nat. Rev. Mol. Cell Biol. 1, 11.
8.Cruzalegui, F.H. and Bading, H. (2000) Cell. Mol. Life Sci. 57, 402.
9.Kiselyov, K. et al. (2003) Cell. Signal. 15, 243.
10.Shimamura, A. et al. (2000) Curr. Biol. 10, 127.
11.Bonni, A. et al. (1999) Science 286, 1358.
12.Ballif, B.A. and Blenis, J. (2001) Cell Growth Differ. 12, 397.
13.Maedler, K. et al. (2004) Diabetes 53, 1706.
14.Deisseroth, K. et al. (1998) Nature 392, 198.
15.Wantanabe, S. et al. (1997) Blood 89, 1197.
16.Abel, T. et al. (1998) Science, 279, 338.
17.Chin, D. and Means, A.R. (2000) Trends Cell Biol. 10, 322.
18.De Koninck, P. and Schulman, H. (1998) Science 279, 227.
19.Tebar, F. et al. (2002) Mol. Biol. Cell 13, 2057.
20.Dolmetsch, R.E. et al. (2001) Science 294, 333.
21.Cullen, P.J. and Lockyer P.J. (2002) Nat. Rev. Mol. Cell Biol. 3, 339.
22.Selcher, J.C. et al. (2002) The Neuroscientist 8, 122.
23.Cruzalegui, F.H. and Bading, H. (2000) Cell. Mol. Life Sci. 57, 402.
24.Gao, L. et al. (2006) J. Neurosci. 26, 6259.
25.Nakamura, T. et al. (1999) Neuron 24, 727.
26.Benaim, G. and Villalobo, A. (2002) Eur. J. Biochem. 269, 3619.










 危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)
危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)  营业执照(三证合一)
营业执照(三证合一)