导言
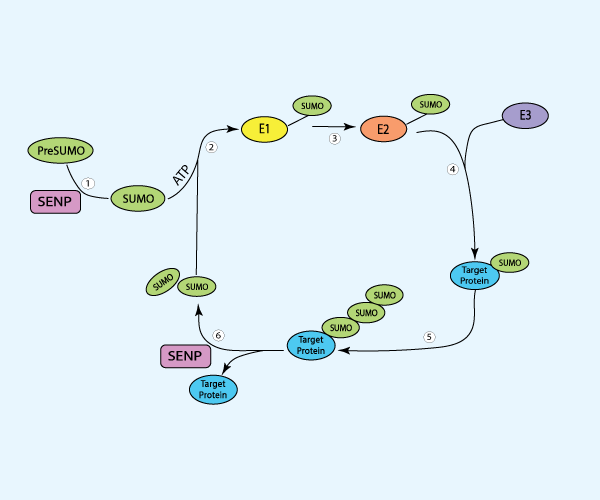
类泛素化小分子 (SUMO1),属于泛素样家族的一员, 于 1997 年被首次发现1 ,此后,几种亚型(SUMO2、SUMO3、SUMO4、SUMO5)、SUMO 酶机制(E1、E2、E3)和去SUMO化蛋白酶(SENPs)相继被发现和鉴定2(见图 1)。 此外,研究还表明,这种关键的翻译后修饰能以调控的方式选择性地修饰成千上万的靶蛋白,从而控制蛋白质的定位、稳定性和功能,进而调节 DNA 修复、应激反应、细胞贩运等至关重要的细胞过程2。因此,SUMO化修饰(SUMOylation)的失调与多种疾病相关,包括癌症。有案例表明SUMO化修饰失调会直接作用于癌细胞,促进其增殖、迁移和转移3。同样,也有证据表明SUMO化修饰可通过改变肿瘤微环境和破坏正常的免疫监视来促进癌症进展。本文将讨论在癌症和宿主免疫应答中,SUMO化修饰对免疫细胞的影响。
图 1. SUMO化修饰和 去SUMO化过程示意图
SUMO化修饰与免疫细胞成熟
人体对病原体的免疫应答有两种机制,即先天性免疫和适应性免疫。先天性免疫是由巨噬细胞、中性粒细胞、自然杀伤细胞和树突状细胞等多种免疫细胞对病原体做出的快速、非特异性反应。 相反,适应性免疫作为 "次级 "反应,是由淋巴系 B 细胞和 T 细胞对病原体做出的高度特异性和有针对性的反应。先天性免疫细胞和适应性免疫细胞之间存在着明显的相互影响,从而形成了一种既能清除病原体又能产生后续记忆反应的有效策略。 有几项研究选择性地敲除了免疫细胞中的 SUMO化修饰机制4、5。在大多数情况下,SUMO化修饰的有效缺失会显著改变免疫细胞的发育。例如,已证实在T细胞和B细胞发育的早期阶段,SUMO蛋白酶SENP1会高表达。敲除 SENP1 会导致小鼠胸腺明显变小,T 细胞前体减少6。 同样,T 细胞特异性 E2 酶 Ubc9 的敲除也会导致 CD4 和 CD8 阳性 T 细胞减少7。
SUMO化修饰失调引起肿瘤免疫逃逸
大多数肿瘤细胞都能被先天性和适应性免疫细胞识别,在很多情况下,肿瘤的进展依赖肿瘤微环境中免疫细胞活化的抑制。 因此可通过免疫细胞中的 SUMO 依赖性机制来调节免疫监视;例如,在转基因小鼠模型中过表达 SUMO 2 可增强 IL17-CD8+ T 细胞,从而有效靶向癌细胞并减少肿瘤生长8。另一个例子是,特异性消耗小鼠巨噬细胞中的 Ubc9可使得前列腺癌进展减慢,而这是通过 STAT4 依赖性机制减少肿瘤相关巨噬细胞表型实现的。 有趣的是,该模型中癌症进程的减缓还依赖于免疫细胞的串联作用,巨噬细胞中ubc9的敲除也会产生增强的CD8 + T细胞9。 此外,癌细胞中SUMO 依赖性信号传导已被确定为免疫监视的关键机制。 在 Zitti 等人的研究中,研究人员发现抑制 DNAM1 激活受体的 SUMO 化会导致其转位到细胞表面,并增加自然杀伤细胞对多发性骨髓瘤癌细胞的识别,这是由 SUMO 化修饰调控的先天免疫激活配体的首例10。在肝细胞癌患者中,IL-33 集中在细胞核的比例似乎更高。 最近的一项研究将这种定位归因于 E3 连接酶 Ran BP2 对 IL-33 的 SUMO化11。 IRF1通过调控 PD-L1增强定位,而PD-L1 可抑制细胞毒性 T 细胞的活性,从而加速癌症进程。在一项补充研究中,活化的 SUMO化修饰可抑制 MHC I 类,从而使癌细胞逃避 CD8+ T 细胞介导的免疫监视12。
SUMO化修饰失调调节宿主免疫反应
对抗病原需要充分的免疫应答,而应答不足则会容易患病。免疫细胞的激活受转录因子、信号级联和翻译后修饰的调控,其中就包括SUMO化。如今SUMO化已被认定是一种特别重要的翻译后修饰机制5。最近有一项研究,研究对象是转基因小鼠,这种小鼠关键的活化 T 细胞核因子(NFATc1)特异异构体无法 SUMO 化,测得小鼠的IL-2 水平很高,Treg 细胞增殖增强,IL-17 的释放受到抑制13。 使得机体能更好地对抗实验性自身免疫性脑脊髓炎和移植物抗宿主病,为 SUMO化在免疫细胞活化中的作用提供了更多证据。一项辅助研究利用敲除 Treg 细胞中 Ubc9的小鼠模型,结果也证实SUMO化对 Treg 细胞增殖、活化和稳态很重要14。鉴于SUMO化在免疫细胞活化中发挥重要作用,病原体劫持 SUMO 机制以逃避免疫监视也就不足为奇了。 最早的例子之一来自单核细胞增多性乳酸杆菌,它产生的一种孔形成毒素李斯特溶菌素能催化 Ubc915 的降解。 此后,许多其他病原体都以 Ubc9 的稳定性为目标,以此破坏 SUMO化和免疫细胞功能5。此外,一些病原体还利用 SUMO 机制来修饰它们的靶蛋白,以增强感染。 研究表明,SARS-CoV 核苷酸蛋白与 Ub9 相互作用并被 SUMO 化,从而促进了核苷酸的组装和 SARS-CoV 的感染性16。 最近的另一项研究表明,SUMO1 修饰甲型流感病毒的基质蛋白可增强病毒的稳定性,并最终促进病毒复制17。 SUMO化机制的调控是宿主免疫应答和入侵生物致病的关键机制。
总结与未来方向
这一系列研究结果凸显了 SUMO化修饰在免疫细胞发育过程中发挥的重要作用。 有趣的是,SUMO化修饰过程已成为破坏正常免疫功能的高度靶向手段,以至于癌症和病原体都瞄准了这一翻译后修饰机制来逃避免疫监视。 由于 SUMO 在癌症中的作用,研究人员已经开始开发针对 SUMO 通路的药物2。 有趣的是,最初人们认为使用 E1 抑制药物破坏 SUMO 功能,主要是破坏癌细胞的细胞周期,结果表明第二代 SUMO E1 抑制剂 TAK981 也能诱导抗肿瘤免疫18。
文中部分相关产品:
| 产品名称 | 货号 | 产品应用 | 规格 |
| Signal-Seeker™ SUMOylation 1 Detection Kit | BK165 | Signal-SeekerTM系列的试剂盒均使用亲和珠从目标细胞或组织裂解物中抽出并富集经过修饰的蛋白质。然后通过WB实验分析富集的蛋白质群,最后还需要使用额外的一抗和二抗来检测经过修饰的目标蛋白质(图1) | 10 assays / 30 assays |
| Signal-Seeker™ SUMOylation 2/3 Detection Kit | BK162 | 10 assays / 30 assays | |
| Anti-SUMO-1 Mouse Monoclonal Antibody | ASM01 | 可用于WB,IP实验;可用于所有种属 | 25 μL / 100 μL |
| SUMO-2/3 Antibody Mouse Monoclonal (Clone 12F3) | ASM23 | 可用于WB, IF和 IP,适用的种属范围广 | 25 μL / 100 μL / 2×100 μL |
关于Cytoskeleton
Cytoskeleton作为专业的细胞骨架和小G蛋白相关产品的生物科技公司,可以提供专业且高度可靠的Pulldown和GLISA检测试剂盒,在过去的20年里,无数各个领域的研究人员已经利用Cytoskeleton的产品产出许多优秀的实验成果。
相关文献
【1】Mahajan, R., et al., A small ubiquitin-related polypeptide involved in targeting RanGAP1 to nuclear pore complex protein RanBP2. Cell, 1997. 88(1): p. 97-107.
【2】Vertegaal, A.C.O., Signalling mechanisms and cellular functions of SUMO. Nat Rev Mol Cell Biol, 2022. 23(11): p. 715-731.
【3】Gu, Y., et al., The emerging roles of SUMOylation in the tumor microenvironment and therapeutic implications. Exp Hematol Oncol, 2023. 12(1): p. 58.
【4】Adorisio, S., et al., SUMO proteins: Guardians of immune system. J Autoimmun, 2017. 84: p. 21-28.
【5】K, S.T., et al., SUMO and SUMOylation Pathway at the Forefront of Host Immune Response. Front Cell Dev Biol, 2021. 9: p. 681057.
【6】Van Nguyen, T., et al., SUMO-specific protease 1 is critical for early lymphoid development through regulation of STAT5 activation. Mol Cell, 2012. 45(2): p. 210-21.
【7】Wang, A., et al., Ubc9 Is Required for Positive Selection and Late-Stage Maturation of Thymocytes. J Immunol, 2017. 198(9): p. 3461-3470.
【8】Won, T.J., et al., SUMO2 overexpression enhances the generation and function of interleukin-17-producing CD8(+) T cells in mice. Cell Signal, 2015. 27(6): p. 1246-52.
【9】Xiao, J., et al., UBC9 deficiency enhances immunostimulatory macrophage activation and subsequent antitumor T cell response in prostate cancer. J Clin Invest, 2023. 133(4).
【10】Zitti, B., et al., Innate immune activating ligand SUMOylation affects tumor cell recognition by NK cells. Sci Rep, 2017. 7(1): p. 10445.
【11】Wang, Z., et al., SUMOylated IL-33 in the nucleus stabilizes the transcription factor IRF1 in hepatocellular carcinoma cells to promote immune escape. Sci Signal, 2023. 16(776): p. eabq3362.
【12】Demel, U.M., et al., Activated SUMOylation restricts MHC class I antigen presentation to confer immune evasion in cancer. J Clin Invest, 2022. 132(9).
【13】Xiao, Y., et al., Lack of NFATc1 SUMOylation prevents autoimmunity and alloreactivity. J Exp Med, 2021. 218(1).
【14】Ding, X., et al., Protein SUMOylation Is Required for Regulatory T Cell Expansion and Function. Cell Rep, 2016. 16(4): p. 1055-1066.
【15】Ribet, D., et al., Listeria monocytogenes impairs SUMOylation for efficient infection. Nature, 2010. 464(7292): p. 1192-5.
【16】Li, Q., et al., Sumoylation of the nucleocapsid protein of severe acute respiratory syndrome coronavirus by interaction with Ubc9. Adv Exp Med Biol, 2006. 581: p. 121-6.
【17】Guo, J., et al., SUMOylation of Matrix Protein M1 and Filamentous Morphology Collectively Contribute to the Replication and Virulence of Highly Pathogenic H5N1 Avian Influenza Viruses in Mammals. J Virol, 2022. 96(4): p. e0163021.
【18】Lightcap, E.S., et al., A small-molecule SUMOylation inhibitor activates antitumor immune responses and potentiates immune therapies in preclinical models. Sci Transl Med, 2021. 13(611): p. eaba7791.










 危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)
危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)  营业执照(三证合一)
营业执照(三证合一)