分子实验难,小优来相伴!哈喽,我又来啦,小优子今天带大家一起来了解qPCR,上期(分子技术#2:终于有人将PCR一次性讲清楚啦!)中,带大家了解了PCR的来龙去脉,相信大家也是意犹未尽,这不,有小伙伴提问,那什么是qPCR呢?我该如何学习它呢?
话不多说,今天就让我们揭开它的神秘面纱吧,到底是怎么个一回事呢?
分子实验技术流程图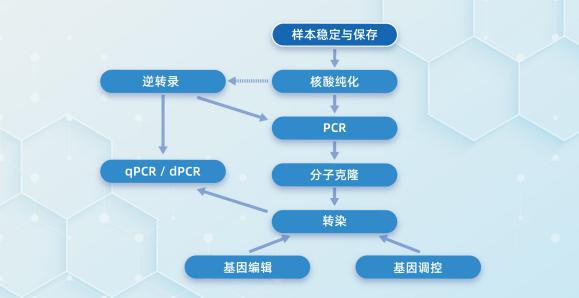 记住这张图,咱们分子的实验兜兜转转就在这里面了,分子技术系列内容也会以上图内容挨个介绍给大家,敬请期待吧!
记住这张图,咱们分子的实验兜兜转转就在这里面了,分子技术系列内容也会以上图内容挨个介绍给大家,敬请期待吧!
qPCR
发出疑问?它是什么?
英文名称:Quantitative Real-time PCR,又可以简称Real-time PCR,中文名称为:实时荧光定量聚合酶链式反应,国际上一般缩写为:qPCR。此技术是指在PCR体系中加入荧光染料或荧光探针,利用荧光信号积累实时监测整个PCR进程,最后通过CT值和标准曲线对未知DNA模板进行定量分析的方法。
荧光信号强度和DNA分子总数目成正比(换句话说就是可以通过荧光信号强度来判断出分子总数目)。
qPCR目前主要可以分为:以SYBR Green I染料法为主的荧光染料嵌合法;以Taqman探针法为主的荧光探针法。
qPCR的定量方法分为:相对定量和绝对定量。
相对定量“个人小传”
概念:用于测定两个或多个不同样品中靶基因量的差异,得到的数据是目的基因在各样本中含量的相对比例。多用于研究内部生理变化或外界环境变化对基因表达水平的影响。
相对定量常用的计算方法为:比较CT法,公式==2-△△CT,计算过程如下所示:
F=2-[待测组目的基因平均CT值 - 待测组内参基因平均CT值]-[对照组目的基因平均CT值 - 对照组内参基因平均CT值]
★ CT待测-CT内参(待测)=△CT待测
★ CT对照-CT内参(对照)=△CT对照
★ △CT待测-△CT对照=△△CT
★ F=倍数差异=2-△△CT
此公式用于计算待测样本与对照样本之间目的基因表达量的倍数变化,若F值=a(a>1),则代表待测样本相对于对照样本表达量上调a倍;反之若F值=b(1>b>0),则代表待测样本相对于对照样本表达量下调1/b倍。
注:2-△△CT法需保证目的基因和内参基因的扩增效率基本一致才能使用。可通过查看扩增曲线中指数增长期是否平行来确定扩增效率是否相似。
绝对定量“个人小传”
概念:常用于精确计算初始模板中目的基因的浓度,比如测定口腔拭子中的病毒颗粒数,细胞中的某基因浓度,得到的是单个样本定量的数据。
其主要是指在荧光定量PCR中,对已知量的样本进行连续稀释后扩增,生成标准曲线。
(1)将标准品稀释成不同浓度,作为模板进行PCR反应。
(2)以标准品拷贝数的对数值为横坐标,以测得的CT值为纵坐标绘制标准曲线
(3)根据未知样品的CT值,即可在标准曲线中得到样品的拷贝数。
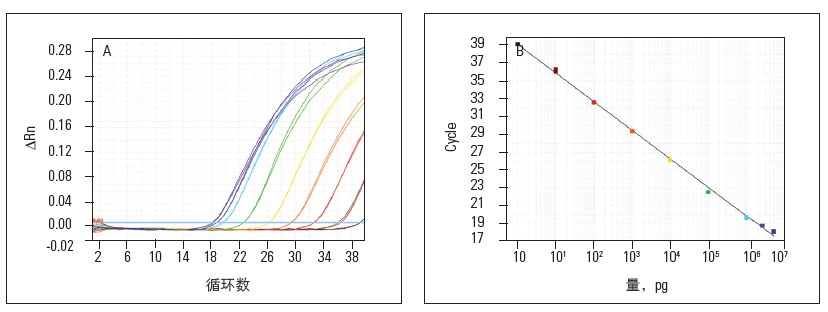 图注:从扩增曲线获得标准曲线(来自网络)
图注:从扩增曲线获得标准曲线(来自网络)
如上图可得,如果起始模板量浓度高,则可在较早的循环中观察到扩增,CT值小;如果起始模板量浓度少,则会在稍后的循环中观察到扩增,CT值大。
对于标准品如何选择或者制备,标准曲线的绘制,请在其它学习平台搜索了解,这里小编就不一一写出来啦!
相对定量多用于 基因在不同样本中的表达差异、基因在不同药物作用下的表达差异、或者是基因在不同环境变化下的表达差异等等;绝对定量多用于样本经过处理之后(例如:转基因)或者是样本本身发生了变化(例如:癌变),某基因在样本体内的具体浓度是多少。相对定量与绝对定量所针对的实验目的不同,大家可根据以上描述举一反三推测您自己做的实验需要用到哪种定量方法。
SYBR Green I染料法
概念与原理
SYBR染料法利用SYBR Green I分子的特点,SYBR Green I 是一种结合于所有双链DNA(dsDNA)双螺旋小沟区域的具有绿色激发波长的染料。SYBR Green I 只有和双链DNA结合后才发荧光,游离的染料分子不发光,在新合成链延伸过程中SYBR Green I掺入双链中,变性时DNA双链解开,SYBR Green I 游离出来,无荧光。荧光信号的强度与扩增得到的dsDNA的浓度成正比。荧光信号被仪器检测并采集得到“扩增曲线”,通过荧光信号的强度反映出体系中dsDNA的浓度。
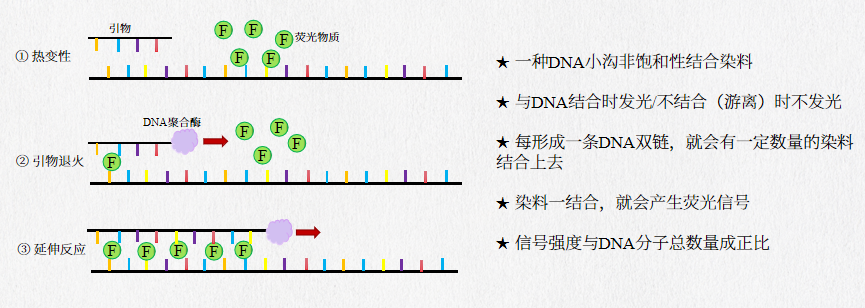 图注:染料法实验原理图
图注:染料法实验原理图
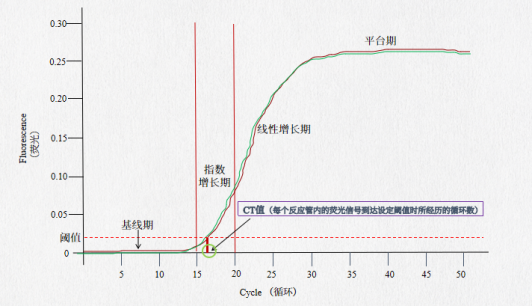 图注:扩增曲线示例图。手绘版本,仅供理解使用。
图注:扩增曲线示例图。手绘版本,仅供理解使用。
CT值:每个反应管内的荧光信号到达设定阈值时所经历的循环数。
阈值:一般是基线的标准偏差的10倍。
基线:通常是3-15个循环的荧光信号,此时的荧光信号变化不大,变化趋势接近于一条直线,即扩增曲线的水平部分,这样的直线就是基线。同一次反应中针对不同的基因需单独设置基线。
所以基线变,阈值会变,CT值也会变,所以大家如果需要做对比实验,尽量放在一起做呦!
但SYBR Green I 需要注意引物的特异性,因为非特异扩增产物和引物二聚体均为dsDNA,均可与特异性扩增产物结合,影响最终的正确结果。扩增反应结束后,需对生成的双链DNA进行分析:通过升温,dsDNA双链解开,SYBR Green I 染料脱落,荧光值逐渐下降,形成温度和荧光强度的曲线即“熔解曲线(Melting curve)”,由此判断体系中是否存在引物二聚体、非特异性扩增。
实验步骤是什么?
以相对定量步骤为例:检测热应激牛B基因与非热应激牛B基因的表达量
1. 提前做好引物设计
*引物长度18~30 bp、产物长度100~300 bp、G/C含量40~60%
*避免引物内含有互补序列 (尤其是3’端)、避免3’ 端错配、3’端不能出现连续三个以上的G或C、避免3’端出现T碱基 、设计跨内含子引物
*正反向引物Tm值最好不要相差超过1℃,Tm值接近60℃
2. 提前做好内参基因的选择
*内参基因(管家基因),由于它们在各组织和细胞中的表达水平相对稳定,在检测基因的表达水平变化时常用它来做参照物,具有校正作用,所以叫内参基因。常用的内参基因包括β-actin、GAPDH、18S rRNA、28S rRNA、B2M、HPRT1、TBP、ACTB、SDHA、ARBP内参基因等。
*首先,我们不能保证一种基因能够在不同生物、组织、器官、生理状态下永远保持稳定,所以我们需要根据自己的实验目的和样本类型去筛选最适合的内参基因。
*可通过查阅相关文献,获取相关内参基因;或者查询数据库,获取内参基因,网址链接:https://ngdc.cncb.ac.cn/icg/,可在此网站查询动物、植物、真菌、细菌的内参基因的引物序列,扩增长度等。
*那我们为什么要使用内参基因?
内参基因是在做相对定量期间使用的,例如,我们准备测定牛热应激的B基因与正常牛的B基因的表达量。通过qPCR相对定量的结果显示,热应激牛B基因的CT=25,正常牛B基因的CT=26,利用表达量倍数计算公式2-△CT计算,公式:2-△CT=2-[热应激牛B基因的CT - 正常牛B基因的CT]=2,结果发现热应激牛B基因表达量是正常牛B基因表达量的2倍。
但此结论成立的前提是,它们的生长环境,饮食,采样操作,提取,扩增效率等各种因素都要一致,这显然有点强人所难。
因此,为了将样本处理归一化,引入一个内参进行校正。此时计算需用公式:2-△△CT来计算。
3. 正式进入实验流程
①实验前准备
对照组核酸模板、处理组核酸模板、引物1(内参基因)、引物2(目的基因)、qPCR mix(SYBR Green I染料、DNA聚合酶、dNTP、Buffer)、ddH20
②实验分组与排版设计
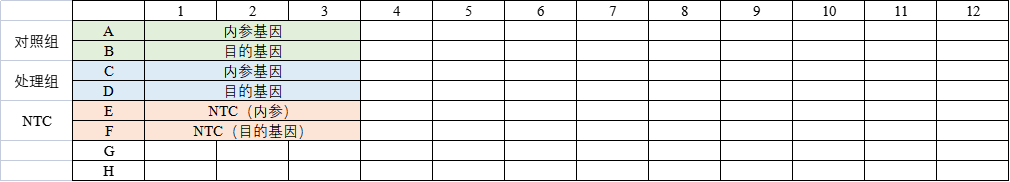
对照组:
内参基因反应管:对照组模板+引物1(内参基因)+qPCR mix+ddH20
目的基因反应管:对照组模板+引物2(目的基因)+qPCR mix+ddH20
处理组:
内参基因反应管:处理组模板+引物1(内参基因)+qPCR mix+ddH20
目的基因反应管:处理组模板+引物2(目的基因)+qPCR mix+ddH20
NTC:
NTC内参基因反应管:水+引物1(内参基因)+qPCR mix+ddH20
NTC目的基因反应管:水+引物2(目的基因)+qPCR mix+ddH20
无模板对照(NTC):
包含除模板之外的所有扩增反应所必要组分的对照反应,模板通常用水代替。使用NTC可以发现由于试剂污染或外源DNA造成的污染,从而确保检测数据的真实性和可靠性。如果NTC对照有扩增,即代表有污染。
③上机与计算
反应体系可根据所购买的试剂盒推荐添加至反应管。上机设置同前。另外计算根据2-△△CT来计算。
Taqman探针法
概念与原理
是指在PCR扩增时还需加入一个特异性的荧光探针,该探针是单链DNA,两端分别标记一个发光基团(5’端)和一个淬灭基团(3’端),游离的完整探针是检测不到荧光信号的,发光基团发出的荧光会被淬灭基团吸收淬灭,探针被水解,发光基团和淬灭基团远离就可以检测到荧光信号。
反应开始时,模板链经热变性解链形成单链,TaqMan探针优先跟模板链退火,引物随后退火到模板上,之后进行链的延伸,延伸过程中Taq酶发挥5’-3’外切酶活性,遇到探针会从5’端逐个碱基切除探针,发光基团会跟淬灭基团分开,因此荧光检测系统可以接收到荧光信号,每扩增一条DNA链,就有一个荧光分子形成,荧光信号的累积和PCR产物形成是同步的。
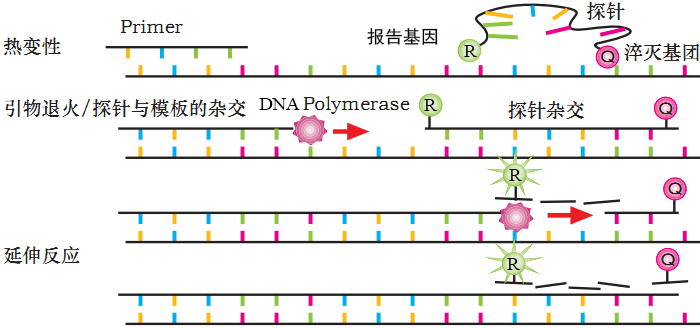 图注:探针法实验原理图(来自网络)
图注:探针法实验原理图(来自网络)
实验步骤是什么?
探针法的相对定量方法可参考染料法的相对定量方法,只不过qPCR mix的其中一个组分(染料)需变为:特异性的荧光探针。
总结:
目前大家大多数使用的还是染料法,至于做相对定量还是绝对定量,根据实验需求确定。当然此文章并未将qPCR两种方法的绝对定量进行详细的描述,大家可在其余学习平台进行搜索学习,有问题可私信小编呦~
常用的qPCR试剂有哪些?
| 货号 | 品名 | 规格 | 产品介绍 |
| abs60270 | miRNA茎环染料法荧光定量PCR试剂盒 | 200T/400T | 该产品采用本司生产的化学修饰的热启动聚合酶,使用SYBR Green I嵌合荧光法进行miRNA的荧光扩增,具有高度的特异性,能够有效避免引物二聚体形成和其它形式的非特异扩增 |
| abs601512 | 2 × 预混实时荧光定量快速PCR反应体系(高浓度ROX) | 1.7mL*3 | 本产品是采用 SYBR Green I 嵌合荧光法进行实时荧光定量 PCR 的专用 2×浓度预混液 |
| abs601513 | 2 × 预混实时荧光定量快速PCR反应体系(低浓度ROX) | 1.7mL*3 | |
| 6101S | Volcano3G® RT-PCR Probe 2x Master Mix |
100/500 reactions at 25 µL |
①兼具逆转录酶活性的工程化Taq DNA聚合酶,并结合优化的反应缓冲液 ②高达95℃热稳定性的双功能酶 ③无需样本提取,支持粗样本直扩 ④采用适配修饰热启动方法,更快速启动反应 |
| 6101M | |||
| 208054 | QuantiNova SYBR Green PCR Kit | 500T | 染料法荧光定量试剂盒 |
| 208254 | QuantiNova Probe PCR Kit | 500T | 探针法荧光定量试剂盒 |










 危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)
危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)  营业执照(三证合一)
营业执照(三证合一)