今年一月份,医学类神刊CA上发布了一篇名为《Cancer Statistics,2023》的癌症报告。报告指出,自1991年以来美国癌症死亡率总体下降了33%,但癌症依旧是美国的第二大常见死因。无独有偶,去年在Journal of the National Cancer Center杂志上发布的《Cancer incidence and mortality in China, 2016》一文,指出2020年中国癌症死亡人数占全球30%,可谓是“癌症大国”。
在人人都谈癌色变的今天,如何攻克癌症,已然是所有医学工作者研究的热点问题之一。近几月,Nature上发布了多篇肿瘤研究进展,不仅揭示了癌症从发生到转移的驱动因素,还提供了一些癌症治疗的新靶点!
提示:由于干货较多、篇幅较长,建议大家先收藏哦!
01 又一新肿瘤免疫检查点被发现,β受体阻滞剂或可协同抗癌!
标题:Theβ1-adrenergic receptor links sympathetic nerves to T cell exhaustion
发表时间:2023.9.20
原文链接:https://doi.org/10.1038/s41586-023-06568-6

概述:
T细胞,特别是CD8+ T细胞受到慢性炎症或肿瘤抗原的长期刺激,会导致其失去杀伤肿瘤细胞或清除病毒的功能,这种状态被称为T细胞耗竭。耗竭的 CD8+ T 细胞β1肾上腺素能受体( ADRB1)表达会上调,儿茶酚胺则会抑制 ADRB1+ T 细胞产生细胞因子,影响其增殖功能。
本文指出ADRB1是一个新的免疫检查点,在长期暴露于抗原的情况下,肾上腺素能通过 ADRB1 向 T 细胞发出信号,促使 T 细胞转入耗竭状态。用β受体阻滞剂对 ADRB1 进行基因或药物阻断,可防止 T 细胞的终末耗竭分化,并增强 T 细胞的功能。这提示将β受体阻滞剂与现有免疫检查点抑制疗法联合使用,有望实现协同增效,破解肿瘤免疫治疗耐药的难题。
主要内容:
1、耗竭的 CD8+ T 细胞β1肾上腺素能受体 ADRB1表达上调
通过构建小鼠慢性脑膜炎模型(LCMV),发现分化程度更高的CD8+T 细胞亚群——TEXeff和耗竭的TEXterm,其ADRB1的表达水平显著高于祖细胞和幼稚T细胞。对耗竭的CD8+T细胞的通路分析显示,肾上腺素能受体信号通路富集程度提高,并且去甲肾上腺素水平也显著增高。

2、TEXterm 细胞的分布靠近交感神经
在LCMV 感染的脾脏以及胰腺癌小鼠模型中,均观察到TEXterm 细胞更加靠近表达酪氨酸羟化酶(TH+)的交感神经。随后,通过研究 164 个人类非小细胞肺癌 (NSCLC) 样本,发现约 20% 的样本中 THhigh 染色显着增加。这些发现表明,TEX 样细胞与慢性病毒感染组织和肿瘤组织中的交感神经具有近距离的相互作用。

3、Adrb1 的活性可促进T细胞耗竭
利用逆转录病毒使 CD8+ T 细胞过表达 Adrb1,发现其增殖及释放细胞因子的能力下降,而这正是 T 细胞耗竭的两个典型特征。随后的一系列实验结果揭示了 CD8+ T 细胞中存在 ADRB1-cAMP-CREM 信号轴,并表明 Adrb1 表达的增加会抑制 CD8+ TCR 活性,并通过 cAMP-CREM 信号通路促进T细胞耗竭。
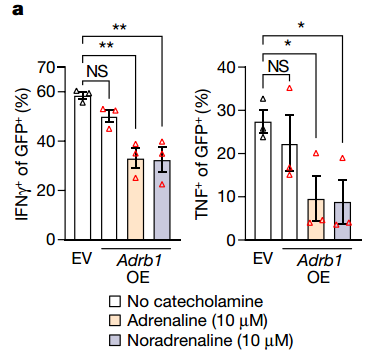
4、敲除 Adrb1 可抑制末期耗竭
在感染LCMV病毒后,敲除 Adrb1会导致终末耗竭 CD8+ T 细胞标志物的表达显著降低、祖细胞特有的转录因子TCF1表达显著升高,这说明Adrb1能促进终末耗竭CD8+ T细胞分化。此外,研究发现敲除病毒特异性 CD8+ T 细胞上的 Adrb1 可促进细胞维持在TEXprog 状态,阻止其向交感神经迁移,并与 ICB 疗法有协同作用。

5、阻断 ADRB1 可抑制 TEXterm 细胞的形成
采用药物阿替洛尔药理阻断慢性感染小鼠的ADRB1 受体,可抑制CD8+T细胞衰竭,促使其产生更多的IFNγ、TNF 和颗粒酶B,降低其cAMP 和 CREM 的含量,并使病毒滴度降低。这些结果表明,药物阻断 ADRB1 可防止抗原特异性 CD8+ T 细胞功能衰竭。

6、阻断 ADRB1 可使 TIL 恢复活力
作者接下来评估了单独使用阿替洛尔或与ICB(抗PD-1加抗CTLA-4)联合使用药物阻断ADRB1对T细胞抗黑色素瘤的影响,结果显示联合治疗组的小鼠肿瘤明显缩小,且产生的细胞因子大幅增加。结合慢性病毒感染模型的结果,作者得出结论:ADRB1 的表达是不同病因、不同肿瘤类型和不同物种中 T 细胞耗竭的一个保守和可靶向的分子。

7、β受体阻断剂与ICB可联合治疗胰腺导管腺癌(PDAC)
采用非选择性β受体阻断剂普萘洛尔与 ICB 联合用药来治疗PDAC,发现肿瘤生长显著减少,且会增加肿瘤中 CD8+ T 细胞的数量,同时增加活化-衰竭标志物 PD-1 和 TIM3 的表达,也增加了IFNγ和颗粒酶 B 的产生。对不同上调基因的分析表明,普萘洛尔和 ICB 治疗在增强 T 细胞反应方面具有协同作用。

部分相关优宁维可提供产品推荐:
|
货号 |
品名 |
反应种属 |
应用 |
|
β1-Adrenergic Receptor Antibody |
H M R |
WB |
|
|
Anti-β1-Adrenergic Receptor (extracellular) Antibody |
M, R |
IF, IFC, IHC, LCI, WB |
|
|
PD-1 (Intracellular Domain) (D4W2J) XP® Rabbit mAb |
H |
WB,IP,IHC,IF,F |
|
|
PD-L1 (E1L3N®) XP® Rabbit mAb |
H |
WB,IP,IHC,F |
|
|
Phospho-PLCγ1 (Tyr783) (D6M9S) Rabbit mAb |
H M |
WB,IP,F |
|
|
TCF1/TCF7 (C63D9) Rabbit mAb (Pacific Blue™ Conjugate) |
H M |
F |
|
|
Alexa Fluor® 647 Mouse anti-Mouse Ly-108 |
Mouse |
F |
02 胰腺癌的“帮凶”,竟然是巨噬细胞!
标题:IL-1β+macrophages fuel pathogenic inflammation in pancreatic cancer
发表时间:2023.11.01
原文链接:https://www.nature.com/articles/s41586-023-06685-2

概述:
胰腺导管腺癌(Pancreatic ductal adencarcinoma, PDAC)是一种对治疗具有高耐药性的致死性疾病。炎症和免疫调节信号在胰腺肿瘤微环境中共存,导致修复和细胞毒性反应失调。
本文研究发现,阻断PGE2或表达白细胞介素-1β (IL-1β)活性可引发巨噬细胞(TAM)重编程并拮抗肿瘤细胞的内源性和外源性炎症,从而在体内控制PDAC,因此,靶向PGE2-IL-1β信号通路可能为胰腺癌免疫动力学重编程提供预防或治疗策略。
主要内容:
1、IL-1β+ TAM与PDAC患者不良预后相关
对初诊或化疗的PDAC患者的新鲜解离肿瘤样本进行scRNA-seq分析,发现IL1β+ TAM的表达与较差的患者生存率相关,并且PDAC病人的血液单核细胞中IL1β+ TAM基因上调。这些数据揭示了IL1β+ TAM是表达炎症和非细胞毒性程序的PDAC巨噬细胞的一个子集,其丰度与不良预后相关。

2、IL-1β+ TAM在小鼠PDAC中是一个保守的巨噬细胞群体
胰腺癌原位模型的血液、胰腺和肿瘤的纵向scRNA-seq的结果表明,IL1β+ TAM以及Folr2+、Spp1+和Mki67+ TAM的标志基因和转录程序在小鼠、人类中广泛保守。与scRNA-seq分析一致,在PDAC小鼠中IL-1β由TAM的一个亚群表达。因此,IL1β+ TAM是一个保守的巨噬细胞群体,共同表达炎症和免疫抑制标志物。

3、IL1β+ TAM来源于单核细胞
单核细胞进入肿瘤后会上调IL1β+ TAM的标志性基因,另外在对照小鼠和荷瘤小鼠的循环单核细胞中IL-1β蛋白水平较低,但被募集到肿瘤后,IL-1β蛋白水平大幅增加。这些结果表明,绝大多数IL1β+ TAM起源于浸润肿瘤并暴露于TME局部因子的循环单核细胞。

4、PGE2和TNF诱导IL1β+ TAMs
IL1β+ TAM转录组在小鼠巨噬细胞中被IL-1β或TNF诱导,然而,仅用IL-1β或TNF处理小鼠骨髓源性巨噬细胞并不会引起IL-1β合成。进一步研究发现,人和小鼠PDAC活检组织或肿瘤细胞培养上清中检测到高水平的PGE2,并且PGE2诱导的基因在IL1β+ TAM中过度表达。这些结果表明PGE2和TNF作为TME因子能够共同引发PDAC中IL1β+ TAM状态。

5、PDCA来源的PGE2促进肿瘤生长
使用用COX2的选择性抑制剂celecoxib处理具有免疫能力的小鼠,能够延缓肿瘤的生长。从COX2-KO肿瘤分离出的IL1β+ TAM中,关键基因和炎症反应标志物的表达降低,并具有干扰素反应特征。这些结果表明,肿瘤源性PGE2在体内驱动IL1β+ TAM状态中起到关键作用,并且靶向COX2以干扰素不依赖的方式导致TME重编程和疾病控制。

6、PDAC细胞中的致病性IL-1β信号通路
在体内使用抗体介导IL-1β靶向治疗会引起PDAC生长延迟,同时单核细胞和TAM中IL-1β表达降低,引流淋巴结中细胞毒性T细胞活化增加。在免疫正常的小鼠中,IL1R1-KO KPC细胞的肿瘤形成能力明显降低。这些结果表明,肿瘤细胞内在的IL-1β信号通路对PDAC生长具有重要作用。

7、PDAC的早期炎症性重编程
数据分析发现,良性胰腺上皮内瘤变(PanIN)小鼠的细胞中T1RS的表达最高,在已建立的PDAC和远端转移中,T1RS的表达水平仍然很高。这些结果表明,炎症重编程和TIRS表达发生在胰腺肿瘤的早期,导致与疾病进展和不良患者预后相关的持续转录变化。

8、IL-1β+ TAMs与T1RS+ PDAC共定位
T1RS+ PDAC细胞是由T1RS本身和已知IL-1β靶基因的表达增加所驱动的转录轨迹的终点。CXCL1与KRT19、巨噬细胞标记基因(CD68)以及IL-1β和PGE2程序在空间上明显共表达;IL1β+ TAM标志基因的相关性高于其他巨噬细胞亚群。这些结果表明,IL1β+ TAM与T1RS+ PDAC共定位,并在肿瘤细胞验证重编程和病理性程序中发挥重要作用。

部分相关优宁维可提供产品推荐:
|
货号 |
品名 |
应用 |
| 9242S |
IkappaBalpha Antibody |
WB |
| 4842S |
Cox2 Antibody |
WB |
| 10600002 |
NC 0.45UM 300MMx4M 1/PK |
WB |
| 93498S |
CD163(D6U1J)Rabbit |
IHC |
| BE0036-1MG |
InVivoMAb anti-mouse NK1.1 |
体内实验 |
| abs601511 |
qPCR反应体系 |
qPCR |
| 559763 |
BD Pharmingen™ PE Annexin V Apoptosis Detection Kit |
FACS |
03 协助医生完成脑肿瘤手术,AI发展竟如此智能了?!
标题:Ultra-fast deep-learned CNS tumour classification during surgery
发表时间:2023.10.11
原文链接:https://www.nature.com/articles/s41586-023-06615-2

概述:
中枢神经系统肿瘤是最致命的癌症类型之一,目前主要的治疗是神经外科切除。然而外科医生在术前对肿瘤类型的准确判断主要依赖于术前影像和术中组织学分析,这偶尔也会产生错误的判断。因此,作者开发了Sturgeon神经网络,可依靠全基因组DNA甲基化情况对中枢神经系统肿瘤进行分子细分。基于快速且低成本术中测序的机器学习诊断可以辅助神经外科决策,潜在地预防神经系统共病,避免额外的手术。
主要内容:
1、基于仿真的神经网络训练
Sturgeon采用数量级增强的方法对可用的训练样本进行采样,从每个甲基化图谱模拟数千个独特的纳米测序实验。

2、儿科阵列数据的分类
对于绝大多数可以使用海德堡评分进行分类的儿科病例,Sturgeon可以在模拟测序的 25-50 分钟内得出结论性诊断,且错误率非常低;对于难以诊断的病例,其中的大多数Sturgeon是可以在较晚的时间给出和模拟诊断一致的结果的。

3、样品纯度影响灵敏度
术中的组织样本大多数情况下并没有模拟中的纯度,其中包含大量的正常细胞。作者进一步评估了Sturgeon在低纯度肿瘤样本中的表现,较高比例的混杂会降低Sturgeon的性能,但是并不会导致大量的错误分类。这表明,即使肿瘤比例未知,Sturgeon的判断也是可靠的。

4、纳米孔测序样品的分类
Sturgeon在 36,000 个预测中报告了 27,980 个正确类别(77%,得分 ≥0.95);在开放的数据集中作者也进行了验证,Sturgeon分类正确率92.2%。尽管样本工作流程存在这些差异,但 Sturgeon 的表现仍然符合预期。

5、拷贝数变异
除了甲基化分析外,拷贝数变异(CNV)在肿瘤分类、预后和下游治疗中也发挥着重要作用。作者遵循海德堡评分,在工作流程中向病理学家提供 CNV 图,同时提供甲基化分类器结果,以此进一步支持了 Sturgeon 提供的分类。

6、术中测序
作者将手术期间获得的用于组织学评估的25个样本分开,一部分用于术中测序,另一部分用于组织学评估。结果表明,Sturgeon 能够在最多 45 分钟的测序时间内对 72% 的肿瘤进行亚类水平正确分类。

7、特定位置模型
通过将训练Capper 等人的数据集中不相关的类合并为单个类,模型可以专注于真正相关的类并提高其性能,开发了专门针对于脑干肿瘤的Sturgeon,调整后可以稍微提高所需的测序深度。
8、自适应采样
作者设计了一种自适应采样策略并在五个样本中进行了测试,自适应采样每分钟测序的信息丰富的 CpG 位点数量增加了 15-30%,并且 Sturgeon 对同一样本进行分类更有信心。

部分相关优宁维可提供产品推荐:
|
货号 |
品名 |
应用 |
| 51304 |
QIAamp DNA Mini Kit (50) |
DNA提取 |
| NBP2-50525JF549 |
N6-methyladenosine (m6A) |
WB, IP |
| sc-89093 |
M6A siRNA (h) |
细胞实验 |
| NB900-66727 |
Proteinase K |
IHC, IHC-Fr, IHC-P |
04 只需这本图谱,就能洞悉癌症的发生和转移!
标题:Epigenetic regulation during cancer transitions across 11 tumour types
发表时间:2023.11.01
原文链接:https://doi.org/10.1038/s41586-023-06682-5

概述:
染色质可及性在调控基因表达和细胞特性方面是必不可少的,可及性的改变已被认为与癌症的启动、进展和转移有关。
本文利用snATAC-seq和snRNA-seq分析染色质可及性和基因转录之间的关联,构建了泛癌表观遗传学和转录切割图谱,该图谱为进一步研究癌症转化过程中的表观遗传动力学奠定了基础。这项研究强调了转录因子(TFs)作为预后标志物的潜力,在分子基础层面深入了解驱动癌症进化的因素。
主要内容:
1、癌症中的染色质可及性
作者从11种癌症中获取了225个样本进行snATAC-seq和sc/snRNA-seq分析,找到了它们的可及染色质区域(ACR)。此外,生成的WES数据能够系统地识别不同癌症类型中的细胞亚群,并跟踪从正常前体到原发肿瘤再到肿瘤转移的癌症进化过程。

图1:数据生成和研究设计示意图
2、肿瘤中染色质区域的改变
使用CNCs去除组织特异性信号,并识别几种癌症类型共有的癌细胞特异性的染色质可及性变化。结果发现,56,001个组织和癌细胞特异性染色质区域(DACR)中,53%位于增强子区域,37%位于启动子区域,这表明它们的功能与基因表达的变化有关。此外,作者还进一步确定了富含癌细胞特异性的DACRs标志性通路。

图2:不同癌细胞与肿瘤起源组织的正常细胞之间的相关性,以及与癌细胞相关的DACR
3、肿瘤进展中ACR与基因联系
增强子可及性对癌症类型和起源组织的特异性要显著高于启动子的可及性,并且能够更好地反映转录本的表达,这表明它们在调控基因表达方面发挥了关键作用。作者找到了一些关联的ACRs和基因可能与从正常癌细胞向原代癌细胞的转变有关,并证明了ACR对基因分析在识别远端顺式作用元件和临床相关基因之间潜在的调控关系方面的作用。
 图3:ACRs的可及性,与PDAC癌细胞中的基因表达有关
图3:ACRs的可及性,与PDAC癌细胞中的基因表达有关
4、原发肿瘤中的调控子
作者研究了构成细胞状态的TF靶基因,其中有87个调控子对某些癌症类型表现出高度的特异性,并且调控子在恶性肿瘤中活性会增强。癌细胞特异性调控子的靶基因富集在癌症特异性通路上,表明它们参与了癌症相关的过程。其中,21个TF的靶基因更有可能与含有这些TF结合基序的ACR相连,验证了目标基因表达、ACR可及性和TF活性之间的相关性。

 图4:TF、TF靶基因与富含TF特异的ACR到基因的连接
图4:TF、TF靶基因与富含TF特异的ACR到基因的连接
5、表观遗传学在癌症转移中的作用
通过比较四种癌症(SKCM、CRC、PDAC和UCEC)中原发癌细胞和转移癌细胞的TF基序和可及性得分,确定了常见的和特定的TF都参与了不同癌症的转移过程。进一步研究发现,所有配对的原发-转移样本都遵循线性轨迹,即从正常——原发——转移细胞,与癌症转移相关的TF基序呈正相关。

图5:在癌症转移中激活的表观遗传程序
6、遗传和表观遗传交互作用
TERT启动子(TERTp)突变优先在癌细胞中获得,这与snRNA-seq数据中获得的高TERT表达结果一致。与snATAC-seq数据相比,批量WES的TERTp突变的等位基因变异频率要低得多,这表明snATAC-seq能够检测到导致染色质可及性的突变。许多癌基因显示出增强子与基因之间的联系,这表明这些基因具有广泛而复杂的表观遗传调控。

图6:癌基因的表观遗传调控
7、临床相关的表观遗传学程序
研究确定了癌症特异性的DEGS和DACR,它们是潜在的药物靶点。并且,作者观察到已知的药物靶点在癌症中富集的例子,这些靶点在临床实践中还没有使用。
部分相关优宁维可提供产品推荐:
|
货号 |
品名 |
应用 |
| 4084L |
DRAQ5 |
FACS |
| 130-093-235 |
MACS全自动温和组织处理器-GentleMACS |
单细胞悬液制备 |
| 86652S |
CUT&RUN Assay Kit |
CUT&RUN |
| abs929-1支 |
免疫组化笔 |
IHC |
| 13684T |
PD-L1(E1L3N)XP Rabbit mAb |
IHC |
05 掌握癌症的这个弱点,就能对其一击致命!
标题:Disruption of sugar nucleotide clearance is a therapeutic vulnerability of cancer cells
发表时间:2023.10.25
原文链接:https://doi.org/10.1038/s41586-023-06676-3

概述:
在细胞的新陈代谢过程中,会产生有毒的中间产物,这时需要酶将有毒中间产物转化成无毒的分子来防止毒素的积累,癌细胞也不例外。
在肺腺癌、乳腺癌、结肠癌等几种癌症中,UGDH(UDP葡糖醛酸脱氢酶)表达升高,并在化疗耐药选择过程中进一步增强。UGDH将葡萄糖代谢产物转化为UDP葡糖醛酸(UDPGA),UXS1是一种高尔基体酶,能够将UDPGA转化为UDP木糖。这些癌细胞选择性地依赖于UXS1来进行UDPGA解毒,这揭示了高表达UGDH肿瘤的治疗靶点。
主要内容:
1、确定UXS1为候选解毒酶
首先,利用DEPMAP数据库筛选出一些癌细胞株生存所必需的代谢酶,最终找到UXS1与其
上游的UGDH基因高表达最相关。接着,利用CRISPR-Cas9敲除了UXS1基因,结果发现UXS1的敲除只对表达高水平UGDH的细胞系有害,而对正常细胞几乎没有影响。

 图1:UXS1的丢失靶向杀死表达高水平UGDH的细胞系
图1:UXS1的丢失靶向杀死表达高水平UGDH的细胞系
2、UXS1防止UDPGA毒素的积累
作者首先证明了是UDPGA的积累,而不是木糖修饰的缺失产生了毒性。接下来,通过抑制UGDH的表达来防止UDPGA的产生,这挽救了那些UXS1基因敲除的癌细胞,进一步证明UDPGA的积累才是杀死癌细胞的关键所在。此外,在UXS1敲除突变体中,由于缺少UDP木糖,UGDH的活性也会提高,从而更加导致UDPGA大规模增加,这与之前的研究结果一致。

图2:高水平表达UGDH的细胞依赖于UXS1来防止UDPGA的毒性过度积累
3、过量的 UDPGA 会破坏高尔基体的功能
UXS1的敲除极大地改变了高尔基体的形态,这是由于细胞质中积累了过量的UDPGA。进一步研究发现,UXS1敲除突变体中细胞表面受体会发生糖基化缺陷,尤其是EGFR,它的失活对癌细胞有害。
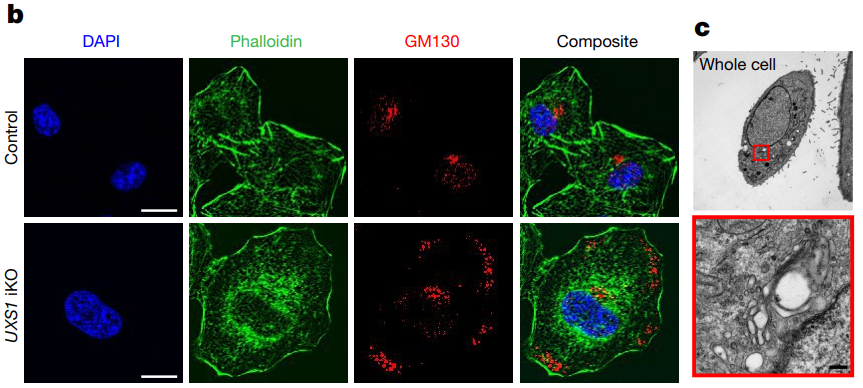
 图3:过量的UDPGA破坏了高尔基体的形态和功能
图3:过量的UDPGA破坏了高尔基体的形态和功能
4、UXS1作为癌症选择性靶点的研究
在高表达的UGDH肿瘤的活体模型中,UXS1的敲除会导致肿瘤生长明显受阻。与正常组织相比,肺癌和乳腺癌中的UGDH表达升高,这表明UXS1靶向损伤癌细胞,但不会损伤正常细胞。作者还发现,UGDH的高表达与许多药物的耐药性增加相关,因此UXS1靶向为治疗化疗耐药的癌细胞提供了新思路。
图4:UXS1靶向治疗高表达UGDH肿瘤和化疗耐药性癌细胞
部分相关优宁维可提供产品推荐:
| 货号 | 品名 | 应用 |
| SH30406.05 | 新西兰胎牛血清 | 细胞培养 |
| 101000017 | PEIpro | 病毒转染 |
| abs9229-100ml | RIPA裂解液 | WB |
| 5872S | Protease/Phosphatase Inhibitor Cocktail(100X) | WB |
| 111-035-003 | Peroxidase-conjugated AffiniPure Goat Anti-Rabbit IgG (H+L) | WB |
| FAB10951F | Human EGFR Fluorescein-conjugated Antibody | FACS |










 危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)
危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)  营业执照(三证合一)
营业执照(三证合一)