BIAcore是一种基于光学表面等离子共振(Surface Plasmon Resonance,简称SPR)原理的用于分子互作分析的常用方法。
因为其准确性高、重复性好、应用广泛,目前SPR原理用于药物分析的方法已经被录入中国、美国、日本的药典,基于BIAcore方法的文献也已经超过了15000篇。那这个方法为什么会这么优秀,我们来给大家介绍一下!
SPR其实是一个运用物理光学原理,来检测因为分子结合导致的介电常数的变化引起的角度的变化,角度的变化会导致响应值的变化。

变化会实时的从传感图检测出来:

从上面的传感图也可以看出,SPR的方法不仅可以检测是否有特异性的结合,还可以通过数据分析软件获得分子间的结合速率常数(association rate constant,ka)、解离速率常数(dissociation rate constant,kd)、平衡解离常数(dissociation equilibrium constant,KD)等,从而可以得到亲和力、浓度、动力学、热力学等参数,这些在药物研发中非常重要的数据,所以在SPR 技术被正式收录到中国、美国和日本药典后,越来越多的被应用到药物的研发和质控中。
那接下来我们通过一些文献来看一下BIAcore在药物研发中主要应用的方向:
01
特异性分析
目标分子与靶分子之间是否发生特异性结合?
分子互作最基本的检测参数,我们可以利用特异性结合在药物研发过程中来筛选和药物分子特异性的结合的药物靶点受体。
BIAcore的优势在于可以重复使用作为受体的靶点,只需要进行合理的再生,就可以高效的进行多种分子的筛选验证。
在下面这篇文献当中,作者就是想验证哪些分子可以和肿瘤靶向分子EGFR特异性的结合并且具有较好的特异性,可以作为潜在的药物作用靶点。
所以在实验之初,作者通过软件模拟筛选结合位点,然后用BIAcore进行验证,最后筛选出有潜力的结合位点,再进行下游的实验分析。
经证明,只有小分子NSC51186能特异地与EGFR结合,如下图为从上到下的曲线依次是浓度由高到低的小分子NSC51186在EGFR表面流过的响应值(扣除了BSA参比),响应值的变化说明了有特异性的结合。(未结合的未展示)

BIAcore 分析 NSC51186 和 EGFR 之间的相互作用 EGFR 固定于芯片上不同浓度的小分子 51186(250, 350, 400, 450, 475, 500nM )依次流过EGFR表面
02
亲和力测定
配体与分析物之间的结合强弱?
亲和力,可以用解离平衡常数(KD)反映,是一个描述配体和分析物分子之间的结合强度的参数,对于生物药物研发来说,亲和力是判断药效的关键功能属性之一,在生物药研发的过程中,抗体亲和力测定意义重大,可以为新型抗体偶联药物开发提供依据。
在下面这篇文章之中,作者就是通过 SPR 法测定单抗及其相对应的抗体偶联药物与受体间的相互作用,计算其亲和动力学。
抗体—药物偶联物(ADC)是特异性靶向肿瘤抗原的抗体与细胞毒性药物连接的一类治疗药物,ADC可以提高治疗指数,因为它们被设计成特异性递送细胞毒性剂对肿瘤细胞,并限制对正常细胞的附带损伤。
目前仅有上市的T-DM1就是由曲妥珠单抗、高活性抗有丝分裂的美登素衍生物DM1通过交联剂琥珀酰亚胺酯偶联形成的ADC,唯一一个用于与HER2受体结合治疗实体瘤的。文中作者讨论的就是其他的ADCs的在治疗过程中起作用的可能性,作者挑选了265SD、P-DM1、P-MMAE、WBP26这些正处于临床前试验阶段的正在研发的新药。
文章利用 Biacore T200 检测抗体偶联药物及单克隆抗体与受体 HER2的KD值,如果数值在10^(-10)左右,就认为有很高的亲和力,活性高。
首先将抗人 IgG(Fc)抗体氨基偶联到 CM5 传感芯片表面的方式,应用单循环动力学(SCK)测定抗体偶联药物及单抗与受体的亲和动力学,SPR 实时监测到的供试品与 HER2 结合解离的 SPR 时间变化曲线,用1:1 Lamgmuir 模型描述拟合的情况,对所得结合曲线进行综合分析(如下图的单抗 Tratuzumab和抗体偶联药物 T-DM1)。
然后再用Biaevaluation 分析软件处理后,平衡解离常数 KD(亲和力)可利用软件得出的解离速率常数 kd 和结合速率常数 ka计算得出(数据见下表)。通过亲和力初步判断哪些ADC适合进行后面的药物研发实验。

单抗 Tratuzumab 与受体 HER 2 的 1:1 Lamgmuir 结合动力学曲线
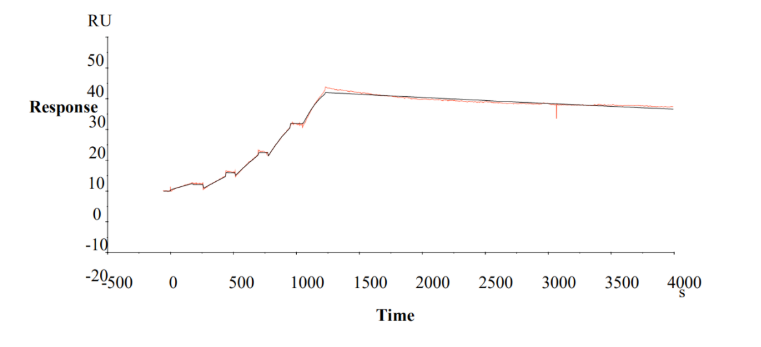
抗体偶联药物 T-DM1 与受体 HER 2 的 1:1 Lamgmuir 结合动力学曲线

单抗及抗体偶联药物与受体 HER 2 的亲和常数
参考文献:张茂桃. (0). 基于HER2靶标的抗体偶联药物(ADCs)内吞机制研究. (Doctoral dissertation).
03
动力学分析
两分子结合和解离的速率快慢?
动力学在分子互作中是用来描述分析物与配体之间结合的速率(ka)和解离的速率(kd),是表征分子结合很重要的参数。在药物研发过程中,我们可以通过检测结合或者解离速率来判断结合的药物分子作用的时间和效果。
例如这篇文献当中作者对HIV蛋白酶突变与抑制剂耐受性的关联性进行研究,通过BIAcore方法检测不同突变体和抑制剂的结合的动力学和亲和力,来探究影响抑制剂作用的关键因素。
为了研究抑制剂的结构和耐药性之间的关系,作者做了关于HIV-1蛋白酶耐药突变体和一系列抑制剂之间的研究。突变体是根据已知的临床常用抑制剂耐药突变体,并结合蛋白酶中的氨基酸的位置进行设计。如下图所示,作者构建了单个和多个位点的突变,突变的氨基酸伟G48V,V82A,I84V和L90M。
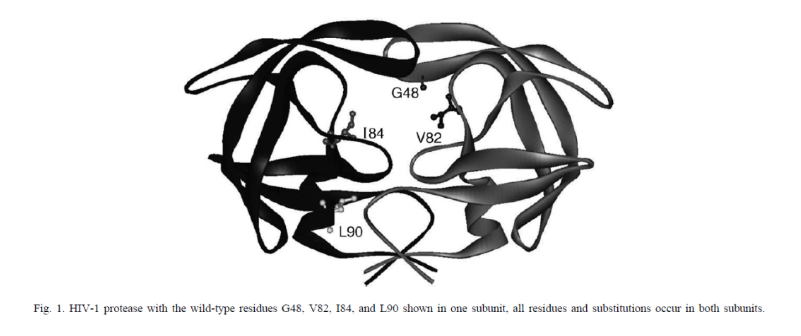
接下来,作者通过Biacore检测野生型/突变的HIV蛋白酶和抑制剂之间的亲和力和动力学参数。结果如下方的表格所示。

通过进一步对结合动力学进行分析,作者发现和野生型相比,突变体和抑制剂之间的解离速率明显增加。


作者进一步对实验结果进行了讨论和分析。Leu90是一个位于二聚体表面的氨基酸残基,替换为Met降低了二聚体的稳定性。本次实验表明,Leu90替换为Met,对抑制剂的结合具有非特异性的作用,由于解离速率增加而亲和力减弱。
Gly48位于蛋白酶的flap区,对于结合位点成型和酶复合体稳定性具有重要的作用,这个位点突变之后,对saquinavir形成耐受性,解离速率增加。而82和84位点位于活性位点,突变之后引起亲水性和范德华力作用的减少,数据表明结合和解离速率的改变引起亲和力的减弱。
参考文献:Shuman , et al. Antiviral Research, 2003, 58(3):235-242.
总结:SPR技术在药物研发中运用的越来越广泛,也说明了SPR方法在药物研发中重要的位置。本文旨在抛砖引玉,简单的介绍哪些功能可应用于生物药研发当中,如果有需要,可以自行下载文献了解,或在小优课堂小程序搜索蛋白课堂大咖讲BIAcore,我们有4期关于BIAcore应用的讲座可以观看。










 危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)
危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)  营业执照(三证合一)
营业执照(三证合一)