白介素4(IL-4)是一种细胞因子,可诱导幼稚辅助性T细胞(Th0细胞)分化为Th2细胞。通过IL-4激活后,Th2细胞随后在正反馈回路中产生其他IL-4。IL-4主要由肥大细胞,Th2细胞,嗜酸性粒细胞和嗜碱性粒细胞产生。它与白细胞介素13密切相关且具有相似的功能。
已经发现IL-4介导成年斑马鱼脑中的实验性阿尔茨海默氏病模型中神经干细胞与经历神经变性的神经元之间的串扰,并通过其细胞内效应子STAT6的磷酸化引发再生级联反应。
IL-4也已经显示,以驱动有丝分裂,分化和转移中横纹肌肉瘤。IL-4和其他Th2细胞因子一起参与过敏性哮喘患者肺部观察到的气道炎。
一、IL-4的功能
白介素4具有许多生物学作用,包括刺激活化的B细胞和T细胞 增殖,以及将B细胞分化为浆细胞。它是体液和适应性免疫的关键调节剂。IL-4诱导B细胞类别转换为IgE,并上调MHC II类产生。IL-4减少Th1细胞,巨噬细胞,IFN-γ和树突状细胞 IL-12的产生。
IL-4的过量生产与过敏有关。
炎症和伤口修复:组织巨噬细胞在慢性炎症和伤口修复中起重要作用。血管外组织中IL-4的存在促进巨噬细胞进入M2细胞的替代活化,并抑制巨噬细胞进入M1细胞的经典活化。修复巨噬细胞(M2)的增加与IL-10和TGF-β的分泌结合,导致病理性炎症减轻。活化的M2细胞释放精氨酸酶,脯氨酸,聚酰胺酶和TGF-β与伤口修复和纤维化有关。
二、IL-4的受体
白细胞介素4的受体称为IL-4Rα。该受体存在于全身3种不同的复合物中。1型受体由具有共同γ链的IL-4Rα亚基组成,并特异性结合IL-4。2型受体由与另一种称为IL-13Rα1的亚基结合的IL-4Rα亚基组成。这些2型受体具有结合IL-4和IL-13(两种具有密切相关的生物学功能的细胞因子)的能力。
IL-4和IL-13的受体系统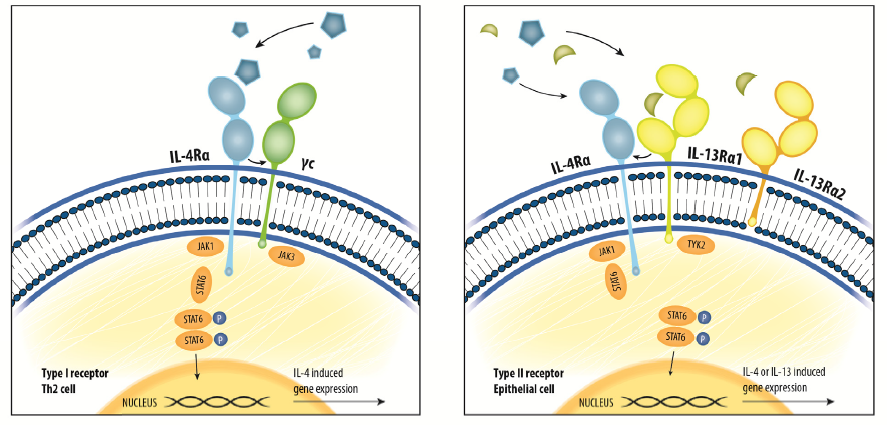
IL-4结合由IL-4Rα和普通细胞因子受体γ链(γc)组成的I型受体。IL-4和IL-13都结合II型受体复合物,其由IL-4Rα和IL-13Rα1组成。IL-13还以比IL-13Rα1高的亲和力结合IL-13Rα2。辅助受体链(例如γc,IL-13Rα1)在不同的特定细胞类型上表达。这些细胞因子IL-4和IL-13与它们各自的受体复合物的结合导致蛋白激酶JAK1或JAK3或Tyk2的活化,并随后使转录因子STAT6磷酸化。磷酸化的STAT6会二聚化并转运至细胞核,以激活IL-4-和IL-13诱导的基因转录(例如骨膜素)。
IL-4Rα信号通路的激活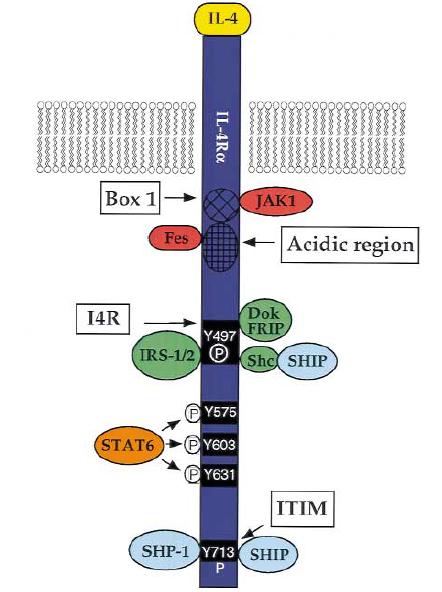
IL-4Rα包含负责启动和传输信号事件的信号域/基序。显示框1区域响应JAK1的缔合,而Fes结合需要相邻的酸性区域。Y497,位于I4R主题中,能够募集IRS-1 / IRS-2,FRIP(或Dok)和Shc。包含Y575,Y603和Y631的区域对于调节CD6的STAT6依赖性表达至关重要,并且似乎负责将STAT6靶向IL-4Rα。最后一个酪氨酸残基Y713由于在FcγRIIB中发现的序列相似性而位于指定的ITIM内,并且在体外结合试验中还被证明与SHP-1 / 2和SHIP相关。
IL-4激活的信号通路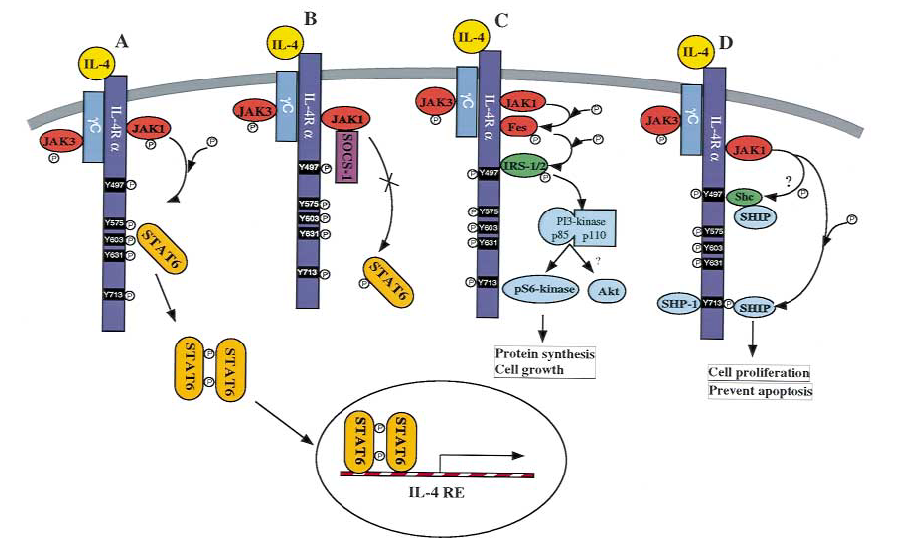
A.IL-4诱导的JAK1 / 3磷酸化,进而使IL-4Rα和STAT6磷酸化,后者靶向于包含Y575,Y603和Y631的域。然后,磷酸化的STAT6通过磷酸酪氨酸和SH2结构域的相互作用而形成二聚体。这使其可以进入细胞核并结合IL-4响应基因中的特定DNA序列。B.通过防止JAK1 / STAT6磷酸化并阻断IL-4诱导的基因表达,SOCS-1被证明是IL-4信号传导过程中JAK1 / STAT6的抑制剂 C.IL-4结合诱导JAK和Fes激酶的活化。Fes负责IRS-1 / 2的磷酸化。IRS-1 / 2的磷酸化通过与p85催化亚基相互作用来激活PI3激酶途径。活化的PI3激酶似乎可以调节pS6K途径,从而促进细胞生长所需的翻译过程。D.IL-4诱导的SHIP募集和磷酸化通过2个基序I4R和ITIM介导。I4R(Y497)可能与可以与SHIP的SH2域结合的Shc相互作用。ITIM(Y713)可以直接与SHIP交互。
I型和II型白介素(IL)-4受体成分和细胞分布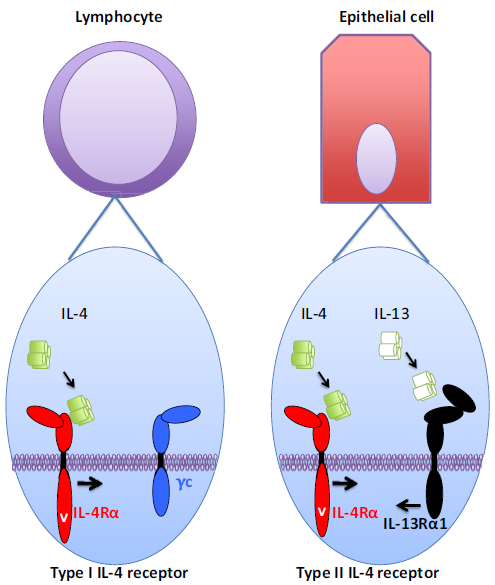
I型IL-4受体主要在造血细胞中表达,特别是在淋巴细胞(左部分)中很少或没有观察到II型受体的表达。在非造血细胞中,例如上皮细胞(右部分),几乎没有或没有观察到I型IL-4受体的表达。相反,II型IL-4受体很容易表达,随后这些细胞也对利用II型IL-4受体的IL-13产生反应,但将其“驱动”到与IL-4相反的方向。骨髓细胞(未显示)介于这两种细胞之间,因为它们同时表达I型和II型IL-4受体。
三、IL-4的来源与表达
1、体内IL-4和IL-13的细胞来源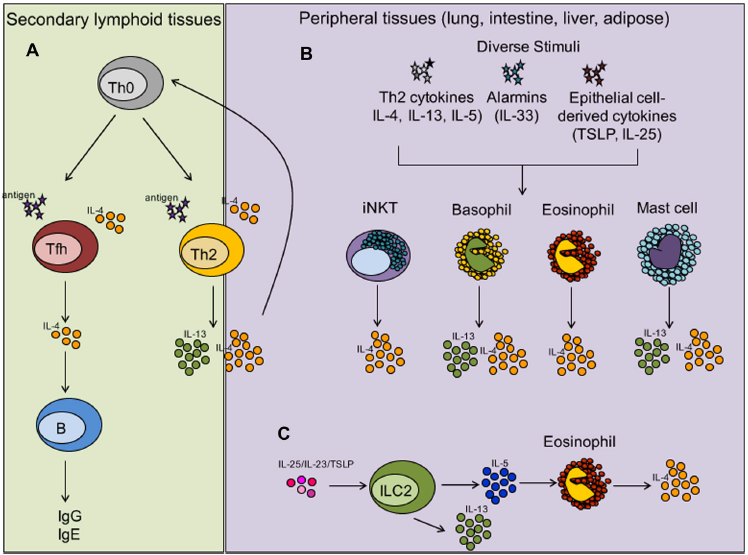
Tfh细胞在抗原中继发性淋巴器官中的激活(存在来自未知细胞的IL-4)诱导它们产生IL-4(a)。Tfh衍生的IL-4对于启动B细胞依赖性体液反应至关重要。在Th2免疫反应期间,在存在IL-4的情况下,抗原呈递细胞(主要是树突状细胞)在抗原呈递后,继发性淋巴器官和/或周围组织中的幼稚T辅助细胞将分化为Th2状态。这种依赖抗原的刺激负责分泌大量的IL-4和IL-13,从而将Th2细胞作为两种细胞因子的主要来源(a)。在周围组织中,多种与Th2相关的刺激包括IL-4,IL-13,IL-3,IL-5,IL-33和上皮细胞衍生的细胞因子(例如IL-25和TSLP)可以刺激iNKT细胞,嗜酸性粒细胞和小鼠嗜碱性粒细胞(据报道人类嗜碱性粒细胞也分泌IL-4(b)。IgE交联后或用IL-33刺激后,肥大细胞可分泌IL-4和IL-13(b)。ILC2细胞是IL-5(嗜酸性粒细胞引发和激活因子)的重要来源,IL-5有助于嗜酸性粒细胞衍生的IL-4分泌(c)。在用警报蛋白,尤其是用IL-33刺激后,ILC2细胞也是IL-13的主要来源(c)。总的来说,IL-4 / IL-13 Th2反应的诱导可调节过敏性免疫反应(包括粘液产生,平滑肌收缩和气道高反应性)并支持抗蠕虫免疫。
2、表达IL-4和IL-13的不同细胞亚群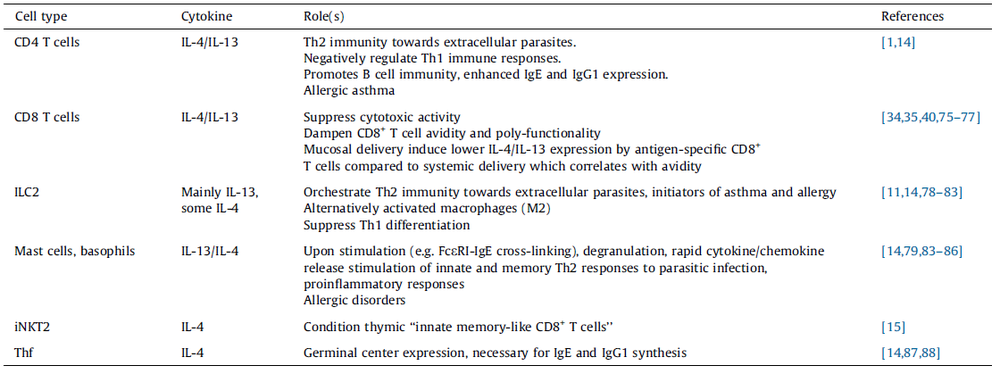
3、在IL-4介导的树突状细胞指令存在/不存在下的免疫应答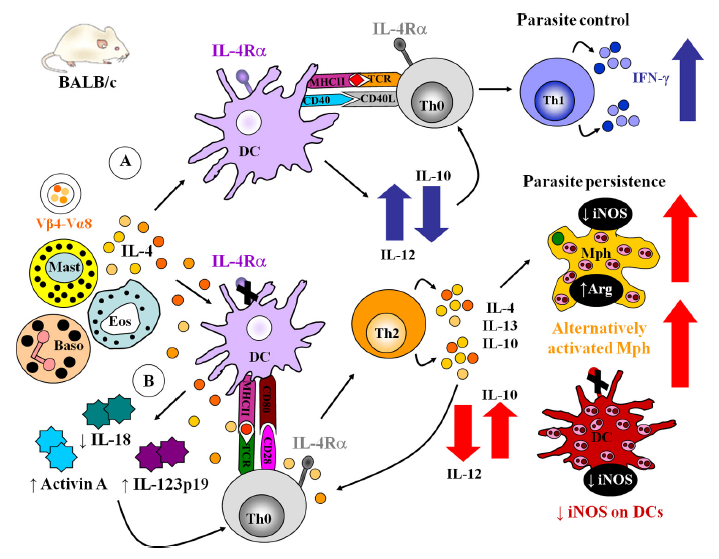
(A)在IL-4Rα充足的树突状细胞(DC)中,早期IL-4分泌指示DC衍生的IL-12产生,Th1分化和寄生虫控制。(B)在缺乏IL-4Rα的DC中,早期IL-4诱导Th2分化,DC降低IL-12 / IL-18,并增加Th2细胞因子,从而在交替激活的巨噬细胞(Mph)和DC中驱动精氨酸酶(Arg)的增加和iNOS的减少。
四、与IL-4相关的疾病
IL-4在某些免疫疾病(尤其是过敏症和某些自身免疫性疾病)的发生中起重要作用。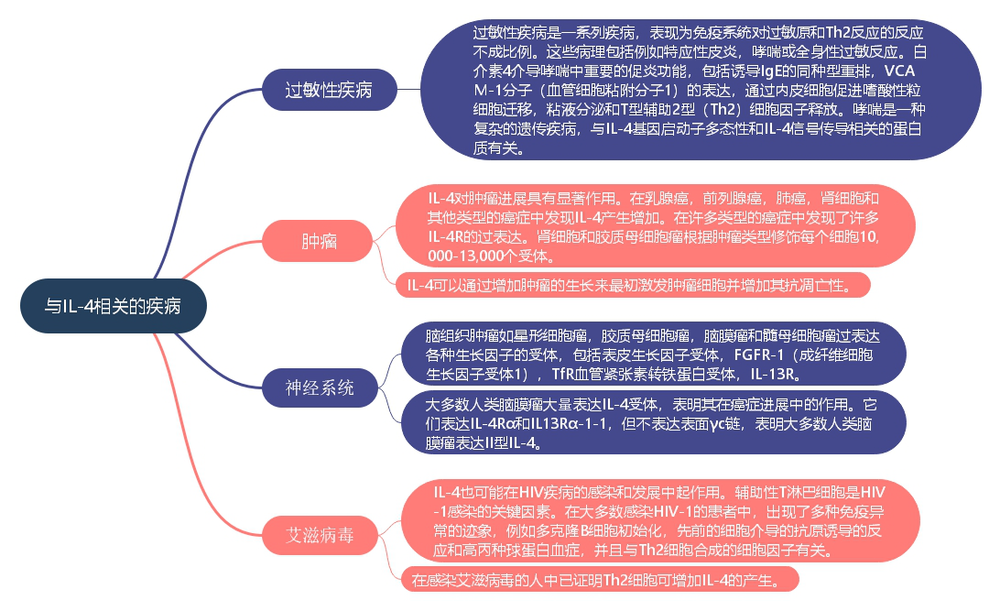
1、IL-4和IL-13在各种疾病中均具有独特但多效的功能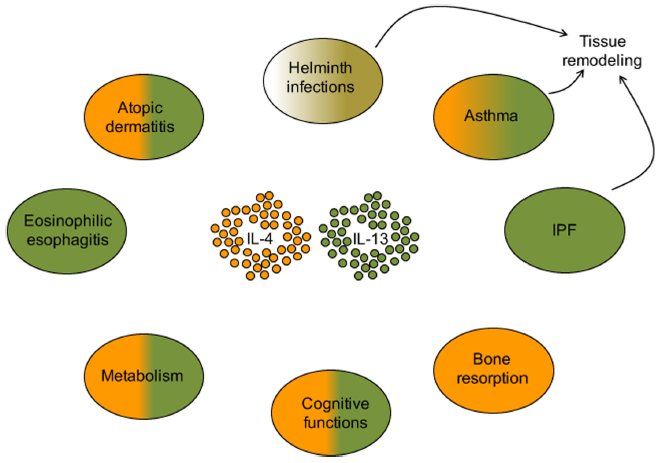
虽然蠕虫感染被认为是与Th2相关的标志性疾病,但Th1细胞因子参与早期感染事件已变得越来越明显。在哮喘中,IL-4负责引发过敏反应,IL-13负责导致组织重塑和纤维化的后期慢性事件。IL-13是嗜酸性食管炎的主要调节剂,也被认为是IPF中主要的促纤维化因子。相反,骨吸收的过程主要由IL-4调节,IL-4和IL-13都是特应性皮炎,脂肪组织稳态和葡萄糖代谢以及大脑认知功能(如学习和记忆)的关键调节剂。
2、IL-4与炎症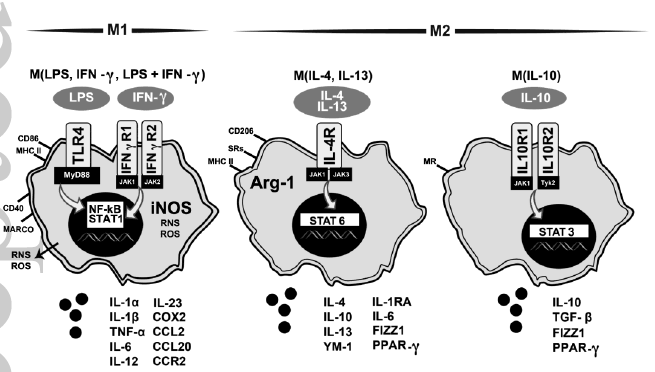
根据外周巨噬细胞命名法,小胶质细胞的M1和M2极化状态已被提出作为评估反应异质性的框架,而最近的评估表明,该框架着重于诱导刺激。在经典M1状态下,暴露于脂多糖(LPS)和/或干扰素γ(IFNγ)会刺激Toll样受体4(TLR4)或IFNγ受体1和2,分别导致转录因子NF-kB和STAT1激活并增加CD86和MHC II的表达。iNOS的增加会产生活性氧(ROS)和氮素(RNS)爆发,并释放促炎性细胞因子(IL-1α,IL-1β,TNF-α,IL-6,IL-12,IL -23),趋化因子(CCL2,CCL20,CCR2),MARCO,COX2。已根据各种刺激因素提出了M2状态。例如,在用白介素IL-4 / IL-13刺激后,IL-4受体(IL-4R)的结合会启动STAT6的激活,从而使细胞朝着具有Arg-1表达增加的抗炎表型转移CD206和甘露糖受体(MR)的释放,以及抗炎因子(IL-4,IL-6,IL-10,IL-13,IL-1RA,FIZZ1和PPARγ)的释放。通过刺激IL-10R1和IL-10R2激活STAT6,从而使细胞转变为一级免疫抑制状态,表达CD206,并释放IL-10,TGF-β,FIZZ1和PPARγ。
3、IL-4和IL-13对皮肤炎症的影响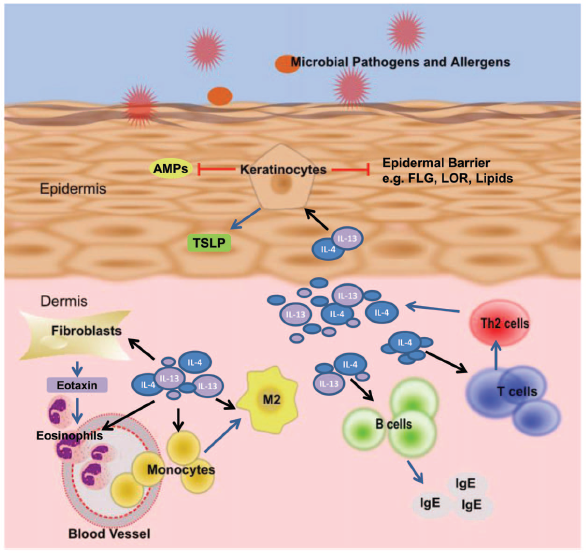
IL-4和IL-13以重叠和累加的方式作用于角质形成细胞,成纤维细胞,嗜酸性粒细胞,单核细胞和B细胞。主要差异是由于它们的表达水平以及受体表达的差异。由于缺乏IL-13受体的表达,T细胞仅能对IL-4做出反应,而对IL-13无反应。
4、IL-4与食物过敏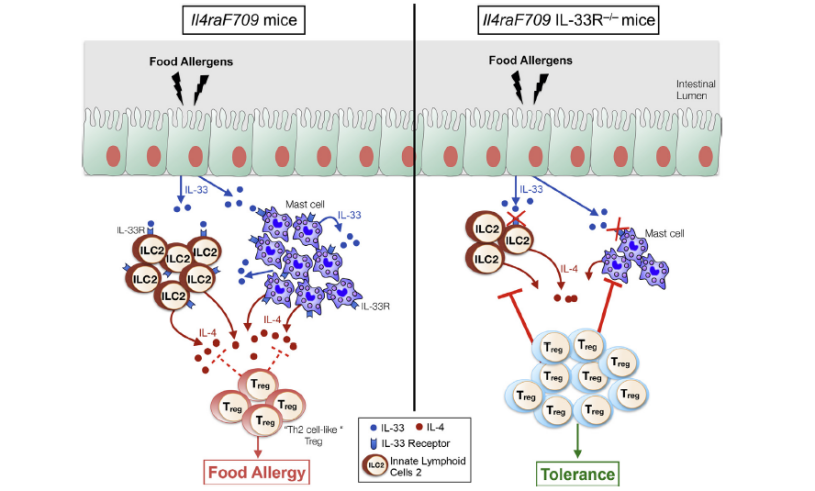
由IL-33刺激的ILC2s产生的IL-4阻断了过敏原特异性Treg细胞的产生,并有利于食物过敏。阻断ILC2激活或IL-33 / IL-33受体途径的策略可导致食品过敏治疗中的创新疗法。具有食物过敏的Il4raF709小鼠表现出ILC2数量增加。ILC2s分泌的IL-4可通过减少过敏原特异性Treg细胞并激活肥大细胞计数来促进过敏反应。Il4raF709 Il1rl12 / 2小鼠中的IL-33受体缺陷可防止变应原致敏和过敏反应,同时减少ILC2诱导。在Il4raF709 Il1rl12 / 2小鼠中,野生型和Il132 / 2但不是Il42 / 2 ILC2的过继转移恢复了敏化作用。Treg细胞可在体外和体内抑制ILC2。
5、严重哮喘,特应性皮炎和慢性鼻窦炎伴鼻息肉的2型炎症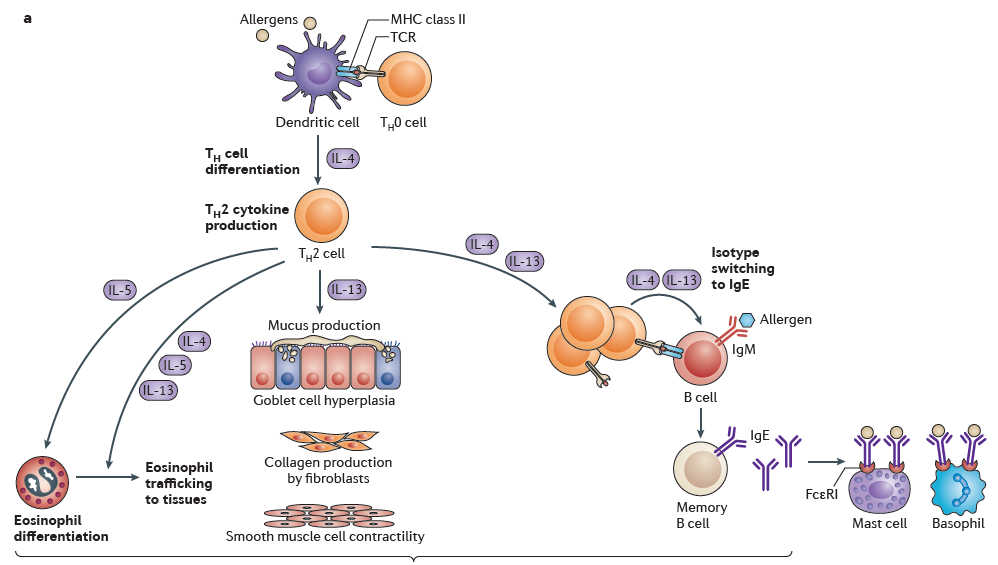
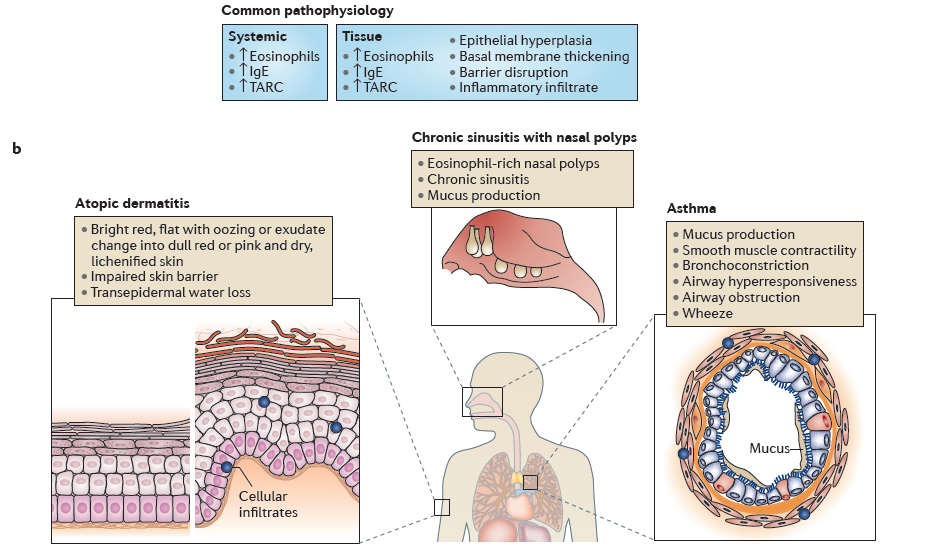
a. 2型细胞因子白介素-4(IL-4)促使T辅助(TH)细胞分化和克隆扩增为TH2细胞,并进一步产生IL-4,IL-5和IL-13细胞因子。2型途径激活的标志包括免疫球蛋白E(IgE)产生和嗜酸性粒细胞增多。特别是,IL-5主要驱动骨髓中嗜酸性粒细胞的分化,IL-4,IL-5和IL-13在组织特异性运输中起作用。IL-4和IL-13主要负责B细胞产生IgE的同种型转换。IL-13与组织作用有关,例如粘液分泌,平滑肌收缩和增生。b.常见的潜在病理性2型通路激活会根据受影响的组织导致不同的过敏性疾病。
6、IL-4与肿瘤
A.肿瘤细胞来源的IL-4诱导肿瘤排斥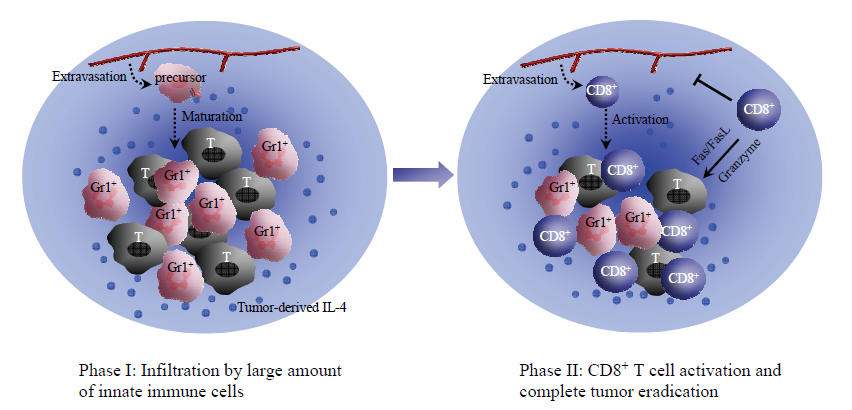
说明了基因修饰的肿瘤细胞(T)周围外源性IL-4浓度的可能梯度。IL-4诱导髓样前体细胞积聚并促进其成熟为Gr-1 +粒细胞。这些粒细胞直接抑制肿瘤细胞的扩增(第一阶段),而在高水平的外源性IL-4存在下被激活的CD8 + T细胞则是导致肿瘤完全排斥的原因(第二阶段)。IL-4直接或通过先天和后天免疫细胞抑制肿瘤诱导的血管生成。
B.内源性IL-4促进肿瘤生长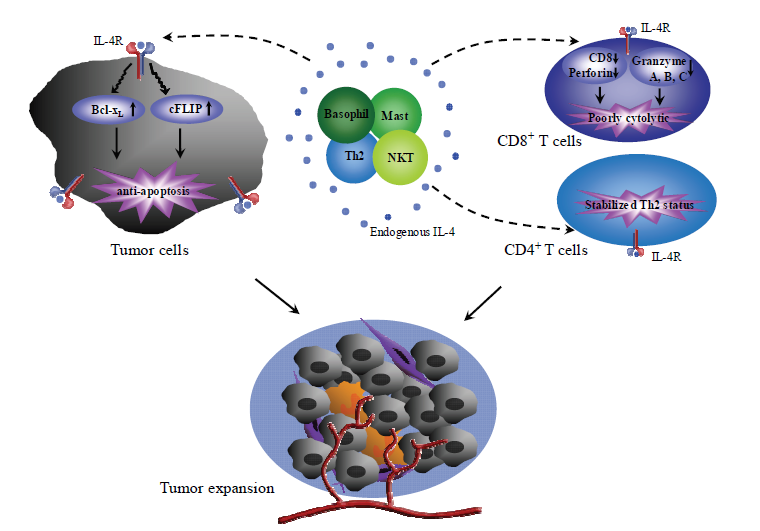
肿瘤部位内源性IL-4表达的时间和浓度几乎是未知的。许多宿主细胞,包括Th2细胞,嗜碱性粒细胞,肥大细胞和NKT细胞,都可以在适当的刺激下分泌IL-4。内源性IL-4作用于CD4 + T细胞,诱导并稳定其Th2状态。IL-4还下调CD8 + T细胞中CD8,穿孔素和颗粒酶A,B和C的表达,并使这些细胞具有较弱的细胞溶解表型。此外,肿瘤细胞通常具有增加的IL-4R表达。IL-4与其在肿瘤细胞上的受体的结合增加了抗凋亡分子(例如Bcl-xL和cFLIP)的水平。内源性IL-4的这些多重作用共同导致免疫偏离和肿瘤扩大。
7、哮喘免疫病理的机制和特征性病理特征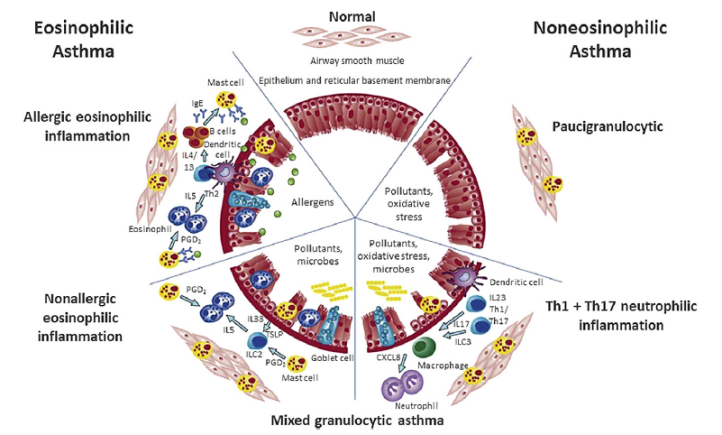
特征分为嗜酸性(过敏性和非过敏性),非嗜酸性(嗜中性1型和17型以及多核粒细胞性)和混合性粒细胞性炎症。
产品推荐:
Reference:
[1].Gandhi NA, Pirozzi G, Graham NMH. Commonality of the IL-4/IL-13 pathway in atopic diseases. Expert Rev Clin Immunol. 2017 May;13(5):425-437. doi: 10.1080/1744666X.2017.1298443. Epub 2017 Mar 15. PMID: 28277826.
[2].Hurdayal R, Brombacher F. The role of IL-4 and IL-13 in cutaneous Leishmaniasis. Immunol Lett. 2014 Oct;161(2):179-83. doi: 10.1016/j.imlet.2013.12.022. Epub 2014 Jan 8. PMID: 24412597.
[3].Hart PH, Bonder CS, Balogh J, Dickensheets HL, Donnelly RP, Finlay-Jones JJ. Differential responses of human monocytes and macrophages to IL-4 and IL-13. J Leukoc Biol. 1999 Oct;66(4):575-8. PMID: 10534111.
[4].Jiang H, Harris MB, Rothman P. IL-4/IL-13 signaling beyond JAK/STAT. J Allergy Clin Immunol. 2000 Jun;105(6 Pt 1):1063-70. doi: 10.1067/mai.2000.107604. PMID: 10856136.
[5].Gandhi NA, Bennett BL, Graham NM, Pirozzi G, Stahl N, Yancopoulos GD. Targeting key proximal drivers of type 2 inflammation in disease. Nat Rev Drug Discov. 2016 Jan;15(1):35-50. doi: 10.1038/nrd4624. Epub 2015 Oct 16. PMID: 26471366.
[6].Noval Rivas M, Burton OT, Oettgen HC, Chatila T. IL-4 production by group 2 innate lymphoid cells promotes food allergy by blocking regulatory T-cell function. J Allergy Clin Immunol. 2016 Sep;138(3):801-811.e9. doi: 10.1016/j.jaci.2016.02.030. Epub 2016 Apr 18. PMID: 27177780; PMCID: PMC5014699.
[7].Roesner LM, Zeitvogel J, Heratizadeh A. Common and different roles of IL-4 and IL-13 in skin allergy and clinical implications. Curr Opin Allergy Clin Immunol. 2019 Aug;19(4):319-327. doi: 10.1097/ACI.0000000000000553. PMID: 31157635.
[8].Ranasinghe C, Trivedi S, Wijesundara DK, Jackson RJ. IL-4 and IL-13 receptors: Roles in immunity and powerful vaccine adjuvants. Cytokine Growth Factor Rev. 2014 Aug;25(4):437-42. doi: 10.1016/j.cytogfr.2014.07.010. Epub 2014 Jul 23. PMID: 25159217.
[9].Junttila IS. Tuning the Cytokine Responses: An Update on Interleukin (IL)-4 and IL-13 Receptor Complexes. Front Immunol. 2018 Jun 7;9:888. doi: 10.3389/fimmu.2018.00888. PMID: 29930549; PMCID: PMC6001902.
[10].Orihuela R, McPherson CA, Harry GJ. Microglial M1/M2 polarization and metabolic states. Br J Pharmacol. 2016 Feb;173(4):649-65. doi: 10.1111/bph.13139. Epub 2015 May 11. PMID: 25800044; PMCID: PMC4742299.
[11].Ul-Haq Z, Naz S, Mesaik MA. Interleukin-4 receptor signaling and its binding mechanism: A therapeutic insight from inhibitors tool box. Cytokine Growth Factor Rev. 2016 Dec;32:3-15. doi: 10.1016/j.cytogfr.2016.04.002. Epub 2016 Apr 30. PMID: 27165851.
[12].Karo-Atar D, Bitton A, Benhar I, Munitz A. Therapeutic Targeting of the Interleukin-4/Interleukin-13 Signaling Pathway: In Allergy and Beyond. BioDrugs. 2018 Jun;32(3):201-220. doi: 10.1007/s40259-018-0280-7. PMID: 29736903.
[13].Jacysyn JF, Abrahamsohn IA, Macedo MS. IL-4 from Th2-type cells suppresses induction of delayed-type hypersensitivity elicited shortly after immunization. Immunol Cell Biol. 2003 Dec;81(6):424-30. doi: 10.1046/j.1440-1711.2003.01194.x. PMID: 14636239.
[14].Busse WW. Biological treatments for severe asthma: A major advance in asthma care. Allergol Int. 2019 Apr;68(2):158-166. doi: 10.1016/j.alit.2019.01.004. Epub 2019 Feb 18. PMID: 30792118.
[15].Wills-Karp M, Finkelman FD. Untangling the complex web of IL-4- and IL-13-mediated signaling pathways. Sci Signal. 2008 Dec 23;1(51):pe55. doi: 10.1126/scisignal.1.51.pe55. PMID: 19109238; PMCID: PMC4446705.
[16].Li Z, Chen L, Qin Z. Paradoxical roles of IL-4 in tumor immunity. Cell Mol Immunol. 2009 Dec;6(6):415-22. doi: 10.1038/cmi.2009.53. PMID: 20003817; PMCID: PMC4003035.
[17].Hallett MA, Venmar KT, Fingleton B. Cytokine stimulation of epithelial cancer cells: the similar and divergent functions of IL-4 and IL-13. Cancer Res. 2012 Dec 15;72(24):6338-43. doi: 10.1158/0008-5472.CAN-12-3544. Epub 2012 Dec 7. PMID: 23222300; PMCID: PMC3531868.










 危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)
危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)  营业执照(三证合一)
营业执照(三证合一)