(TNF-α)是一种涉及到系统性炎症的细胞因子,同时也是属于引起急相反应的众多细胞因子中的一员。主要由巨噬细胞分泌,不过有一些其它类型的细胞也能产生。

一、功能
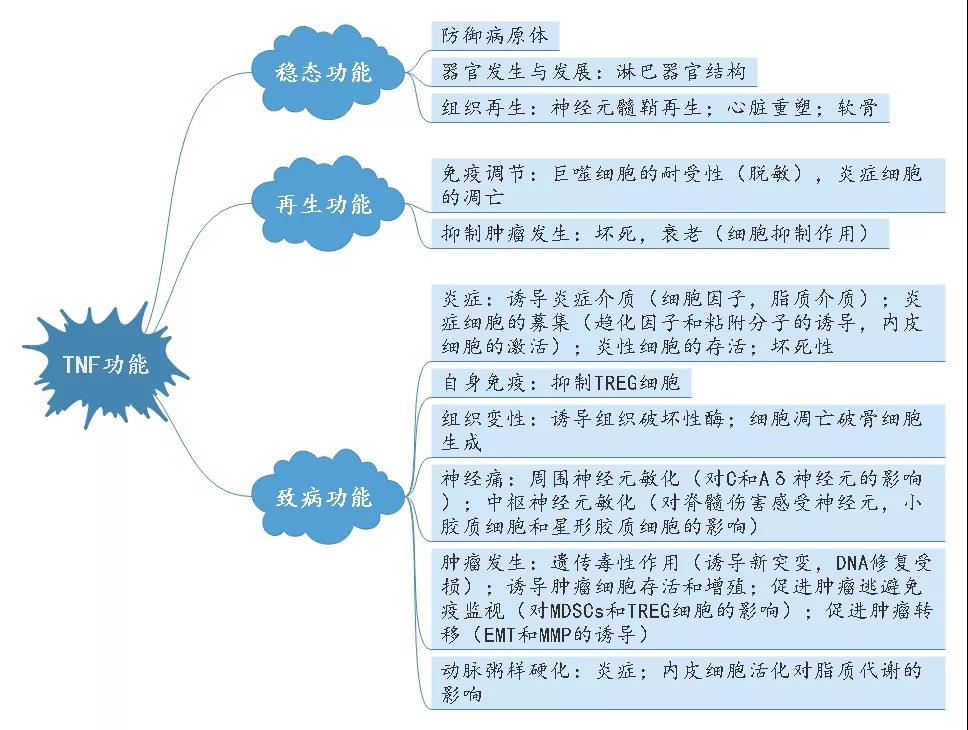
总括而言,肿瘤坏死因子-α能抑制不同种流感病毒的复制,拥有强大的抗病毒效果。肿瘤坏死因子α的主要作用是调节免疫细胞的功能。作为一种内源性致热原,它能够促使发热,引起细胞凋亡,(通过诱使产生IL-1和IL-6)引发败血症,引起恶病体质,引发炎症,阻止肿瘤发生和病毒复制。
肿瘤坏死因子α生产的失调被认为与许多人类疾病有关,包括阿兹海默氏症、癌症、重性抑郁障碍和肠炎。虽然仍有争议,不过当前的研究认为肿瘤坏死因子α的水平与抑郁和肠炎有关。
炎症过程中释放的TNF-α与H2O2诱导的BCa转化有关,伴血吸虫感染的BCa患者血清中TNF-α水平显著升高。由于TNF-α有助于BCa的形成和发展,故而可以作为评估BCa侵袭性和恶性程度的指标。
二、TNF-TNFR相互作用和信号传导的生物学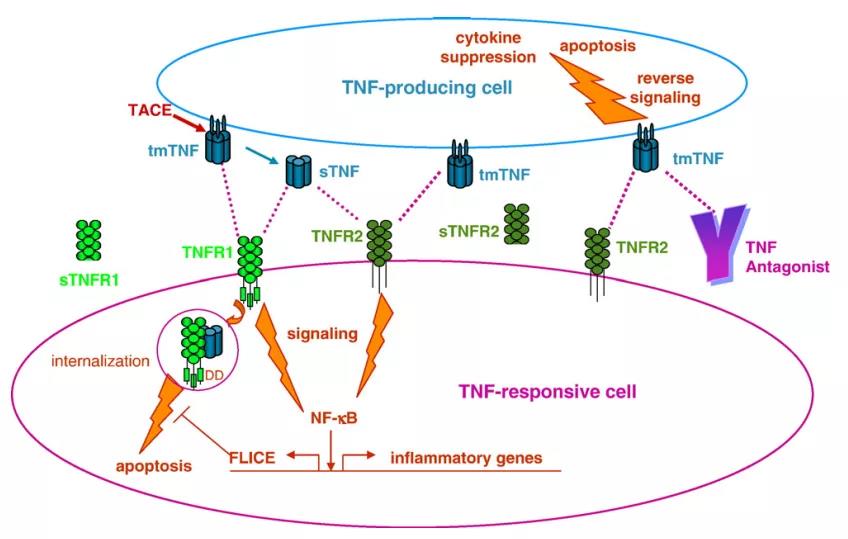
刺激产生TNF的细胞(上图)导致tmTNF三聚体的细胞表面表达和TACE酶促裂解以释放sTNF。tmTNF和sTNF均可与TNF反应性细胞(底部)上的细胞表面TNFR1或TNFR2结合,从而启动导致凋亡或NF-κB活化和炎性基因活化的信号传导途径。sTNF通过TNFR1诱导凋亡涉及内在的配体-受体复合物的内化以及TNFR1胞质尾部死亡域(DD)与衔接蛋白的结合,通常被FADD样IL-1β转化酶(FLICE)阻断。反向信号传导可通过TNFR2或TNF拮抗剂与细胞表面tmTNF结合而引发,从而导致细胞因子抑制或凋亡。酶促裂解后,可从TNF反应性细胞释放可溶性TNF受体(sTNFR1和sTNFR2)。
1、TNFR超家族
肿瘤坏死因子受体超家族(TNFRSF)是一种超家族蛋白质的细胞因子受体的特征在于有能力结合肿瘤坏死因子通过细胞外(TNFs)半胱氨酸富含结构域。大多数TNF受体含有跨膜结构域(TMD)。TNF受体主要参与细胞凋亡和炎症反应,但它们也可以参与其他信号转导途径,例如增殖,存活和分化。TNF受体在哺乳动物的各种组织中表达,尤其是在白细胞中。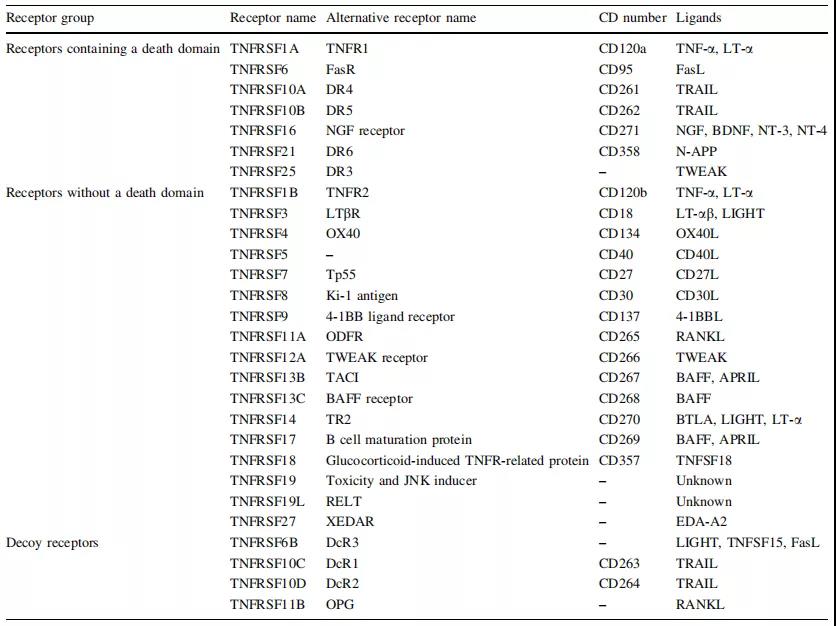
2、人肿瘤坏死因子(TNF)家族的配体与受体之间的相互作用:TNF配体(顶部)和TNF受体(底部)。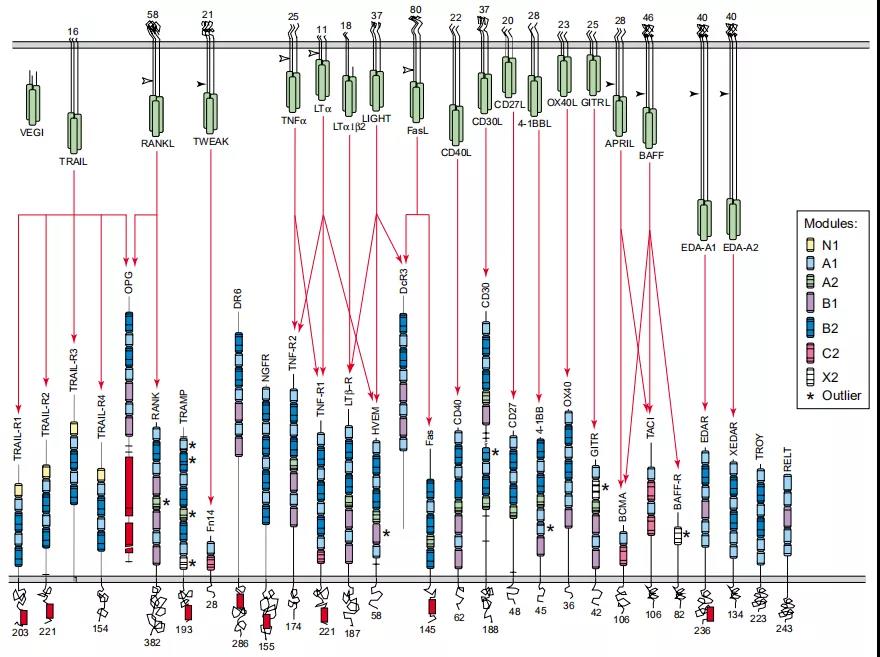
3、TNFR1信号通路
TNFa与TNFR1的结合导致形成膜相关的TNFR1蛋白信号复合物I改变的NF-jB诱导的基因表达或复合物I的不稳定会使细胞内信号复合物IIa和IIb的组装以及凋亡和坏死性细胞死亡的激活。
4、TNF-α的下游信号传导途径
TNF-α可以激活不同的途径来诱导凋亡,细胞存活或炎症。肿瘤坏死因子通过使caspase-8与FADD结合而诱导凋亡,并促进炎症和存活,这是通过TRAF2经由JNK依赖性激酶级联,MEKK激酶级联和RIP激活NF-kB介导的。
三、肿瘤坏死因子(TNF)在肿瘤微环境中的促肿瘤作用
肿瘤微环境中的恶性细胞,髓样细胞和可能其他细胞产生的TNF主要通过自分泌和旁分泌方式通过TNF受体1(TNFR1)发挥作用。已发表文献中记载的自分泌作用包括对恶性细胞或具有恶性潜能的细胞造成进一步的遗传损伤,增强恶性细胞存活率并诱导上皮-间质转化(eMT)。TNF还诱导进一步的TNF表达以及增加恶性细胞产生的其他细胞因子,趋化因子和C-X-C趋化因子受体4。细胞因子和趋化因子的这种组合也作用于肿瘤微环境中的髓样细胞,并由其产生,并可能有助于维持表型,并且肿瘤相关(M2)巨噬细胞的作用可能刺激细胞外基质(ecM)的重塑和导致髓样内皮祖细胞分化,促进血管生成。
TNF的这些作用以及与TNF相关的细胞因子和趋化因子也可能作用于淋巴细胞,这些淋巴细胞有助于局部免疫抑制,尽管这些数据更为初步。最终结果是增强原发性肿瘤生长,帮助促进转移扩散,并调节白细胞浸润和血管生成的程度和表型。TNF还涉及胸腔积液的产生和对化学疗法的抗性。这些作用机制已在多种不同癌症的异种移植,同基因,化学诱导和遗传模型中显示,并且可以在人类癌症活检组织和某些晚期癌症患者的血浆中检测到TNF。TNF的促肿瘤作用可能是肿瘤和组织特异性的。
四、TNF与细胞和疾病
1、涉及肿瘤坏死因子-α(TNF-α)的疾病和TNF-α抑制剂的临床用途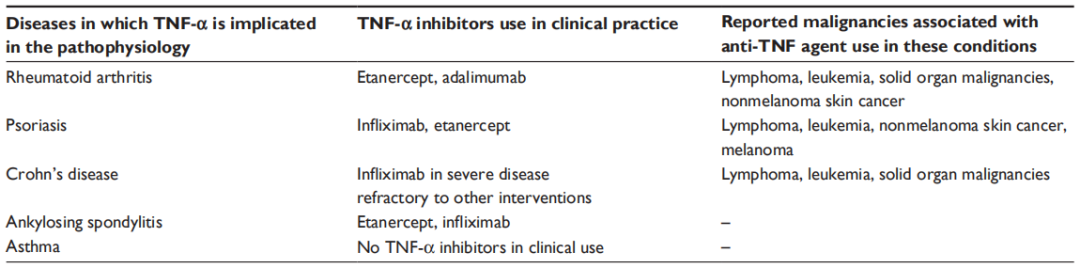
2、RA,克罗恩病和牛皮癣中的TNF
在RA,克罗恩病和牛皮癣的病理生理中,TNF是由多种细胞类型高浓度产生的,推测是由内源性或微生物刺激诱导的。这三种疾病共有的TNF介导的细胞反应的级联和网络显示在图中心的封闭区域中。在封闭区域之外显示了限制特定疾病的机制和细胞特征。
3、TNF对类风湿关节炎骨代谢的影响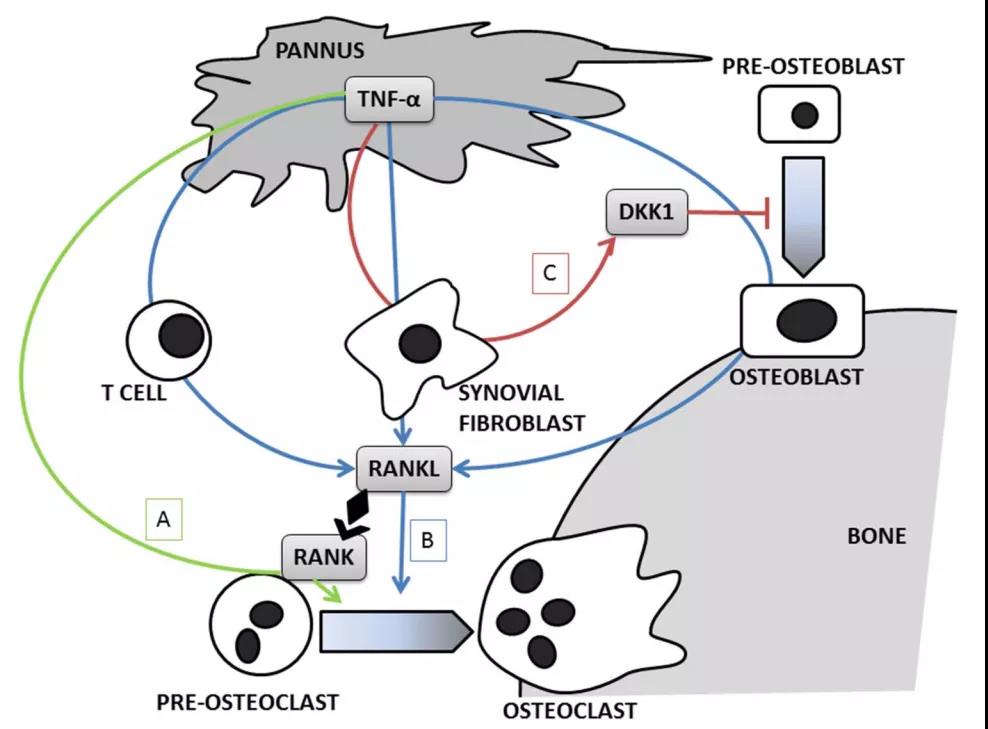
(A)TNF直接促进破骨细胞分化;(B)TNF刺激成骨细胞,成纤维细胞和T细胞产生RANKL,从而增强破骨细胞增殖;(C)TNF刺激滑膜成纤维细胞产生DKK-1,从而抑制成骨细胞增殖。
4、TNF在肠道炎症中的作用
肠粘膜内的炎症反应导致上皮层完整性丧失和通透性增加。上皮屏障的破坏使免疫细胞可以获取腔内物质,相关的危险相关分子模式(DAMP)和病原体相关分子模式(PAMP)。免疫系统的激活导致炎症反应和炎症细胞因子的产生,例如趋化因子,TNF和IFN。IFN和TNF导致紧密连接破坏,而TNF可能导致上皮细胞凋亡。相关的上皮屏障通透性增加进一步加剧了炎症过程并开始了粘性循环。当进展为慢性过程时,可能会发展为炎症性肠病。
5、肠上皮细胞中的TNF依赖性刺激可导致炎症,坏死,细胞凋亡和免疫抑制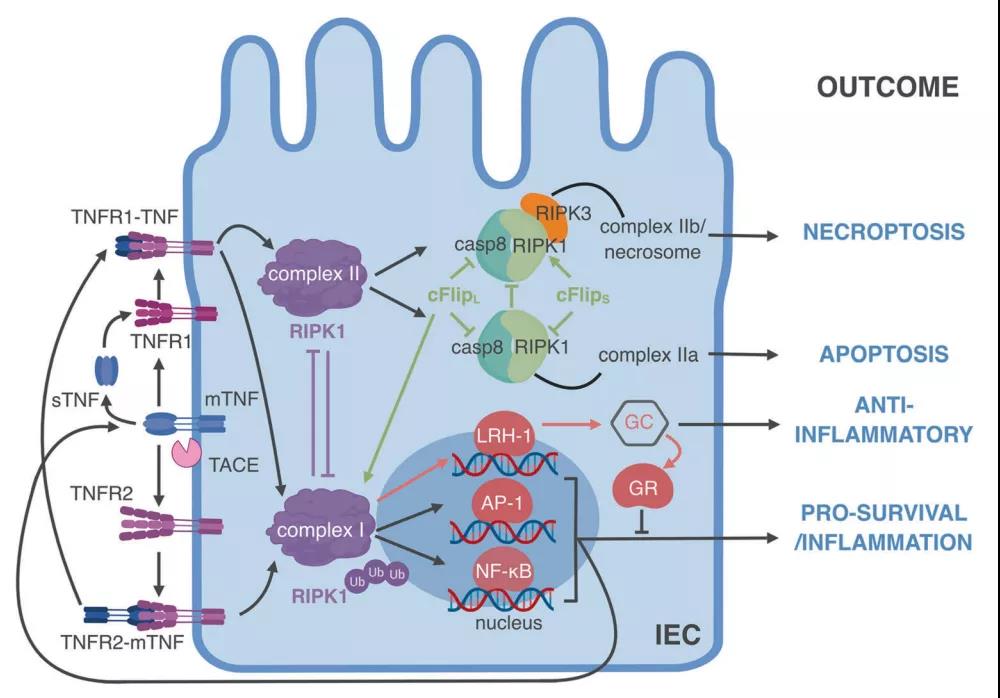
肠上皮细胞表达可被可溶性(sTNF)和膜TNF(mTNF)激活的TNFR1和TNFR2。根据细胞环境和RIPK1的泛素化状态,TNFR信号传导可能导致复合物I或II的形成。复合物I通过激活一系列转录因子(例如AP1或NF-κB)来促进细胞的存活应答,从而使细胞不易诱导细胞死亡。该过程主要通过上调一系列抗凋亡蛋白和促炎细胞因子而发生。激活AP-1和NF-κB进一步诱导TNF表达及相关的正反馈回路。相反,取决于cFLIP同工型,caspase-8活性和RIPK1活性的水平,复合物II的形成会促进细胞凋亡(复合体IIa)或坏死性(复合体IIb)细胞死亡。TNF可以触发LRH-1调节的信号传导途径,从而导致免疫调节糖皮质激素(GC)的合成。糖皮质激素受体(GR)的激活抑制TNF诱导的炎症并诱导免疫细胞凋亡。
6、TNF-α和神经性疼痛
在不同程度的神经系统中公认的TNF-α在神经损伤引起的神经性疼痛中的作用:(1)在神经损伤部位;(2)在背根神经节;(3)在脊髓背角;(4)在大脑和更高的中心。
7、TNF-α在胰岛素抵抗中作用的证据
8、TNF与类风湿关节炎
a.正常和类风湿关节的比较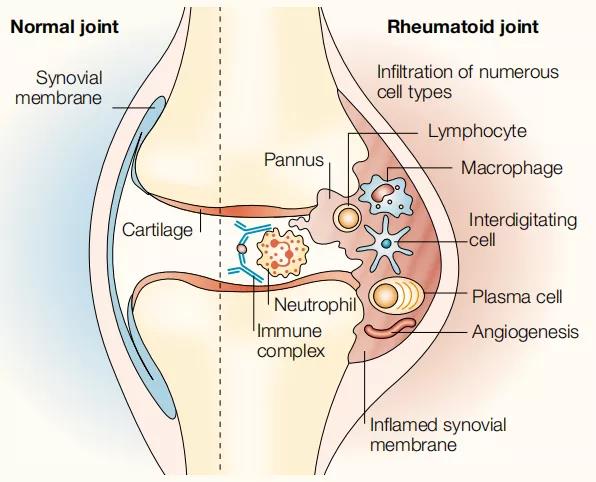
b.类风湿关节炎中的细胞因子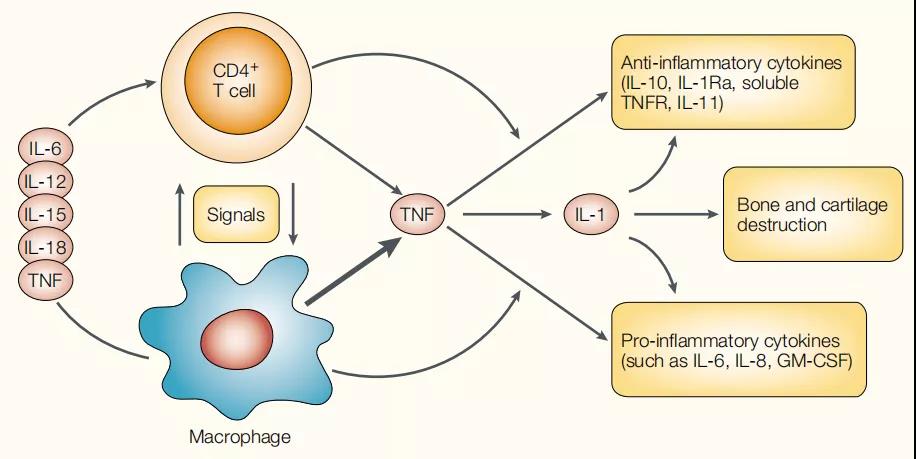
肿瘤坏死因子(TNF)依赖性细胞因子级联反应中某些细胞因子和细胞相互作用的示意图,以说明(TNF)在类风湿关节炎细胞因子网络中的关键作用。关键的相互作用细胞包括CD4 + T细胞和巨噬细胞,尽管它们之间的信号尚不完全清楚。
9、TNF-TNFR家族的相互作用调节了许多细胞类型,从而加剧了炎症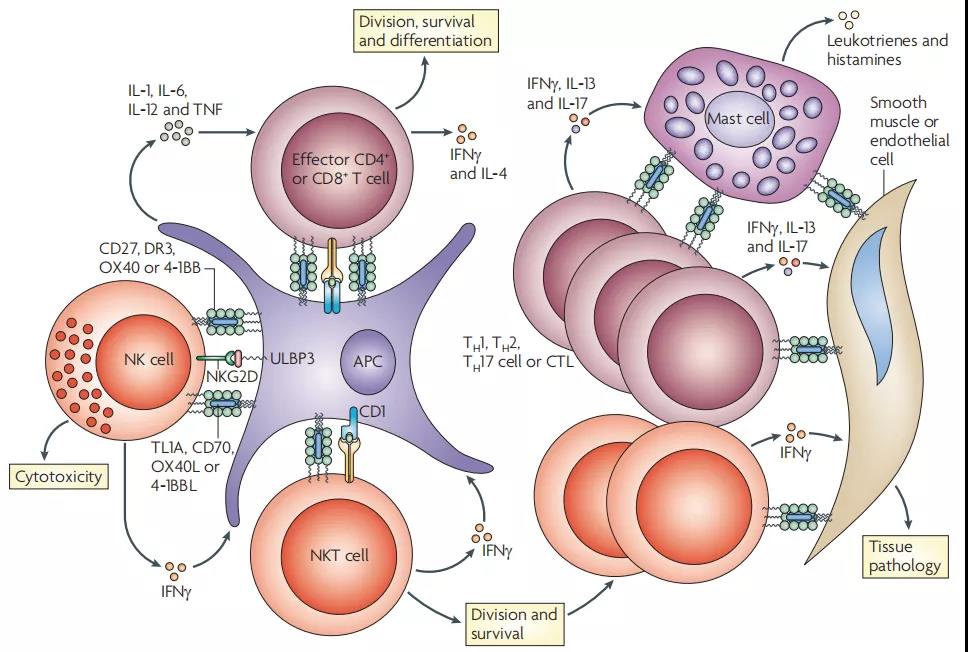
效应T细胞在其配体激活肿瘤坏死因子受体(TNFR)OX40、4-1BB,CD27和死亡受体3(DR3)后接收分裂,存活和细胞因子产生的信号。此外,自然杀伤(NK)和NKT细胞也可以通过TNFR接收信号,从而放大分裂,存活和细胞因子的产生。炎症反应的启动可能涉及NK和NKT细胞与效应T细胞之间的合作,这可能直接或间接通过抗原呈递细胞(APC)发生。反馈机制可通过NK细胞或NKT细胞来源的干扰素-γ(IFNγ)发生,该干扰素以多种方式增强APC激活,包括促进TNF配体的表达。此外,活化的肥大细胞可以表达许多配体,包括OX40配体(OX40L)和4-1BBL,它们可以共同刺激效应T细胞和NKT细胞。T细胞产生促炎细胞因子,例如IFNγ,IL-13和IL-17,也可以促进一种或几种TNF配体在组织细胞(如内皮,上皮和平滑肌)上的表达。通过与效应T细胞,NK细胞或NKT细胞的附加双向信号,这些相互作用可能通过例如诱导产生额外的促炎性介质如白三烯和组胺而进一步放大组织病理学。
10、TNF-TNFR相互作用调节TReg细胞的发育和功能
除了促进效应T细胞活化外,肿瘤坏死因子受体(TNFR)OX40、4-1BB,CD27和DR3及其配体之间的相互作用还可能通过影响自然发生或可诱导的调节性T细胞(TReg)进一步促成炎症。
迄今为止,虽然不同受体可以使用常见的信号传导途径(包括核因子-κB和蛋白激酶B途径)意味着,仅研究了OX40或4-1BB连接对TReg细胞发育和功能的影响,但DR3和CD27可能有类似的效果。OX40激活后触发的信号抑制幼稚CD4 + T细胞通过未知机制分化为TReg细胞的FOXP3和IL-10的表达,这可能涉及阻断或调节转化生长因子-β受体(TGFβR),IL-10R或维生素D受体下游的信号转导事件。OX40还可降低TReg细胞的稳定性,因为OX40的连接可导致最近分化的TReg细胞中FOXP3和IL-10表达的下调。这可以直接或间接地通过促进T辅助细胞产生细胞因子,这反过来诱导转录因子的表达,例如阻止FOXP3和/或IL-10表达的GATA结合蛋白3。完全分化的可诱导CD4 +和CD8 + TReg细胞以及天然CD4 + TReg细胞也表达OX40、4-1BB,CD27和DR3。OX40和4-1BB信号已显示出可直接通过对TReg细胞本身的作用来阻断这些细胞的抑制功能,或通过促进效应T细胞的增殖和存活并使其对TReg细胞具有抗性而间接地阻断这些细胞的抑制功能介导的抑制。
这些TNF-TNFR相互作用的联合作用可能导致效应T细胞与TReg细胞的比率增加(即太少的TReg细胞无法抑制炎症反应)或通过阻断TReg导致更大的效应T细胞活性细胞介导的抑制。TNFRs的活化也可能促进TReg细胞的扩增或存活,如在某些激动剂刺激的体外系统中,尽管对基因敲除动物的研究尚不支持这种扩增作为生理活性。
产品推荐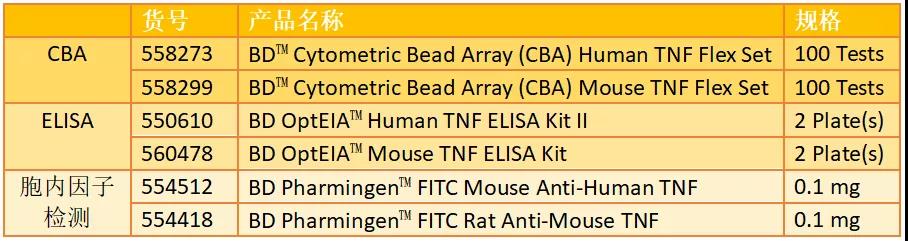
Reference:
[1].TNF biology, pathogenic mechanisms and emerging therapeutic strategies.
[2].TNF-α inhibitors: are they carcinogenic?
[3].TNF-a signalling and inflammation: interactions between old acquaintances.
[4].Bone and TNF in rheumatoid arthritis:clinical implications.
[5].The many faces of tumor necrosis factor signaling in the intestinal epithelium.
[6].Intracellular regulation of TNF activity in health and disease.
[7].TNF-α and neuropathic pain-a review.
[8].Mechanisms of Liver Injury.I. TNF--induced liver injury: role of IKK, JNK, and ROS pathways.
[9].Tumor necrosis factor antagonist mechanisms of action:A comprehensive review.
[10].TNF-a/NF-kB/Snail pathway in cancer cell migration and invasion.
[11].Tumour necrosis factor and cancer.
[12].The Role of TNF-α in Insulin Resistance.
[13].Development of anti-TNF therapy for rheumatoid arthritis.
[14].The role of TNF superfamily members in T-cell function and diseases.
[15].The molecular architecture of the TNF superfamily.










 危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)
危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)  营业执照(三证合一)
营业执照(三证合一)