近几年,公开发表文献中涉及类器官技术的文献数量呈现直线上升。此外,2017年《自然》杂志的子刊《Nature Methods》评价类器官为生命科学领域的年度技术;2019年6月7日 Organoids 登上了《科学》杂志的封面,而且本期为类器官特刊,类器官培养技术已经登录各大顶级期刊杂志。2021年年初,《关于对“十四五”国家重点研发计划6个重点专项2021年度项目申报指南征求意见的通知》中,并把“基于类器官的恶性肿瘤疾病模型”列为“十四五”国家重点研发计划中首批启动重点专项任务。
传统的2D细胞培养体系,平面培养、生长方式与机体内立体环境差别很大,导致细胞形态、增值分化、细胞与基质间以及细胞与细胞间的相互作用与体内生理条件下细胞的行为存在明显差异。不能模拟体内环境以提供生理相关的数据。3D类器官更能在结构和功能上模拟真实器官,克服2D培养短板。
3D类器官 定义:
通过在体外培养胚胎或成体干细胞,让其增殖分化形成具有一定形态结构及功能的类似于器官的3D细胞团结构。能在结构和功能上模拟真实器官,因此,把这些微型人造器官命名为:类器官(organoids)。

分类:
根据干细胞的不同来源, 类器官可简要分为三种类型。
(1)组织干细胞衍生的类器官;
(2)多能干细胞(包括ES胚胎干细胞和IPSC诱导多能干细胞)衍生的类器官;
(3)肿瘤干细胞衍生的类器官:
A. 类器官的培养方法可以运用于肿瘤组织的培养, 形成肿瘤组织来源的类器官,从而可以很好地保持肿瘤的特性;
B. 也可以将患者的肿瘤细胞经重编程为多能干细胞后诱导分化形成与原始肿瘤相同的肿瘤细胞, 再经体外3D培养形成类器官。
应用:
(1)疾病模型:从病人体内取病变组织体外培养成类器官与体内结构及功能类似。
(2)药效评估:2D 加入多少的药物就是有多少药物作用,3D类器官就是模拟体内药物渗透吸收的过程,更具真实性
(3)器官移植:由于人体排斥反应的存在,有些患者很难找到合适的配型,或因需长期服用免疫抑制药物导致并发症。类器官培养可能解决这一难题。
3D类器官培养
(1)类器官培养流程


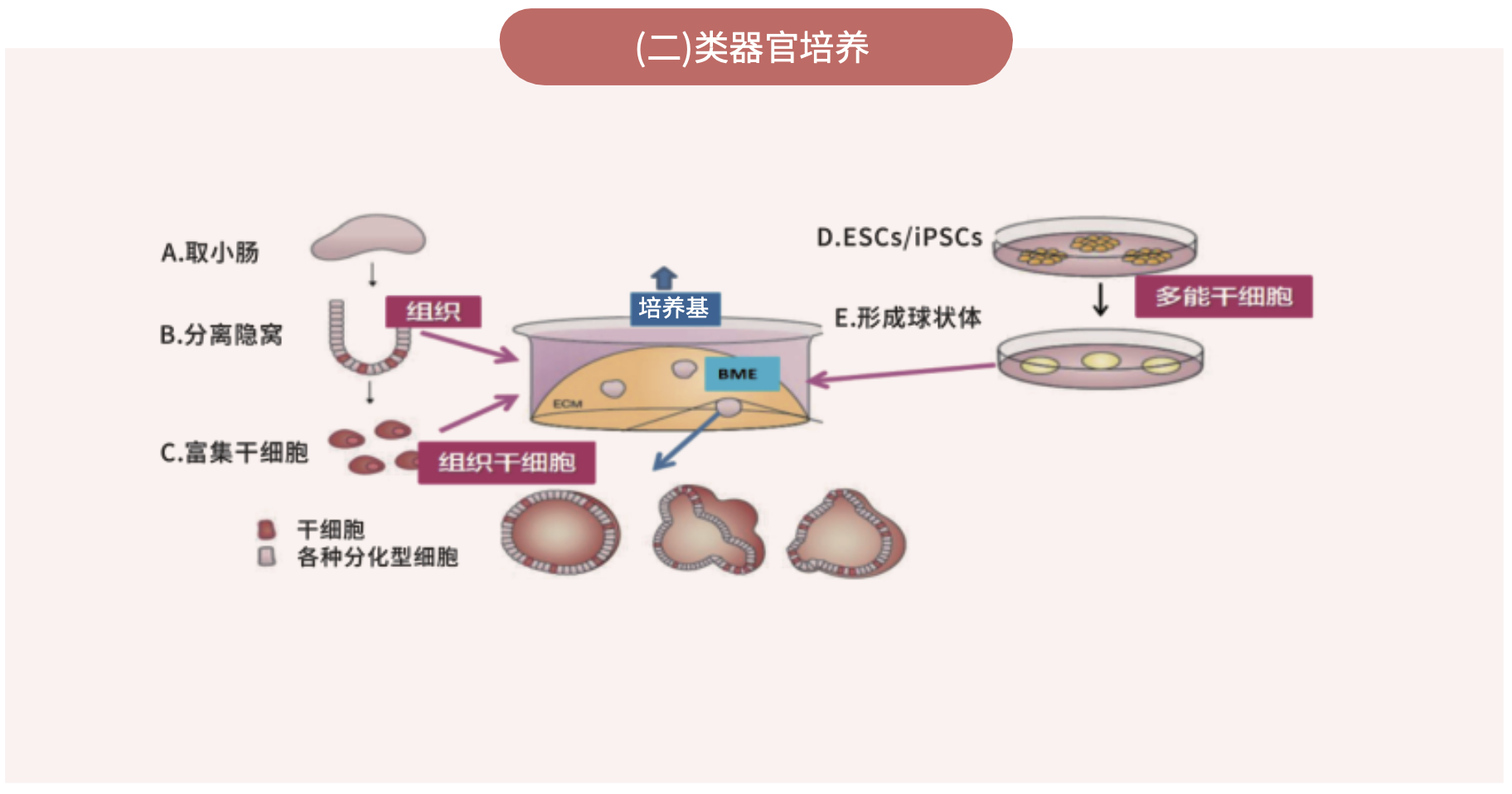
(2)培养方法

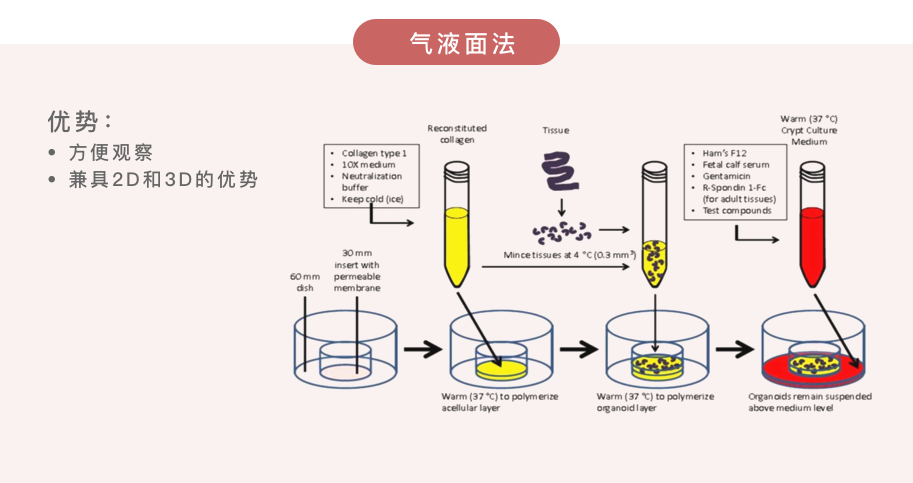
经典案例
肠类器官是2009年由Hans Clevers和他的博士后Sato培养出来的世界上第一个类器官。小肠类器官培养首先要获得肠干细胞,而利用LGR5做标志物可分离得到小肠干细胞。在这里,我们将分享Hans Clevers实验室长期培养肠类器官的实验流程。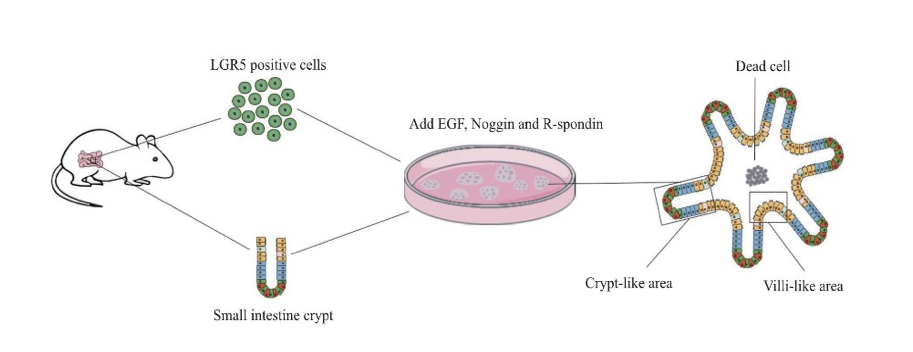
实验步骤:
(一) 组织标本的分离:
1. 取患者的部分回肠及结肠组织约3-5cm长度,放入预冷的PBS中;
2. 肠段从中间剪开,固定于泡沫板上,用镊子和眼科剪将粘膜下层和肌层分离开。用PBS清洗4-5次,用载玻片将小肠的绒毛刮去后,用剪刀将肠管剪成4-5段,放入盛有PBS的50 ml离心管中,置于冰上
(二) 人小肠类器官的培养:
以24孔板为例,以重悬隐窝基质胶混合物50μl来接板,接板后加入500μl隐窝培养基
3.将50ml离心管转移至生物安全柜中,用含有双抗的PBS清洗3-4次,将肠粘膜转移至25ml2mmol/LEDTA溶液中,后转移至4℃冰箱中,小肠消化30min,结肠消化1h;
4.将消化好的小肠粘膜转移至50ml离心管中,加25ml含双抗的PBS,用力地摇晃50下,悬浮液用70μm的细胞过滤筛过滤(去除绒毛和杂质)。1000r/min室温离心5min(结肠隐窝不需要过滤筛过滤);
5.弃上清,用2ml的DMEM/F12重悬沉淀,显微镜下观察计数,隐窝的数量8-10个/μl最好;
6.加适当体积的悬液加入到1.5ml的离心管中,1000r/min室温离心5min;
7.用事先在冰上预冷的基质胶混合物(基质胶与培养基为2:1配比)重悬沉淀;
8.接板,将24孔板事先在培养箱中预热,然后每孔接50μl的重悬液;9.将预热隐窝培养基加500μl/孔。37℃培养5-14天。
部分相关产品:
| 实验过程 | 产品分类 | 货号 | 产品名称 |
| 组织处理 | PBS | 17-516F | PBS |
| 消化 | 胰酶 | 17-161E | Trypsin |
| Dispase中性蛋白酶 | LS02100 | Neutral Protease (Dispase), Purified | |
| Collagenase4 | LS004186 | Collagenase, Type 4 | |
| Collagenase4 | abs47048003-100mg | 胶原酶 Ⅳ型 | |
| 细胞分离液 | 17544652 | Ficoll-Paque PREMIUM 1,073 6X100ML | |
| 细胞分离液 | abs9102 | Percoll | |
| 细胞分离液 | abs930 | Lymphocyte Separation Medium(human,Ficoll-Paque ) | |
| 过滤 | 40um 细胞筛网 | 352340-10 | 40um 筛网 |
| 70um 细胞筛网 | 352350-10 | 70um 筛网 | |
| 30um 细胞筛网 | 130-098-458 | MACS SmartStrainer, 30µM | |
| 70um 细胞筛网 | 130-098-462 | MACS SmartStrainer, 70µM | |
| 100um 细胞筛网 | 130-098-463 | MACS SmartStrainer, 100µM | |
| 基质胶 | 类器官培养,低生长因子,不含酚红,1ml | 3533-001-02 | Cultrex®RGF BME, Type 2 |
| 类器官培养,低生长因子,含酚红,5ml | 3533-005-02P | Cultrex®RGF BME, Type 2 | |
| 类器官培养,低生长因子,含酚红,10ml | 3533-010-02P | Cultrex®RGF BME, Type 2 | |
| 难生长型类器官培养,低生长因子,1ml | 3433-001-R1 | Cultrex®RGF BME, Type R1 | |
| 难生长型类器官培养,低生长因子,5ml | 3433-005-R1 | Cultrex®RGF BME, Type R1 | |
| 难生长型类器官培养,低生长因子,10ml | 3433-010-R1 | Cultrex®RGF BME, Type R1 |
(三) 类器官的传代:
10.在成熟类器官的24孔板中,每孔加入约500ul的DMEM/F12,用中枪头将孔中的基质胶小心的刮出,收集每个孔中的悬液置于15ml离心管中;
11.将可以传代的隐窝冰上放置5-10min;
12.用大枪头吹打将基质胶打碎,然后调制700ul量程,吹打30下左右,此过程避免产生气泡。可取适量的悬液观察,直至看不到大块的类器官团块为止;
13.其后步骤同【人小肠类器官培养步骤中④-⑦】⸺传代中,在刮出培养板基质胶以及在枪头吹打中尽量避免隐窝损失。若隐窝状态良好可进行1:3传代,若状态较差可进行1:1传代。
(四) 类器官的冻存:
14.将需要冻存的类器官冰上放置5-10min;
15.收集类器官,同【类器官传代步骤中的③】;
16.离心后弃上清,用800ul的冻存培养液重悬,将重悬液移至冻存管中,放入冻存盒中于-80℃冰箱中保存24h,如需长久保存,则24h后转移至液氮罐保存。
| 实验过程 | 产品分类 | 货号 | 产品名称 |
| 组织处理 | PBS | 4870-500 | 10X PBS |
| 抗生素 | V900929-100ML | 1%青霉素/链霉素 | |
| EDTA | 17-161F | Trypsin-Versene (EDTA) Mix (1X) | |
| 70um 细胞筛网 | 352350-10 | 70um 筛网 | |
| 130-098-462 | MACS SmartStrainer, 70 µM | ||
| 类器官 | 基础培养基 | 12-719Q | DMEM/F12 |
| 生长因子 | 236-EG | human EGF | |
| 4645-RS | human R-spondin1 | ||
| 5036-WN | human Wnt3a | ||
| 6057-NG | human Noggin | ||
| 小分子化合物 | 1254-1mg | Y-27632 | |
| 3006-1mg | Gastrin | ||
| 2939-10mg | A83-01 | ||
| 1264-10mg | SB202190 | ||
| 基质胶 | 3533-005-02 | Cultrex®RGF BME, Type 2 | |
| 基质胶收获液 | 3700-100-01 | Cultrex Organoid Harvesting Solution |
参考文献:
1. Montesano R, Schaller G, Orci L. Induction of epithelial tubular morphogenesis in vitro by fibroblast-derived soluble factors. Cell ; 66(4): 697-711
2. Sato T,Vries RG,Snippert HJ,et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche[ J].Nature,2009,459 ( 7244) : 262-265.
3. Mahe MM,Aihara E,Schumacher MA,et al. Establishment of Gastrointestinal Epithelial Organoids[J].Curr Protoc Mouse Biol,2013,3 ( 4) : 217-240.
4. Perreault N. & Jean-Francois, B. Use of the dissociating enzyme thermolysin to generate viable human normal intestinal epithelial cell cultures. Exp. Cell Res. 224,354‒364.
5. Evans, G. S., Flint, N., Somers, A. S., Eyden, B. & Potten, C. S. The development of a method for the preparation of rat intestinal epithelial cell primary cultures. J. Cell Sci. 101, 219‒231.
6. Whitehead, R. H., Demmler, K., Rockman, S. P. &Watson, N. K. Clonogenic growth of epithelial cells from normal colonic mucosa from both mice and humans. Gastroenterology 117, 858‒865.
更多类器官培养,关注优宁维,获取更多相关资源......
总结
2009年首个类器官问世后,类器官研究一直是研究热门领域,3D类器官培养不仅克服了2D培养不能模拟体内环境以提供生理相关的数据,而且还克服了动物模型耗时耗力短板。
为了更好帮助3D培养技术科研工作者,优宁维为您提供一站式服务,从技术资源,到产品,耗材等,让您科研不再难。留言更有一站式服务手册领取。











 危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)
危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)  营业执照(三证合一)
营业执照(三证合一)