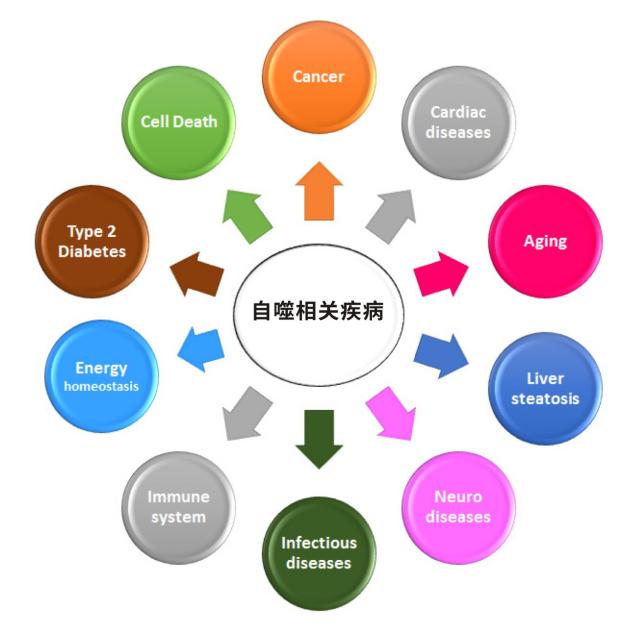
一、细胞自噬的介绍
autophagy又叫做Ⅱ型程序性细胞死亡,是指细胞利用溶酶体降解、选择性地清除自身受损、衰老或过剩的生物大分子和细胞器,释放出游离小分子供细胞回收利用的正常动态生命过程。自噬被认为是机体的一种自我保护机制。
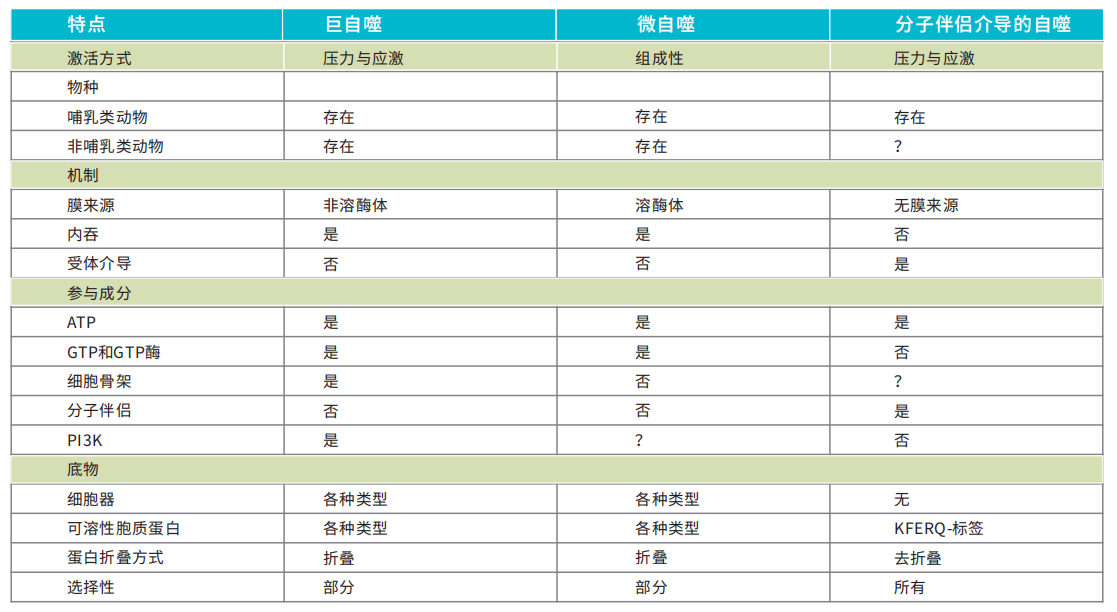
二、细胞自噬的三种形式

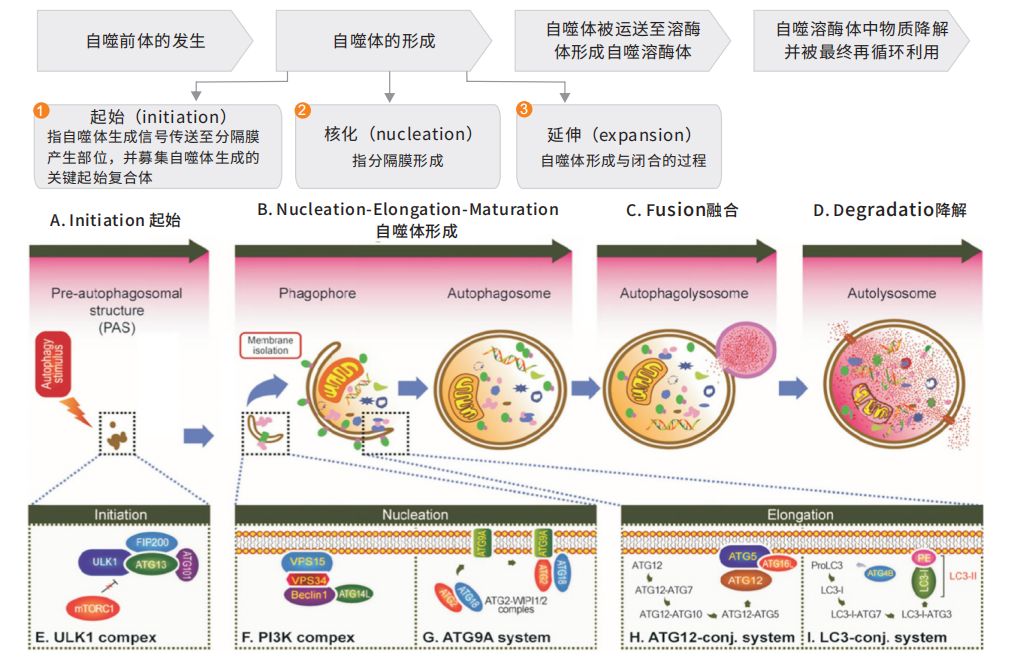
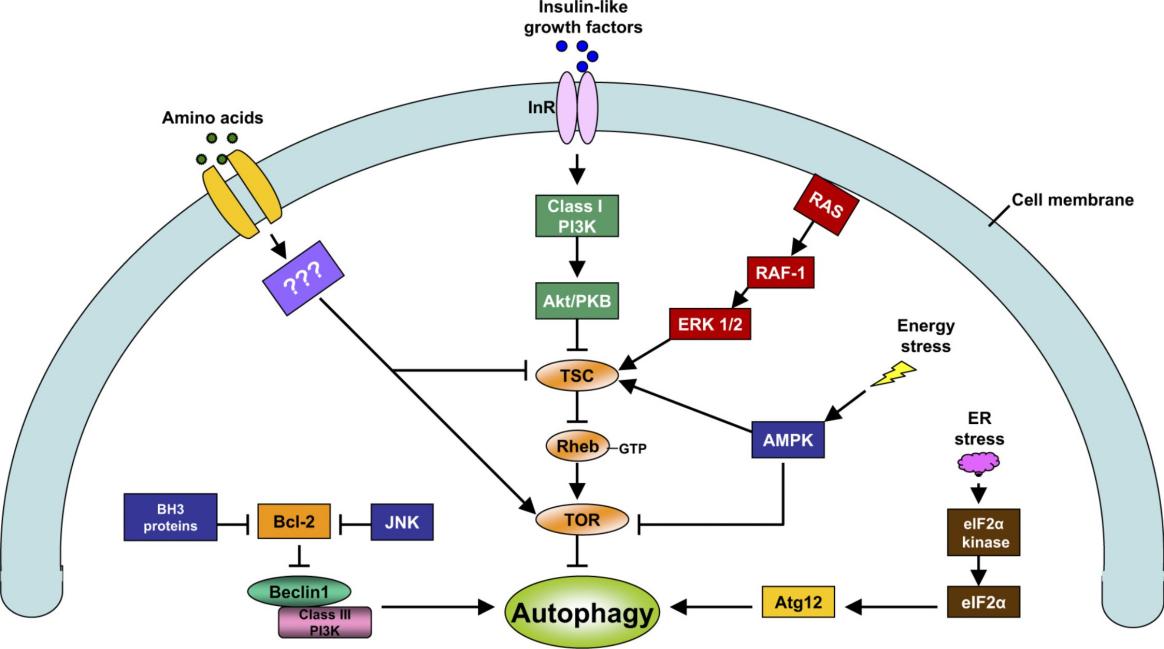
三 、细胞自噬信号通路图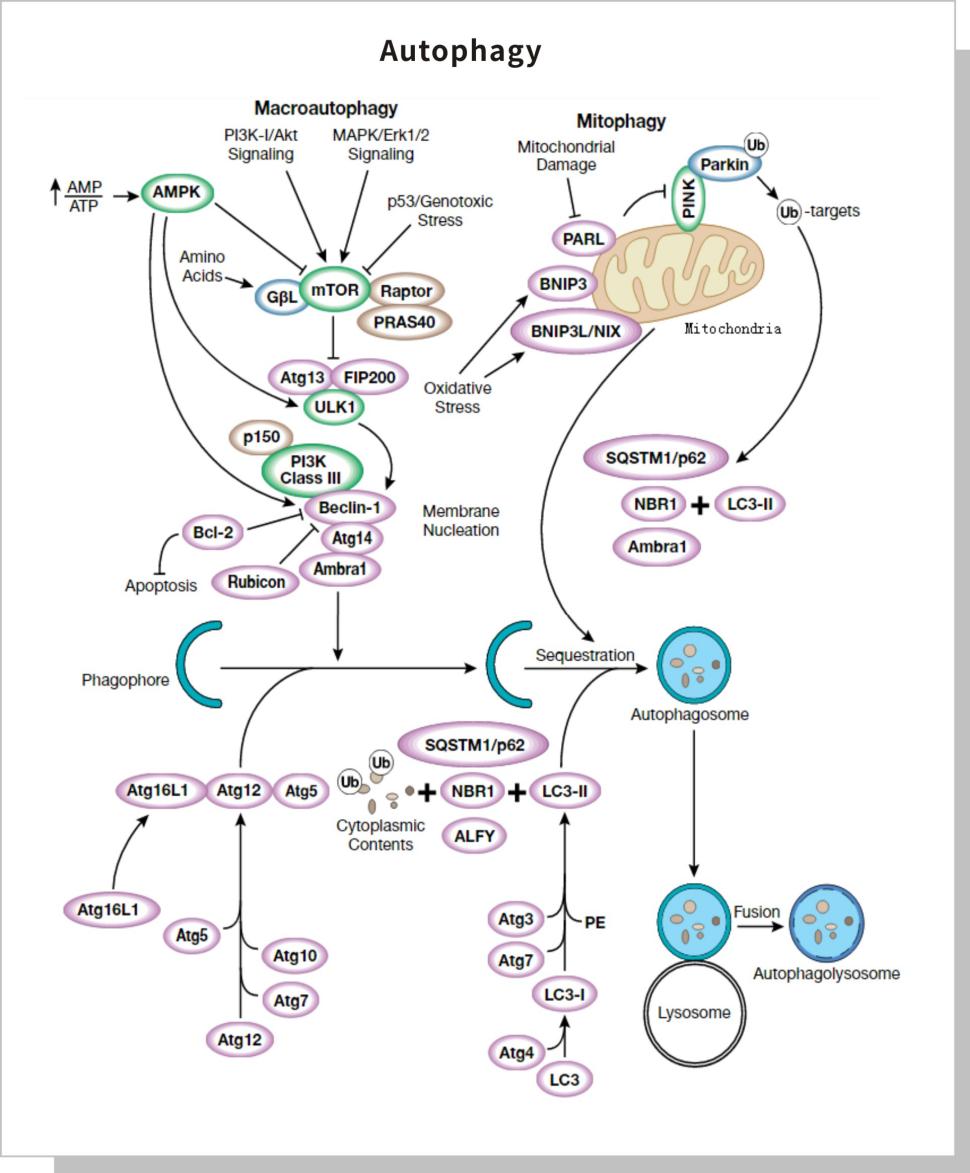
巨自噬,通常也称作自噬,是一种催化过程,导致细胞浆主要内容物的自噬性溶酶体降解、异常蛋白聚集和细胞器过剩或受损。营养不足的状态通常会激活自噬,但自噬也与许多生理和病理过程有关,比如发育、分化、神经退行性疾病、应激、感染以及癌症。mTOR 激酶是诱导自噬的重要调节分子,激活的 mTOR(Akt 和 MAPK 信号转导)可抑制自噬,而 mTOR(AMPK 和 p53 信号转导)的负性调节则促进自噬。三种相关的丝氨酸/苏氨酸激酶,UNC-51-激酶-1、-2 和 -3 (ULK1、ULK2、UKL3),与酵母 Atg1 具有同样的作用,可作为 mTOR 复合体的下游。ULK1、ULK2 与一种自噬相关 (Atg) 基因产物 (mAtg13) 的哺乳动物同源体,以及骨架蛋白FIP200 与酵母 Atg17 直接同源)共同形成一个较大的复合体。III 级 PI3K 复合体,包含 hVps34、 Beclin-1(酵母 Atg6的一种哺乳动物同源体)、 p150(酵母 Vps15的一种哺乳动物同 源体)以及 Atg14 样蛋白 (Atg14L 或 Barkor) 或抗紫外辐射相关基因(UVRAG),为诱导自噬 所必须。
线粒体自噬是一种选择性自噬过程,可特异性地从细胞移除受损或不需要的线粒体部分。PINK 蛋白在健康状态下通过 PARL 的作用持续降解,而在线粒体损伤时,PINK 稳定并招募 E3 连接酶 Parkin ,以启动自噬。线粒体膜蛋白通过 Parkin 的多聚泛素化作用导致自噬连接蛋白 SQSTM1/p62、NBR1 和 Ambra1 聚集,并通过 LC3-作用区域 (LIR) 结合到 LC3上。另外,BNIP3 和 BNIP3L/NIX 也含有 LIRs,可通过非泛素化机制直接聚集自噬机制因素,从而在某些细胞类型中诱导自噬体的形成。
细胞自噬相关抗体 细胞自噬相关化合物
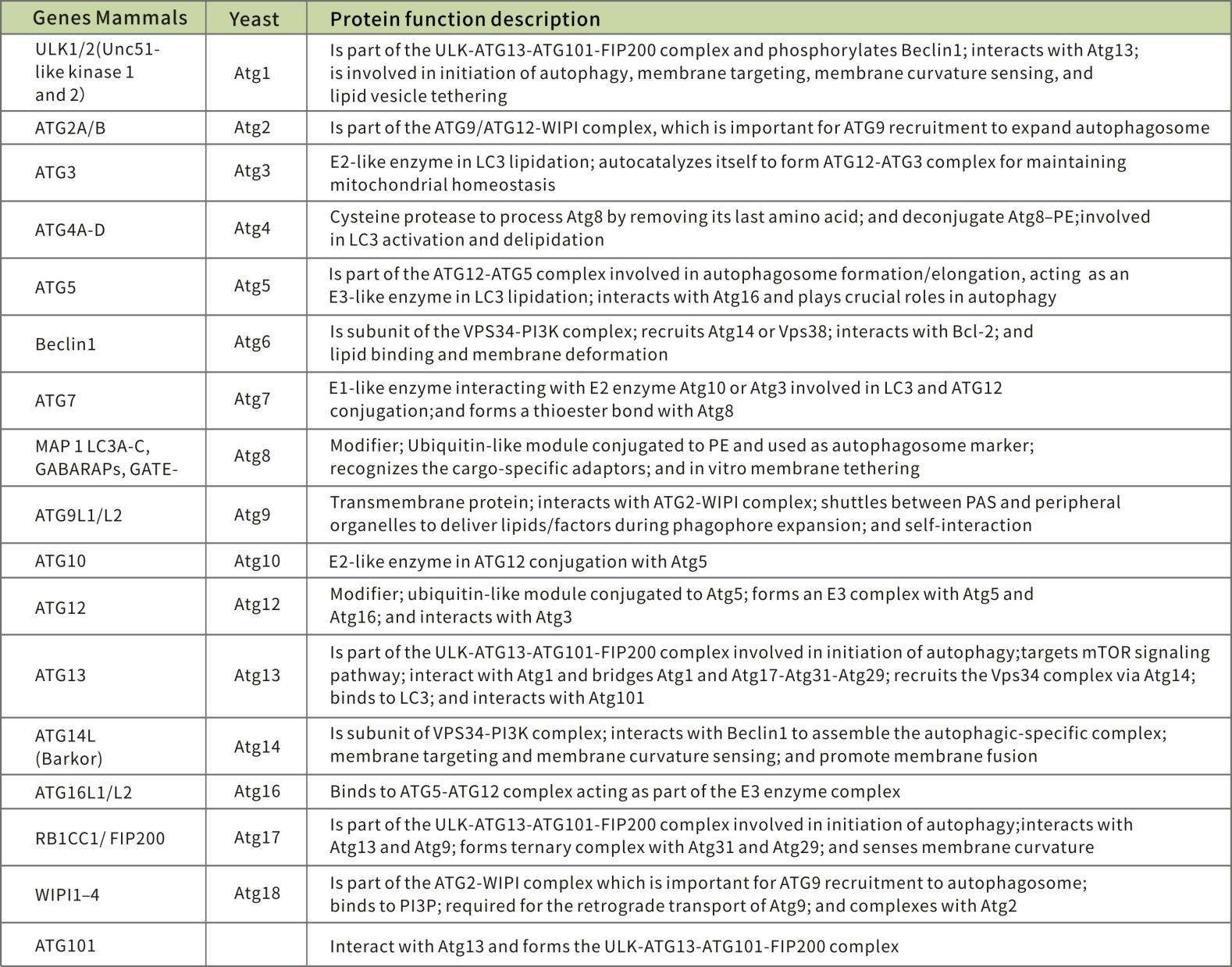
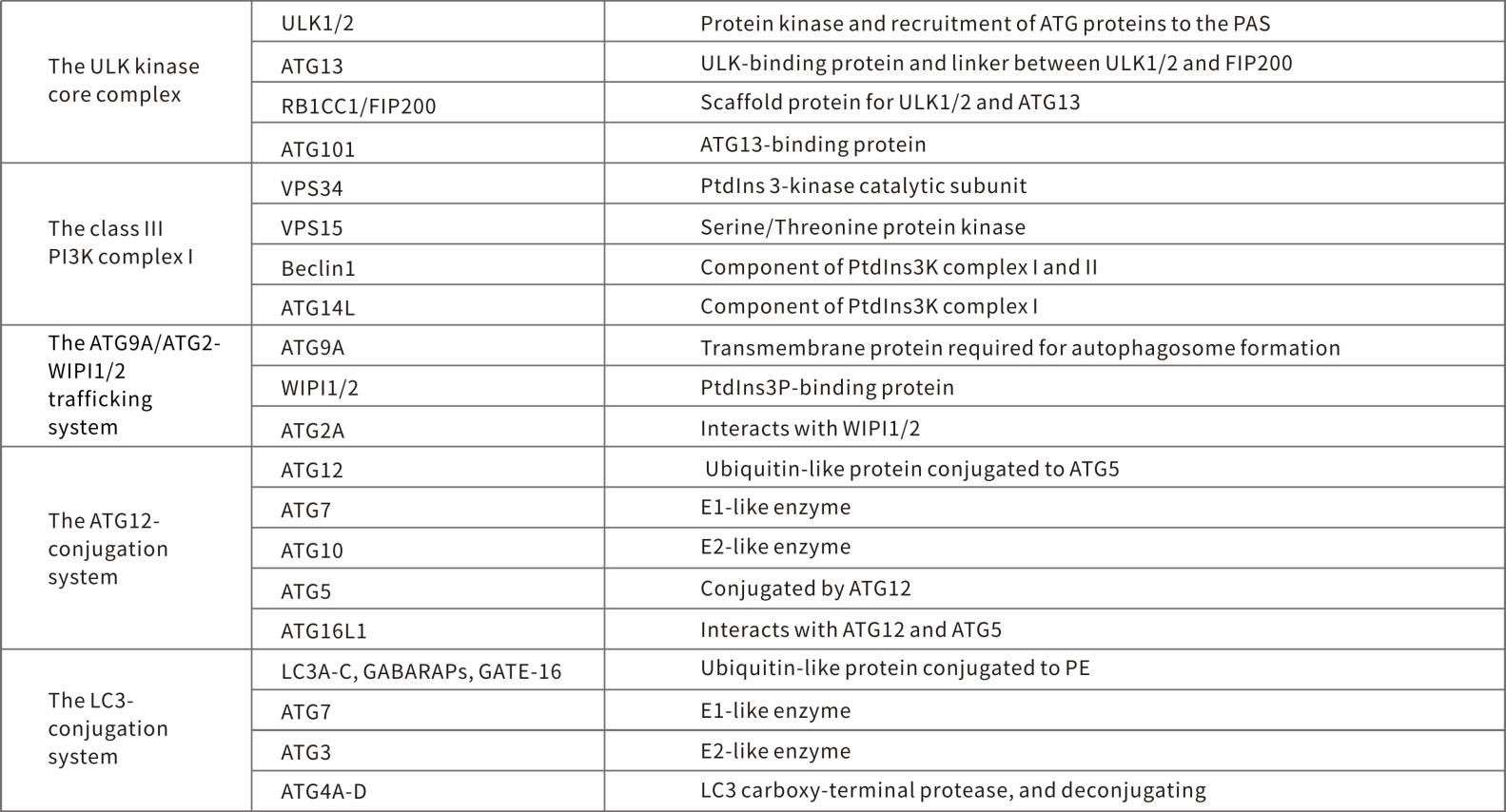
四、细胞自噬重要基因:Atg
Atg 基因通过 Atg12-Atg5 以及 LC3-II (Atg8-II) 复合体,控制自噬体的形成。Atg12 通过一个需要 Atg7 和 Atg10(分别对应 E1 和 E2 样酶)参与的泛素样反应,结合到 Atg5,Atg12-Atg5 接合后,与 Atg16 通过非共价相互作用形成一个大复合体。LC3/Atg8被Atg4 蛋白酶在羧基端剪切后产生胞质 LC3-I。LC3-I 也是通过一个需要 Atg7 和 Atg3(分别对应 E1 和 E2 样酶)参与的泛素样反应,结合到磷脂酰乙醇胺 (PE)。脂质化形式的 LC3,也称作 LC3-II,附着到自噬体的膜上。自噬与凋亡可以正向也可以负向连接,两种过程之间存在大量的交互作用。营养缺乏时,自噬功能可看作促生存的机制;然而,过度自噬可导致细胞死亡,这与凋亡的形态不一样。几种促凋亡信号,如 TNF、TRAIL 和 FADD 也可以诱导自噬。另外,Bcl-2 抑制 Beclin-1依赖性自噬,因此同时具备促生存和抗自噬调节分子的功能。
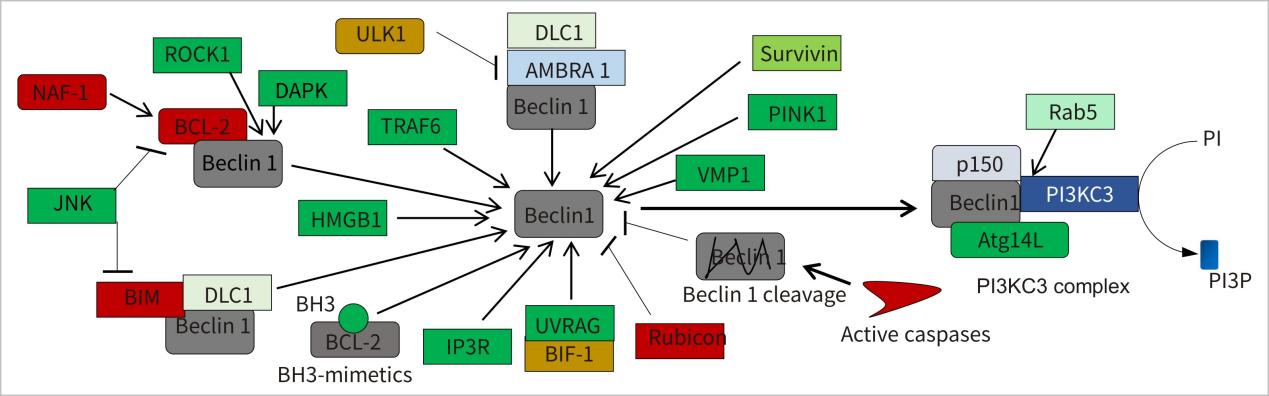
五、细胞自噬重要基因: Beclin-1/BCL-2
Bcl-2 和 Beclin-1 在细胞凋亡和自噬的过程中起着至关重要的调节作用。
Beclin 1是自噬关键调控蛋白之一,参与自噬体膜形成。大量研究结果指出, Beclin 1是caspase家族蛋白酶的全新底物,可被caspase剪切。剪切后的Beclin 1失去自噬调节功能,转而加剧凋亡进程。因而,Beclin 1对细胞凋亡和自噬起着重要的调控作用。
Beclin-1 最初被认为可以和 Bcl-2 家族相互作用的蛋白质,其引发自噬的作用可以被 Bcl-2 和 Bcl-XL 所抑 制。JNK1 使 Bcl-2 磷酸化,结果导致 Bcl-2 与 Beclin-1 分离诱导自噬的发生。但在长期的饥饿中,细胞不能靠启动自噬提营养物质再循环的方式促进细胞存活,同时磷酸化的 Bcl-2不能与凋亡蛋白 Bax 相互作用,从而导致细胞凋亡的发生。
只有当 Bcl-2 位于内质网中,才能抑制自噬。 Beclin-1 有 一个 BH3-only 家 族 蛋白 结 合域,Bcl-2 家族 中 BH3-only 蛋白都可以与之结合,导致 Beclin-1 不能诱导细胞自噬。Beclin-1 的 BH3 结构域的 119 位苏氨酸残基上有一个磷酸 化位点,当 Beclin-1 磷酸化后,与 Bcl-2 的结合能力下调。凋亡相关蛋白激酶(Death-Associated Protein Kinase, DAPK)将 Beclin-1 磷酸化后,使其与 Bcl-2 解离,进而启动自噬。在某些情 况下,DAPK 可以通过与细胞骨架作用,诱导凋亡小体的产生,从而促进细胞凋亡。
在生长因子缺乏等条件下,自噬会先于凋亡发生,自噬的活化可以拮抗细胞凋亡。细胞凋亡发生后,caspase-3 的活化可以水解 Beclin-1,抑制自噬从而促进凋亡。Beclin-1 产生的N 末端片段和 C 末端片段会转移到线粒体和细胞核内。C 末端 片段会导致线粒体释放细胞色素 c 以及其他促凋亡蛋白,诱导细胞凋亡进一步发生,N 末端片段的核转位的作用目前还没有阐明。因此,caspase-3 水解产生的 Beclin-1 的片段会促进细胞凋亡。
Beclin-1/BCL-2相关抗体 Beclin-1/BCL-2相关化合物
六、mTOR是细胞自噬的核心
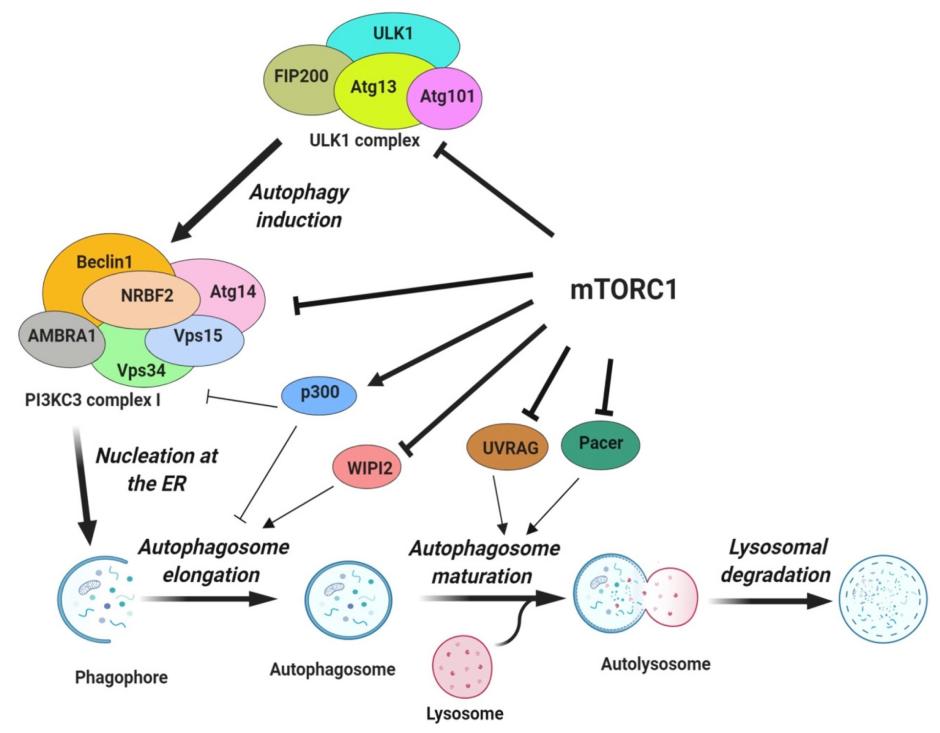
mTOR信号通路是调控细胞生长与增殖的一个 关键通路, 该通路将营养、能量状态及生长因子信号整合在一起, 并作为主要的调控因子参与细胞自 噬过程。mTOR有两种不同的复合体, 即mTORC1和mTORC2。
mTORC1 通过磷酸化使形成的自噬调节复合物 (由 ULK1 和其互作蛋白 Atg13、FIP200、Atg101 等形成) 失活,从而影响自噬小体的生物发生。在营养丰富的条件下,mTORC1 通过介导 ULK1 (Ser637 和 Ser757) 和 Atg13 (Ser258) 特定位点磷酸化,抑制 ULK1 复合物的自噬促进激酶 (Autophagy-promoting kinase) 活性。
在饥饿和细胞应激期间,mTORC1 活性被抑制,于是与 ULK1 分离。因此,ULK1 和 Atg13 的特定位点的磷酸化被解除。同时,ULK1 复合物通过 Thr180 处自磷酸化而变得活跃,并磷酸化 Atg13、FIP200、Atg101 和其他 Atg 蛋白。活跃的 ULK1 复合物随后转移到内质网的隔离膜上,自噬启动。
mTOR相关检测抗体 mTOR相关化合物
七、细胞自噬中的AMPK通路与P53
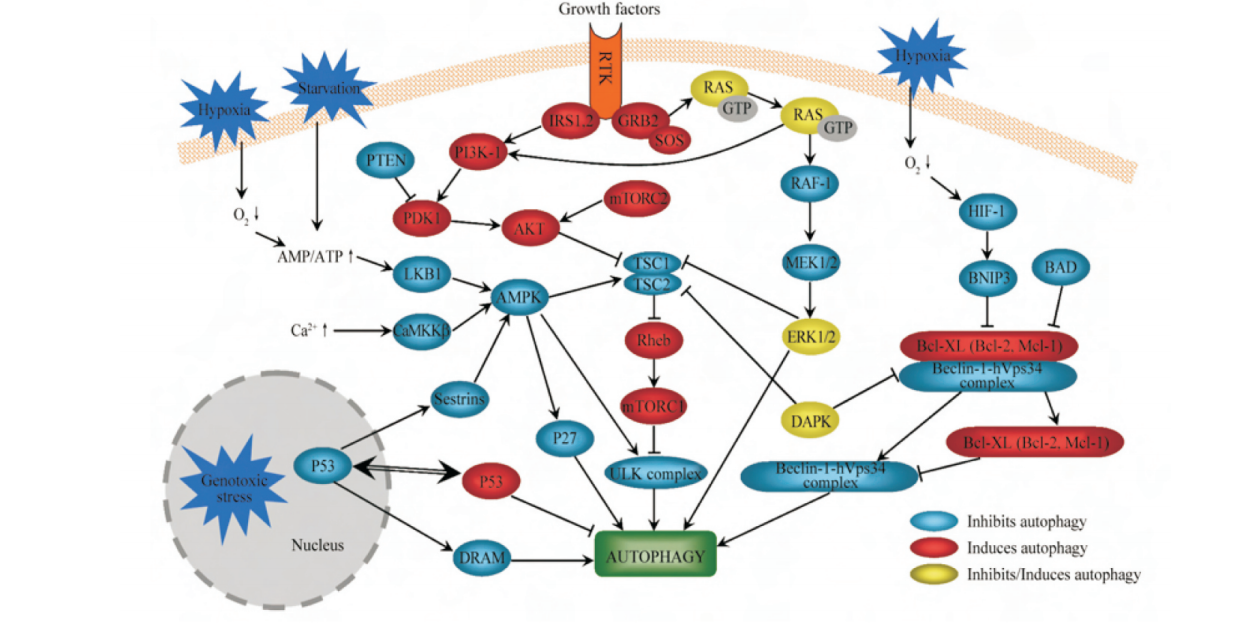
苷酸活化蛋白激酶(AMP-activated protein kinase, AMPK)是能量代谢变化的感受器, 在能量代谢过程中起重要的调节作用。在营养缺乏的情况下, ATP/AMP的比例下降引起LKB1的激活, 进而激活AMPK。与AKT通路的作用相反, AMPK可以磷酸化激活TSC1/2复合体, 进而抑制mTORC1的活性。
AMPK还可以通过直接磷酸化Raptor, 使Raptor脱离mTORC1复合体, 进而抑制mTORC1的活性。AMPK是自噬的重要正调控因子, 在压力存 在的情况下, LKB1-AMPK通路磷酸化细胞周期抑制剂p27kip1来激活自噬反应。细胞内游离Ca2+的浓度增加可以通过激活Ca2+/CaMKKβ和TAK1通路, 进而激活AMPK, 最终通过抑制mTOR诱导自噬的发生。最新的研究表明, 营养缺乏会促进AMPK与ULK1的PS结构域结合, 使ULK1的Ser/Thr丰富 区多位点磷酸化, 从而激活ULK1, 直接调节细胞自噬。
p53是一种重要的抑癌基因, 对自噬的调控作用是双重的。DNA损伤促进p53表达, p53通过激活MPK通路, 诱导了自噬的发生。
p53入核后会增加DRAM (damage-regulated autophagy modulator)的 转录进而促进自噬, 胞浆内p53的减少也提高了自噬的水平。
AMPK与P53相关检测抗体 AMPK与P53相关化合物
八、如何测量自噬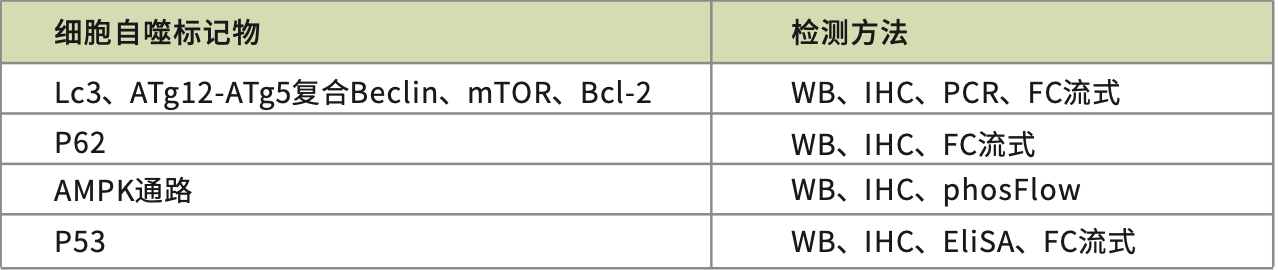
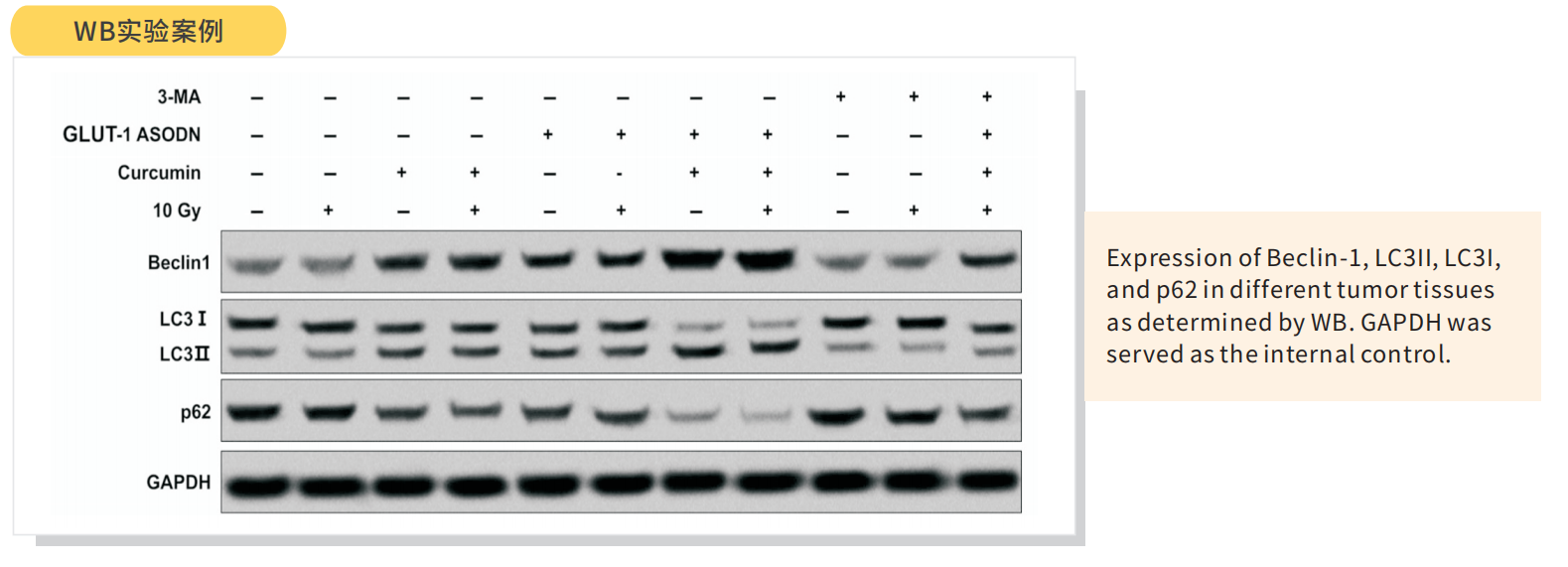
九、实验案例说明
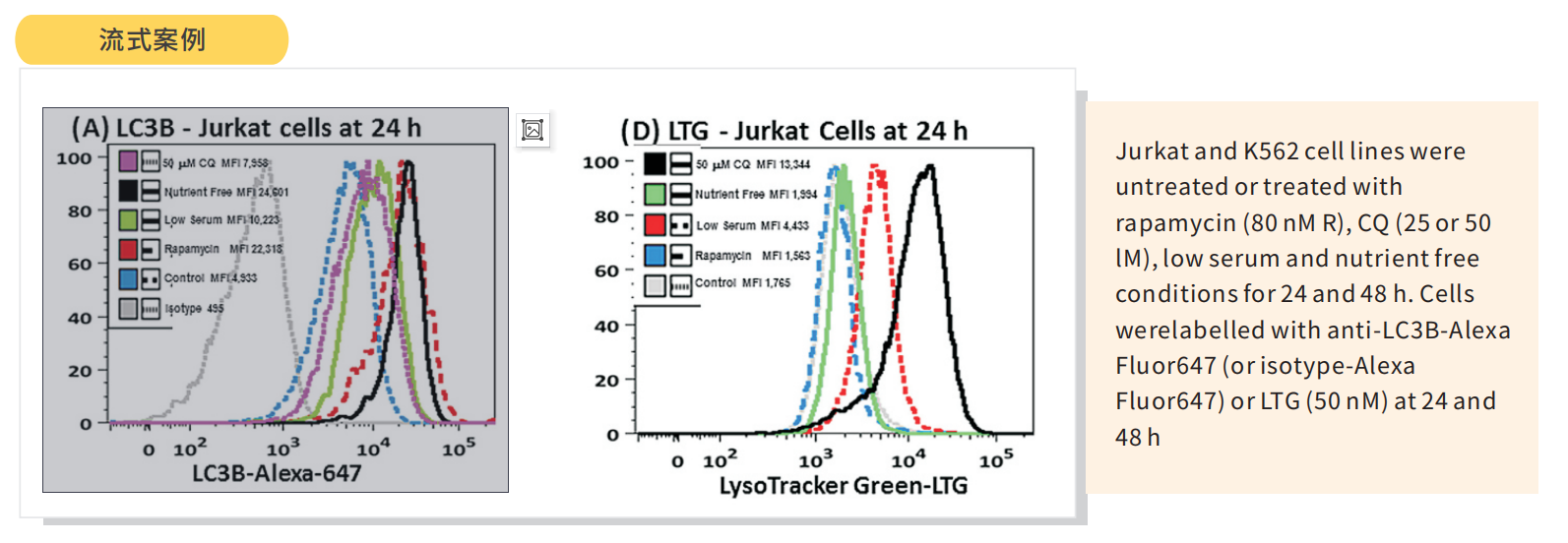
十、引用文献
1. Li, Xiaohua; He, Shikun; Ma, Binyun (2020). Autophagy and autophagy-related proteins in cancer. Molecular Cancer, 19(1), 12–.
2. Yorimitsu, T; Klionsky, D J (2005). Autophagy: molecular machinery for self-eating. , 12(0), 1542–1552.
3. Dossou, Akpedje S.; Basu, Alakananda (2019). The Emerging Roles of mTORC1 in Macromanaging Autophagy. Cancers, 11(10), 1422–.
4. Eng, Kai Er; Panas, Marc D.; Hedestam, Gunilla B. Karlsson; McInerney, Gerald M. (2010). A novel quantitative flow cytometry-based assay for autophagy. Autophagy, 6(5), 634–641.
5. Zhang Y , Mun S R , Linares J F , et al. ZZ-dependent regulation of p62/SQSTM1 in autophagy[J]. Nature Communications, 2018, 9(1).
6. Al-Bari M . A current view of molecular dissection in autophagy machinery[J]. Journal of Physiology and Biochemistry, 2020, 76(3):357-372.
7. Xu X , Araki K , Li S , et al. T cell survival and memory formation[J]. Nature Immunology.
8. Dai L , Yu Q , Zhou S , et al. Effect of combination of curcumin and GLUT AS㎡
9. MD Keller, Torres V J , Cadwell K . Autophagy and microbial pathogenesis[J]. Cell Death and Differentiation, 2020, 27(11):1-15.
10. Warnes G . Measurement of Autophagy by Flow Cytometry[J]. Current Protocols in Cytometry, 2014, 68:9.45.1.
11. Warnes, G. Flow cytometric assays for the study of autophagy[J]. Methods A Companion to Methods in Enzymology, 2015.




















 危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)
危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)  营业执照(三证合一)
营业执照(三证合一)