细胞凋亡
细胞凋亡,又称程序性细胞死亡,是为维持内环境稳定,在一定时间内,细胞按一定的程序发生死亡,这种细胞死亡具有严格的基因时空性和选择性。与细胞坏死不同,它不是病理条件下的自体损伤,而是为更好地适应生存环境主动争取的一种死亡过程。凋亡缺陷会导致肿瘤等细胞死亡障碍疾病的发生,在某些情况下如心脏受袭也会导致凋亡过激从而杀死许多无辜细胞。细胞凋亡涉及一系列基因的激活、表达以及调控等,其特征在于质膜不对称性和附着的丧失,核质浓缩,核膜、核仁碎裂,DNA 片段化和 mRNA 衰变等,早期特征之一是质膜的改变。
一 、细胞凋亡的外源性&内源性信号通路
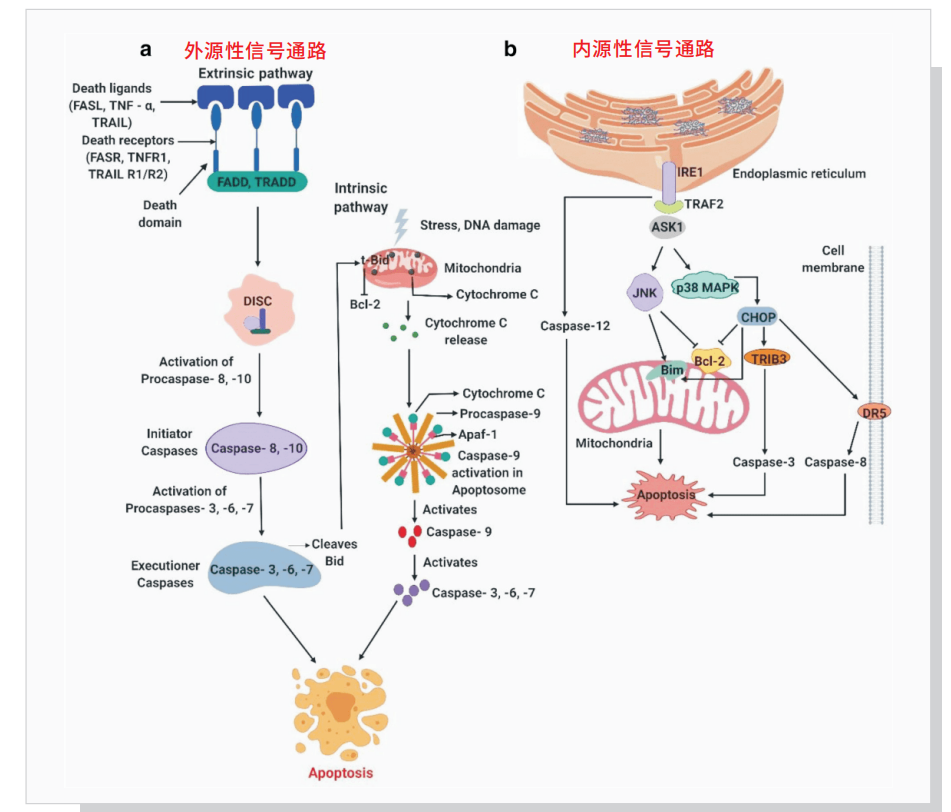
凋亡可被多种细胞信号激活,如钙稳态失衡、氧化损伤、线粒体损伤、毒素、生长因素和激素刺激等。细胞凋亡过程大致分为:
凋亡信号转导
凋亡基因激活
细胞凋亡的执
凋亡细胞的清除
经典的细胞凋亡机制可分为内源性信号通路和外源性信号通路两种。
a. 外源性死亡受体途径开始于特异性死亡受体与配体结合,如 FasL(CD95)或 TNFR1 分别和配体 Fas 或 TNF-α 结合,使死亡受体的结构域寡聚化,后募集 Caspase-8 和衔接蛋白 FADD 形成死亡诱导信号复合体 DISC。激活的 Caspase-8 引发后续 Caspase 级联反应促进细胞死亡,它还能与 Bid 相互作用激活内源性通路。
b. 内源性凋亡信号通常激活线粒体途径。凋亡蛋白 Bid 诱导凋亡蛋白 Bcl-2 拮抗剂 Bak 和 Bcl-2 结合蛋白 Bax 的激活,它们形成的聚合体插入线粒体外膜引起膜电位下降和细胞凋亡关键蛋白的释放,如细胞色素 C、SMAC / DIABLO 及凋亡诱导因子(AIF)等,激活 Caspase 级联反应,从而诱发细胞凋亡。
二 、死亡受体信号通路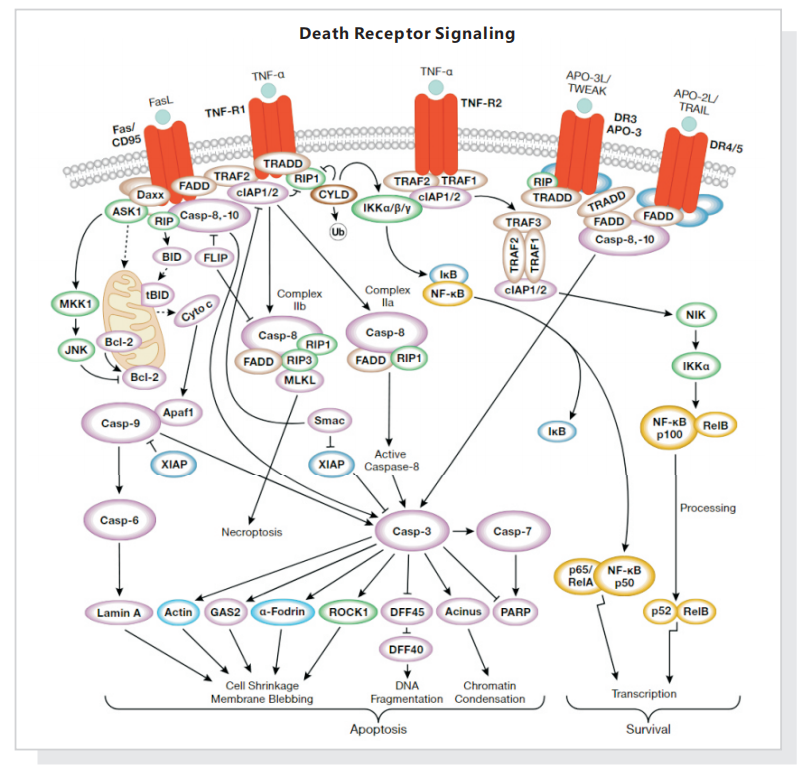 【图片来源于Cell Signaling Technology(CST)】
【图片来源于Cell Signaling Technology(CST)】
Fas、TNFαR、DR3、DR4 和 DR5 等死亡受体被各自的配体激活后,可诱发凋亡。死亡受体配体通过受体寡聚化,启动信号转导,从而导致特异的接头蛋白的募集,以及 caspase 级联反应的激活。FasL 的结合诱导 Fas 三聚化,从而通过接头蛋白 FADD 招募启动型 caspase-8。然后,caspase-8 寡聚化并通过自催化被激活。激活的 caspase-8 可通过两条并行级联反应诱发凋亡:它既可以直接剪切并激活 caspase-3,也可以剪切 Bcl-2 家族的促凋亡蛋白 Bid。切短的 Bid (tBid) 转位到线粒体中,诱导 cytochrome C 释放,从而激活 caspase-9 和- 3。TNF-α 和 DR-3L 可传递促凋亡或抗凋亡信号。TNFαR 和 DR3 通过接头蛋白 TRADD/FADD 和激活 caspase-8 ,促进细胞凋亡。TNF-α 与 TNFαR 的相互作用,可通过 NIK/IKK 激活 NF-κB 通路。NF-κB 的激活诱导促存活基因的表达,包括 Bcl-2 和 FLIP,后者可直接抑制 caspase-8 的激活。FasL 和 TNF-α 也可通过 ASK1/MKK7 激活 JNK。激活 JNK 可通过磷酸化抑制 Bcl-2。在没有 caspase 激活的情况下,对死亡受体的刺激可通过形成复合体 IIb ,导致另一种程序性细胞死亡通路被激活,这种通路称作坏死性凋亡。
三、线粒体调控与细胞凋亡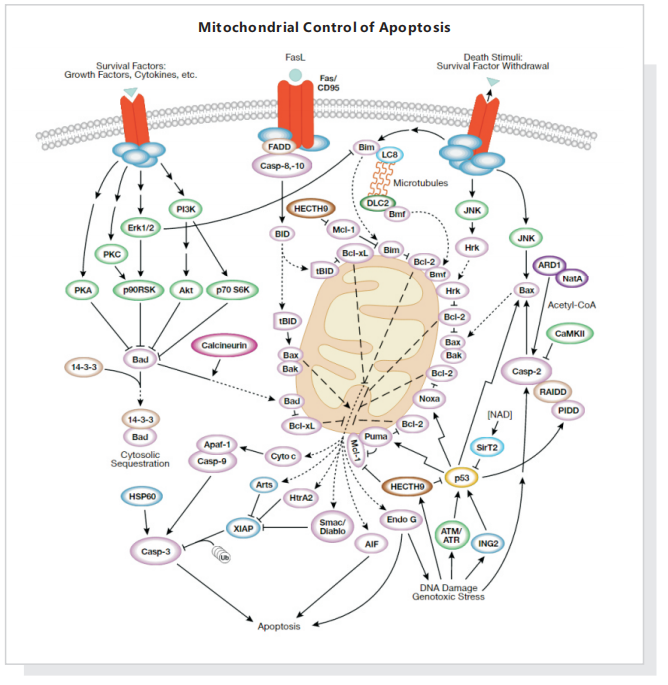
Bcl-2 蛋白家族通过控制线粒体通透性来调节细胞凋亡。抗凋亡蛋白Bcl-2 和Bcl-xL 驻留在线粒体外膜中,抑制cytochrome c 释放。促凋亡的Bcl-2 蛋白Bad、Bid、Bax 和Bim 可驻留在细胞质中,在接受死亡信号转导后转位到线粒体中,并在此处促进cytochrome C 释放。Bad 易位到线粒体,并与Bcl-xL 形成一个凋亡前复合体。这种转位会被存活因子所抑制,该因子会诱导Bad 磷酸化、导致其胞质汇集。Caspase-8 接受Fas 信号转导后,剪切胞质Bid;其活性片段(tBid) 转位到线粒体中。Bax 和Bim 响应死亡刺激,转位到线粒体中,存活因子也会离开。DNA 损伤后,激活的p53 诱导Bax、Noxa 和Puma 转录。从线粒体中释放出来后,cytochrome C 与APAF-1 结合,并与caspase-9 形成激活复合体。虽然线粒体膜通透性和凋亡过程中cytochrome C 释放的调节机制尚未完全清楚,但已知Bcl-xL、Bcl -2 和Bax 可影响电压依赖性阴离子通道(VDAC),这可能对调节cytochrome C 释放有一定的作用。Mule/ARF-BP1 是因DNA 损伤而被激活的针对p53 的E3 泛素连接酶,MCL-1是BCL-2 家族中的抗凋亡成员。
四、细胞凋亡过程总览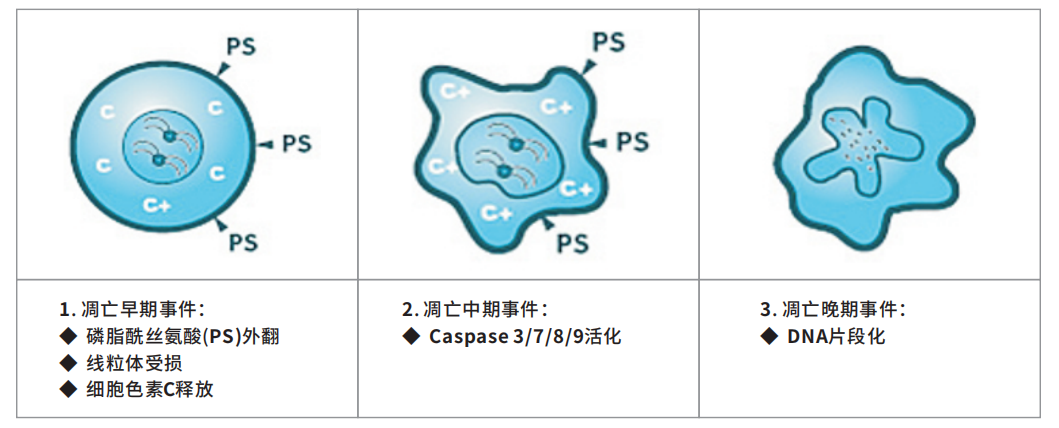
凋亡事件1: Annexin V / 细胞膜 PS 外翻
凋亡细胞在早期Phosphatidyl-serine(PS)会由细胞膜内外翻至膜外,利用Annexin V通过流式或电镜能够检测到PS的外翻。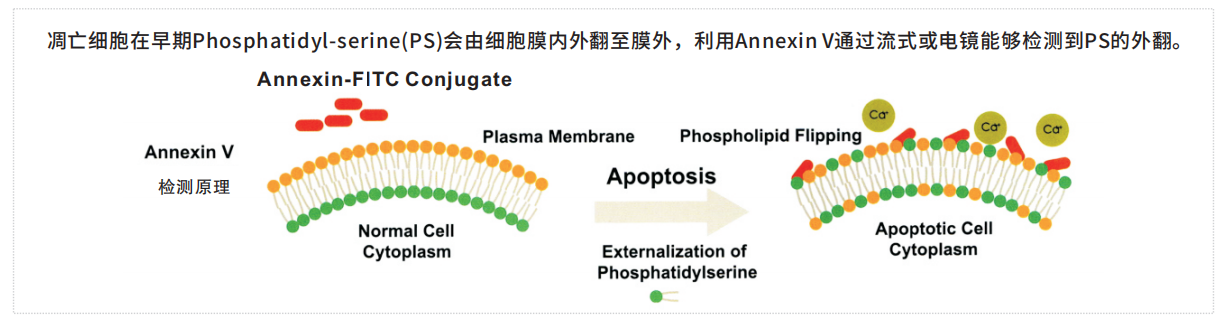
● 流式实验步骤:
★ 取流式管,按顺序编好阴性对照管(空白管、阴性管、单阳管)和样本管号,用冷的PBS洗细胞2次,用1×binding buffer制成1×106/ml细胞悬液
★ 流式管中分别加入100ul细胞悬液,单阳管中分别加入样本管
加入5μl Annexin V-FITC和10μl PI碘化丙啶轻轻混匀
★ 样本管加入5μl Annexin V-FITC,轻轻混匀;再加入10μl PI
★ 室温(20-25°C)避光孵育10-20分钟,随后置于冰浴中
★ 即可上机检测,Annexin V-FITC为绿色荧光,碘化丙啶(PI)为红色荧光
● 流式实验结果:
1. 以Annexin V-FITC标示外翻的PS,再合并以PI进行的死亡细胞的染色,以区分三种细胞。
2. 凋亡细胞可被Annexin V-FITC染成绿色,但对PI拒染;
3.已死亡或Apoptosis后期的细胞因细胞膜已破损会同时染上Annexin V-FITC与PI;
凋亡事件2:凋亡中的线粒体功能变化
程序性细胞死亡早期的特征是线粒体功能的破坏。线粒体破坏包括膜电位的变化,线粒体健康的主要特征以及线粒体氧化还原电位的改变。内线粒体膜电位在Ca 2+的吸收和储存,活性氧的产生和排毒以及最重要的是通过氧化磷酸化合成ATP方面至关重要。可以使用多种基于荧光的分析方法检测线粒体功能的破坏,包括测量线粒体钙,超氧化物,线粒体通透性转变和膜电位。
实验方法一: JC-1线粒体膜电位检测
质子泵存在于线粒体内膜,可将基质内质子泵入膜间隙,质子跨膜转运使得线粒体膜间隙积累大量质子,形成质子梯度:线粒体膜间隙产生大量正电荷,而线粒体基质产生大量负电荷,从而形成跨线粒体内膜的跨膜电位(ΔΨ),简称为线粒体膜电位。
正常线粒体膜电位是维持线粒体进行氧化磷酸化、产生ATP的前提,是维持线粒体功能所必需,而凋亡过程中一个重要的变化即是线粒体膜电位的崩溃。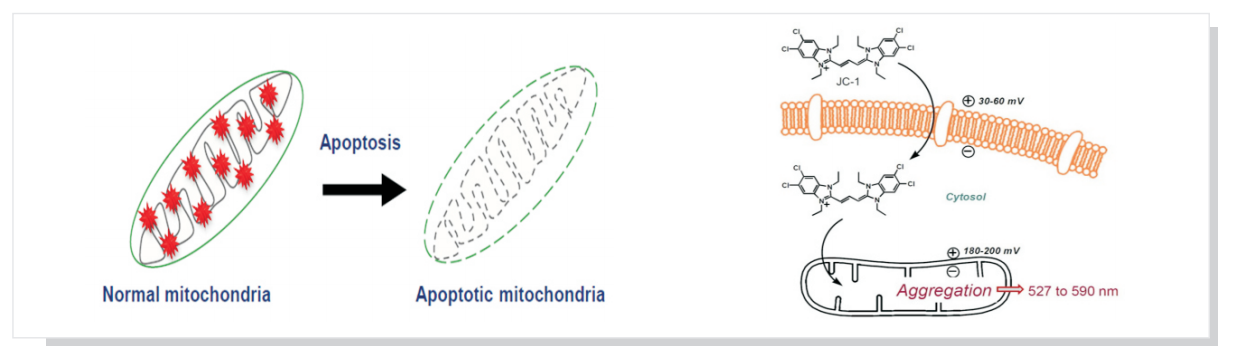
JC-1是亲脂性阳离子荧光染料可结合到线粒体基质,其荧光的增强或减弱说明线粒体内膜电负性的增高或降低。
1、正常生理状态下,线粒体负电性高,JC-1进入线粒体以多聚体(Aggregates)存在,FL2 channel可观察到红色荧光。
2、 细胞走向凋亡时,线粒体去极化产生,负电性降低,JC-1则以单体(Monomer)存在在细胞质,在FL1 channel可以观察到绿色荧光增加。

实验案例结果说明:Decrease in the mitochondrial membrane potential (ΔΨm) during storage is evidenced with JC-1 analysis. Displacement of the platelet population from FL-2 channel to FL-1 channel supports the decline in ΔΨm over time. An increase in unstained platelets in the inferior left region indicates the formation of platelet microparticles.
实验方法二: 凋亡中线粒体的重要蛋白检测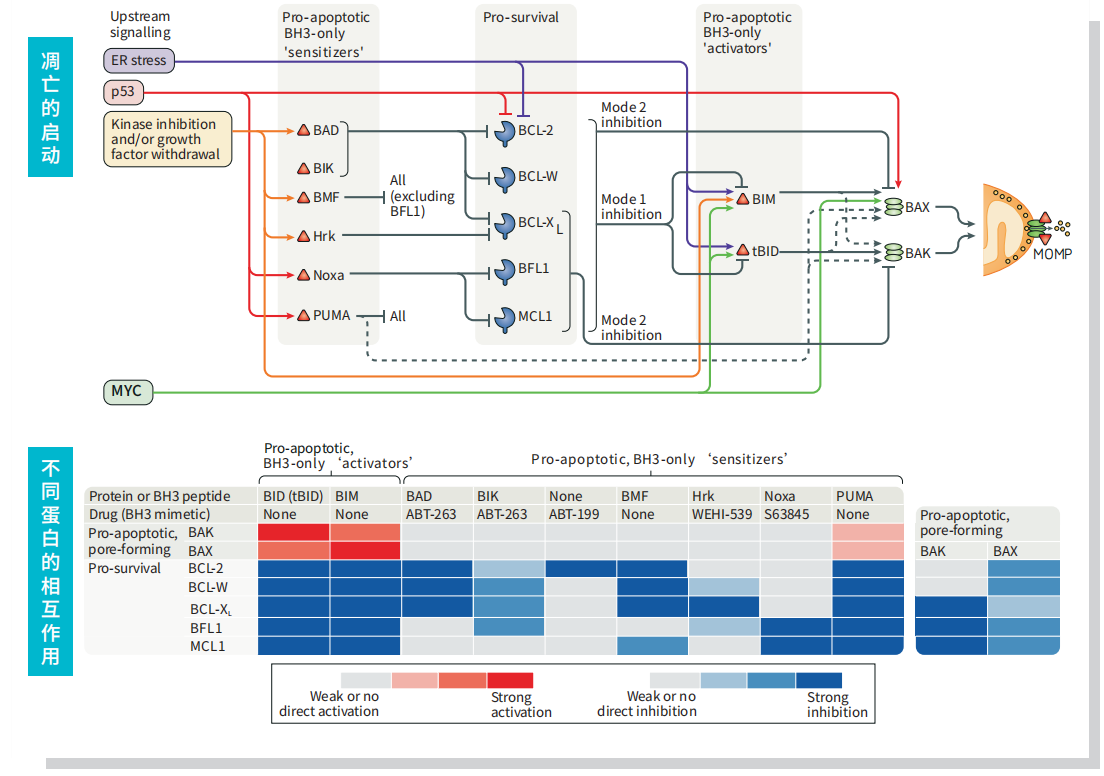
实验方法三: 线粒体膜电位的终点测定

实验案例结果说明: Decrease in the mitochondrial membrane potential (ΔΨm) and presence of platelet swelling during storage is evidenced with MitoTracker analysis on days 1, 3, and 5. Dislocation of the platelet population from FL-3 channel to FL-1 channel demonstrates the decline in ΔΨm along an increase in platelet swelling.
凋亡事件3:Caspase activity assay kits / 检测 Caspase 活化
当Cytochrome C释放至细胞质中,会导致Caspase活化,而活化的Caspase会引发一连串的蛋白质酶解作用(proteolysis cascade),将凋亡信息送至更下游的物质,造成细胞的特征性型态改变。
一、Caspase家庭介绍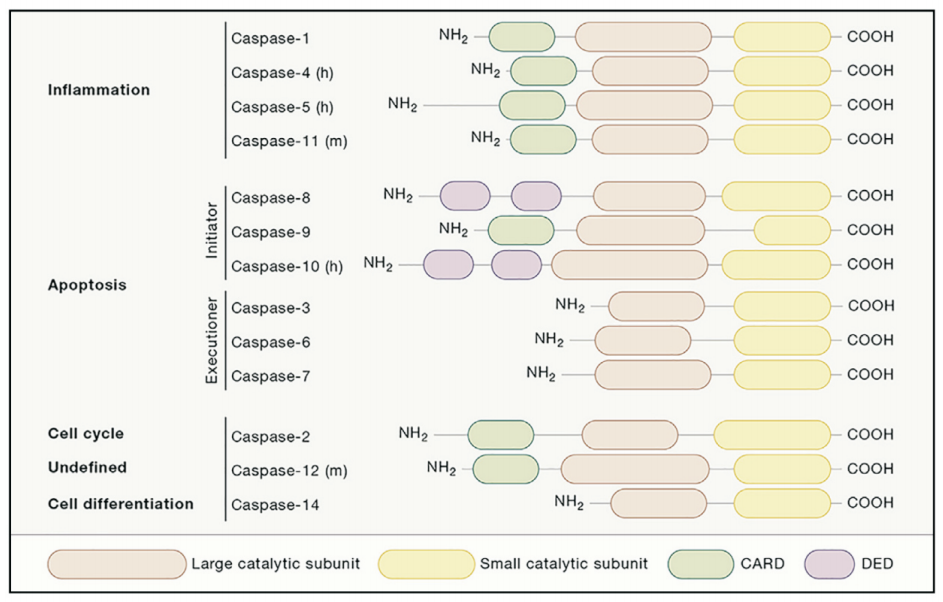
二 、凋亡中Caspase作用机制
Caspase是凋亡重要的启动子。凋亡最早和最常检测到的特征之一是一系列名为caspases的胞浆蛋白酶的激活。当凋亡激活时,caspases一起水解多种蛋白底物,从而使细胞结构和功能缺失,最终导致细胞死亡。尤其是caspase-8、-9和-3都与凋亡有关:Caspase-9在线粒体通路上,Caspase-8在Fas/CD95通路上,Caspase-3位于下游,由多条通路激活。
优宁维拥有多种检测Caspase的试剂,尤其是针对Caspase-3。包括直接针对激活形式的caspase抗体,这些抗体有多种荧光标记,可用于流式细胞术、细胞成像、ELISA和WesternBlot。
检测原理:是通过特异性抗体检测全长或者剪切后的Caspase 活性
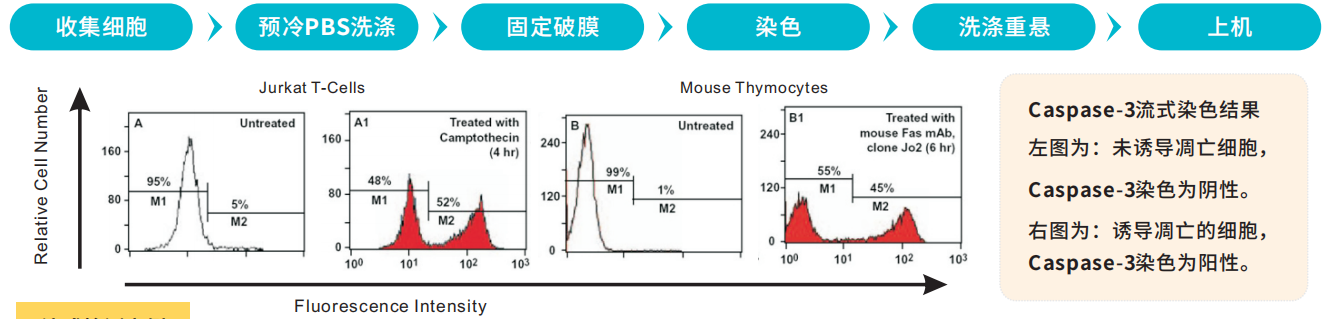
检测方法:流式 、WB 、IF 、IHC 、ELISA等 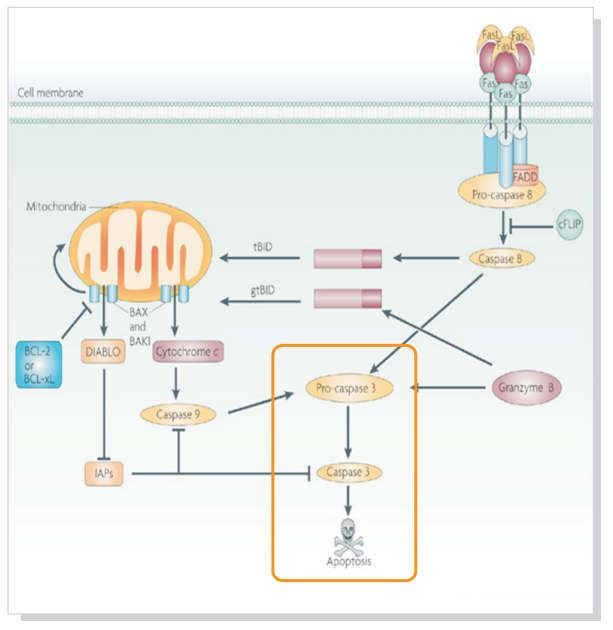
方法一:流式检测
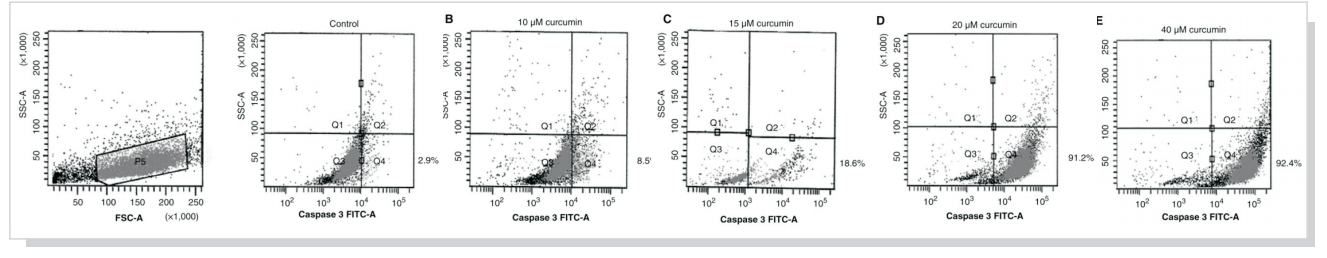
流式案例结果说明:Quadrant analysis of active caspase-3 phycoerythrin staining by flow cytometry of HL-60 cells treated with curcumin n at concentrations of 10 mM (B), 15 mM (C), 20 mM (D), and 40 mM (E). At least 10,000 cells were analyzed per sample,and quadrant analysis was performed. The proportion (%) of cell number is shown in each quadrant Q1þQ3, caspase-3 cell number is shown in each quadrant Q1þQ3, caspase-3
方法二:WB电泳
方法三:免疫组化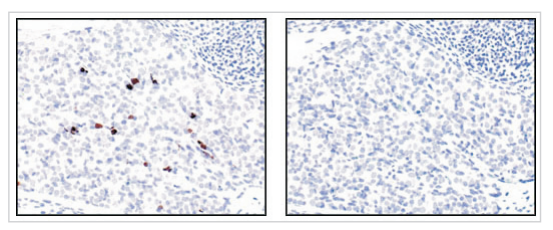
采用Caspase-3 (8G10) Rabbit mAb兔单抗对未Immunohistochemical analysis of paraffin-embedded mouse embryo, using Cleaved Caspase-3 (Asp175) (5A1E) Rabbit mAb in the presence of control peptide (left) or Cleaved Caspase-3 (Asp175) Blocking Peptide (#1050) (right).
方法四:免疫荧光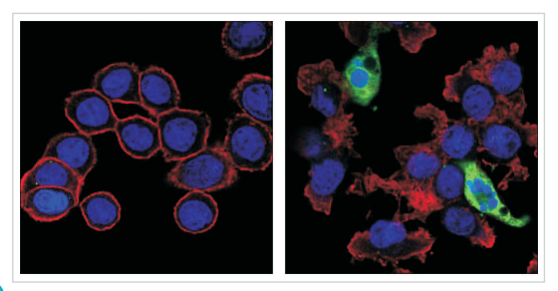
Confocal immunofluorescent images of HT-29 cells, untreated (left) or Staurosporine #9953 treated (right) labeled with Cleaved Caspase-3 (Asp175) (5A1E) Rabbit mAb (green). Actin filaments have been labeled with Alexa Fluor 555 phalloidin #8953 (red). Blue pseudocolor = DRAQ5 #4084 (fluorescent DNA dye).
凋亡事件4: Tunel-DNA梯度降解
细胞凋亡中染色体DNA的断裂是个渐进的分阶段的过程,染色体DNA首先在内源性的核酸水解酶的作用下降解为50-300kb的大片段。然后大约30﹪的染色体DNA在Ca2+和Mg2+依赖的核酸内切酶作用下,在核小体单位之间被随机切断,形成180~200bp核小体DNA多聚体。
DNA双链断裂或只要一条链上出现缺口而产生的一系列DNA的3ʼ-OH末端可在脱氧核糖核苷酸末端转移酶(TdT)的作用下,将脱氧核糖核苷酸和荧光素、过氧化物酶、碱性磷酸化酶或生物素形成的衍生物标记到DNA的3ʼ-OH末端,从而可进行凋亡细胞的检测,这类方法一般称为脱氧核糖核苷酸末端转移酶介导的缺口末端标记法(TUNEL)。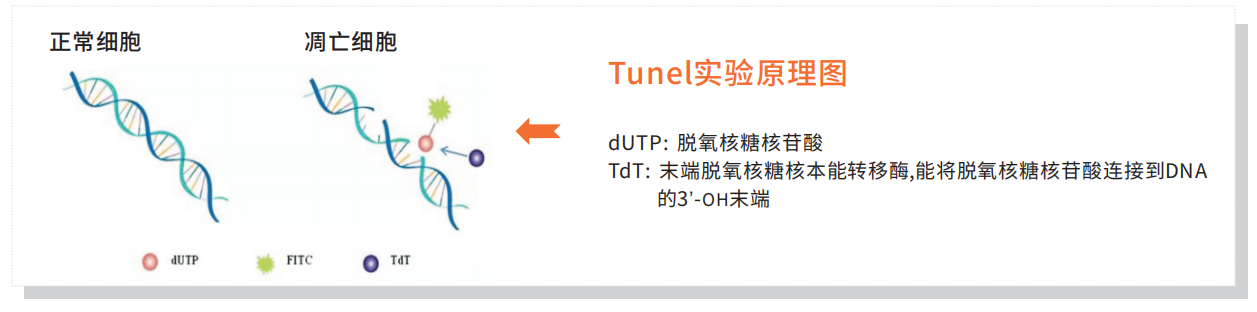
流式案例说明
3'-OH可以在末端脱氧核苷酸转移酶(Terminal Deoxynucleotidyl Transferase, TdT) 的催化下加上荧光素 (FITC) 标记的dUTP (fluorescein-dUTP) 或者Brdu,从而可以通过荧光显微镜或流式细胞仪进行检测,这就是TUNEL (TdT-mediated dUTP Nick-End Labeling) 流式细胞术法检测细胞凋亡的原理。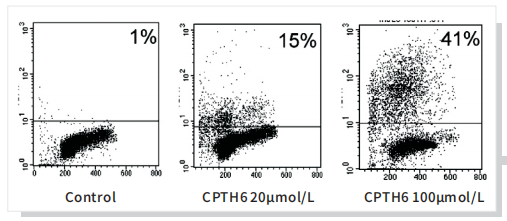
TUNELassay evaluated by flowcytofluorimetric analysis of U-937cells treated with 20 and 100 mmol/LCPTH6 for 72 hours. The percentageof TUNEL-positive cells is reported.A representative experiment of 3independent experiments
免疫组化IHC方法
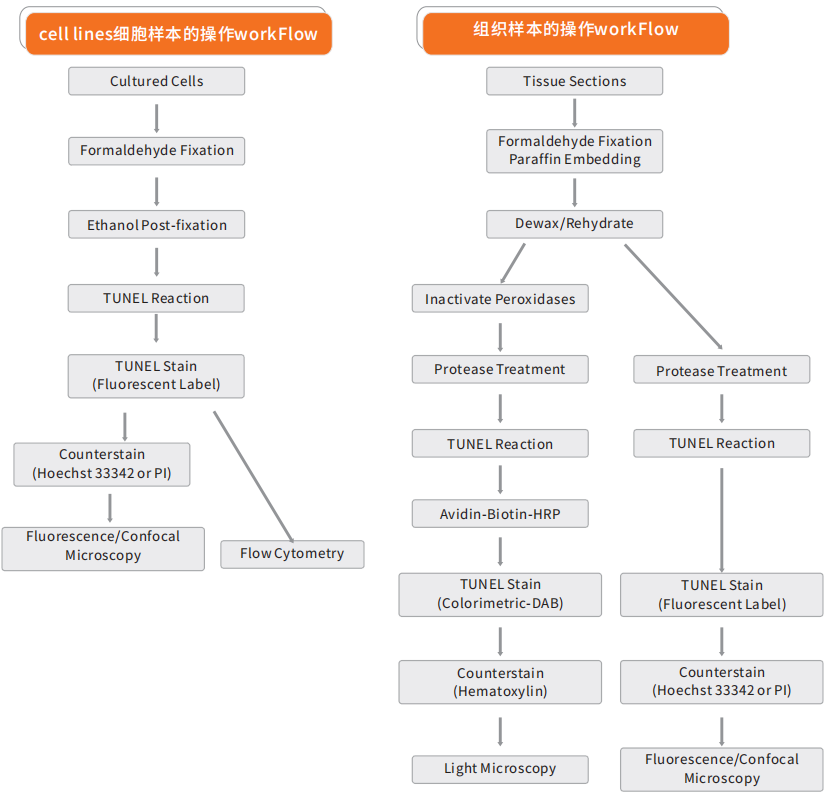
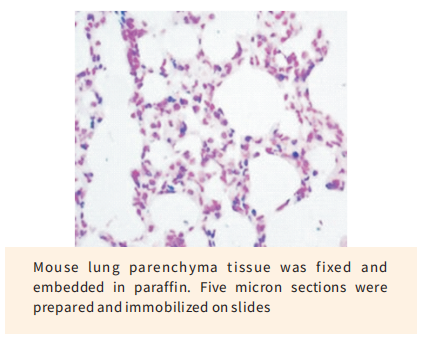
TUNEL(TdT-mediated dUTP nick end labeling)细胞凋亡检测试剂盒是用来检测组织细胞在凋亡早期过程中细胞核DNA的断裂情况。其原理是荧光素(fluorescein)标记的dUTP在脱氧核糖核苷酸末端转移酶(TdT Enzyme)的作用下,可以连接到凋亡细胞中断裂DNA的3’-OH末端,并与连接辣根过氧化酶(HRP)的荧光素抗体特异性结合,后者又与HRP底物二氨基联苯胺(DAB)反应产生很强的颜色反应(呈深棕色),特异准确地定位正在凋亡的细胞,因而在光学显微镜下即可观察凋亡细胞;由于正常的或正在增殖的细胞几乎没有DNA断裂,因而没有3-OH形成,很少能够被染色。本试剂盒适用于组织样本(石蜡包埋、冰冻和超薄切片)和细胞样本(细胞涂片)在单细胞水平上的凋亡原位检测。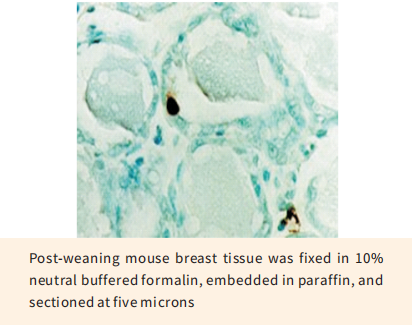
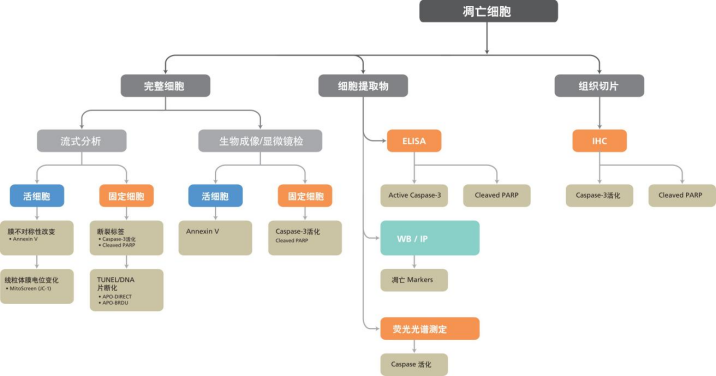
细胞凋亡实验方法学总结
|
检测指标 |
试验 |
主要特点 |
|
细胞膜的改变 |
Annexin结合试验: • 单染试剂 • Annexin V 试剂盒 |
• 早期凋亡检测指标 • 快速、简便 • 用于流式细胞术或免疫荧光 |
|
线粒体变化 |
• JC-1/BCL-2等 |
• 快速、简便、单个细胞水平、用流式细胞仪或荧光显微镜 |
|
细胞凋亡蛋白酶激活 |
Caspase活化试剂盒和试剂 |
• 快速、简便,荧光分光光度法 |
|
• 活化的Caspase-3免疫实验 |
• ELISA、流式细胞术或WB |
|
|
DNA片段化 |
• APO-BrdU TUNEL Assay • APO-DIRECT TUNEL Assay |
• 可以分析贴壁细胞、单个细胞水平、在流式上可同时分析细胞周期 |
细胞凋亡热卖产品(全部现货~~)
|
检测指标 |
检测方法 |
爆款产品编号 |
产品名称 |
规格 |
|
Annexin V |
流式 |
Annexin V FITC Apop Dtec Kit I |
100T |
|
|
Annexin V |
流式 |
BD Pharmingen PE Annexin V Apoptosis Detection Kit I |
100T |
|
|
Annexin V |
流式 |
APC Annexin V |
100T |
|
|
Annexin V |
流式 |
Annexin V FITC Apop Dtec Kit I |
25T |
|
|
线粒体膜电位 |
流式 |
MITOSCREEN JC-1 KIT |
100T |
|
|
线粒体膜电位 |
流式 |
JC-1 |
5mg |
|
|
线粒体膜电位 |
流式 |
MitoTracker®Green FM |
500ug |
|
|
Pro-Caspase-3 |
WB |
Caspase-3 Antibody |
100ul |
|
|
Active-Caspase-3 |
WB |
Cleaved Caspase-3 (Asp175) (5A1E) Rabbit mAb |
100ul |
|
|
Caspase-3 |
流式 |
FITC Active Caspase-3 Apoptosis Kit |
kit |
|
|
Pro-Survival Bcl-2 Family |
WB |
Pro-Apoptosis Bcl-2 Family Antibody Sampler Kit |
kit |
|
|
Pro-Survival Bcl-2 Family |
WB |
Pro-Survival Bcl-2 Family Antibody Sampler Kit |
kit |
|
|
TUNEL |
IHC免疫组化 |
TUNEL Apoptosis Detection Kit-DAB |
50T |
|
|
TUNEL |
流式 |
APO-BRDU™ Kit |
60T |
三 、引用文献
1. Trisciuoglio D , Ragazzoni Y , Pelosi A , et al. CPTH6, a Thiazole Derivative, Induces Histone Hypoacetylation and Apoptosis in Human Leukemia Cells[J]. Clinical Cancer Research, 2011.
2. Masci L , Ovidi, Taddei, et al. Apoptotic Effects on HL60 Human Leukaemia Cells Induced by Lavandin Essential Oil Treatment[J]. Molecules, 2020, 25(3):538.
3. Mcarthur K , Kile B T . Apoptotic mitochondria prime anti-tumour immunity[J]. Cell Death Discovery.
4. Melanie F , SD Günther, Robin S , et al. Caspase-8 is the molecular switch for apoptosis, necroptosis and pyroptosis[J]. Nature, 2020, 2019年575卷7784期:683-687页.
5. Boatright K M , Salvesen G S . Mechanisms of caspase activation.[J]. Current Opinion in Cell Biology, 2003, 15(6):725-731.
6. Singh R , Letai A , Sarosiek K . Regulation of apoptosis in health and disease: the balancing act of BCL-2 family proteins[J]. Nature Reviews Molecular Cell Biology, 2019, 20(3):1.
















 危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)
危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)  营业执照(三证合一)
营业执照(三证合一)