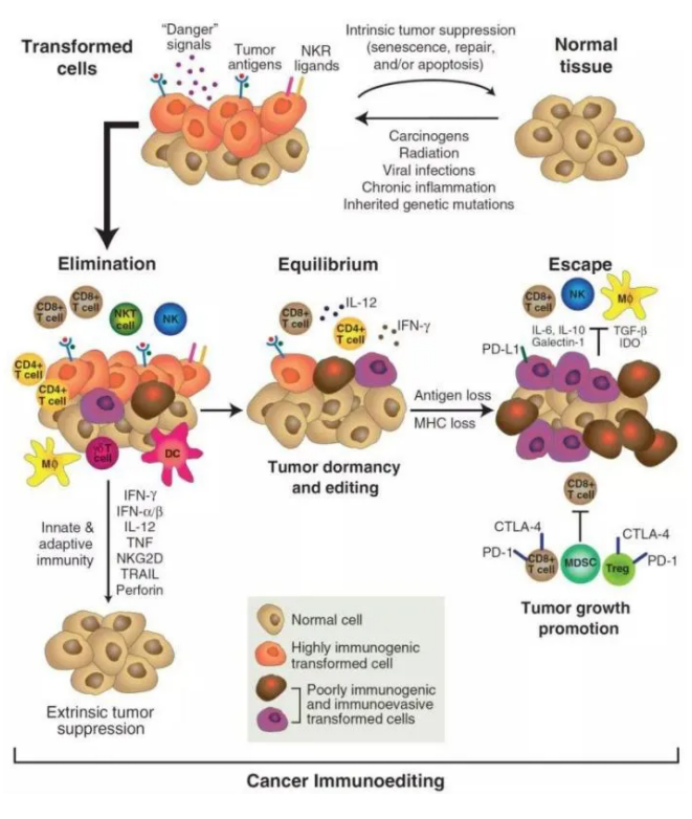
肿瘤免疫编辑是适应性和先天免疫系统控制肿瘤生长和塑造肿瘤免疫原性的过程。
此过程包括三个阶段:清除(elimination)、平衡(equilibrium)、逃逸(escape)。
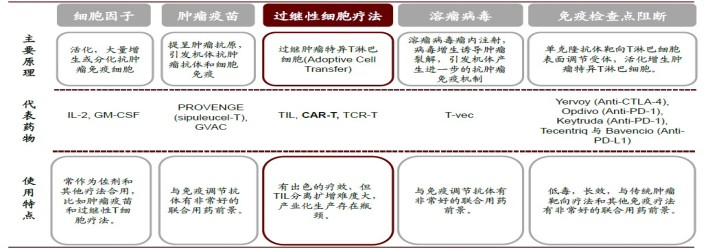
肿瘤免疫治疗五大类:
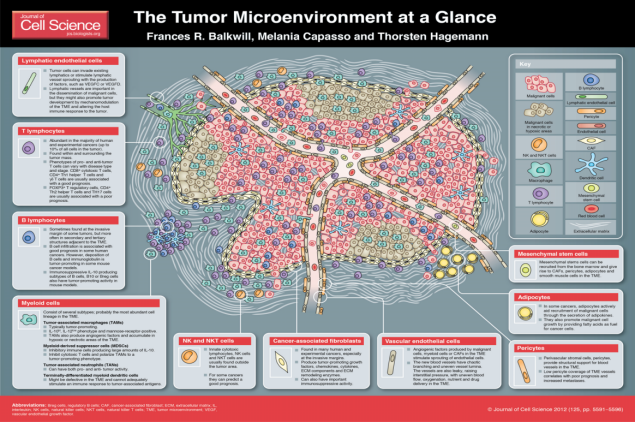
二、肿瘤微环境
肿瘤微环境,即肿瘤细胞产生和生活的内环境,其中不仅包括了肿瘤细胞本身,还有其周围的成纤维细胞、免疫和炎性细胞、胶质细胞等各种细胞,同时也包括附近区域内的细胞间质、微血管以及浸润在其中的生物分子。
三、肿瘤微环境中的免疫细胞
根据免疫细胞在肿瘤微环境的角色,把免疫细胞做成了如下两群区分:
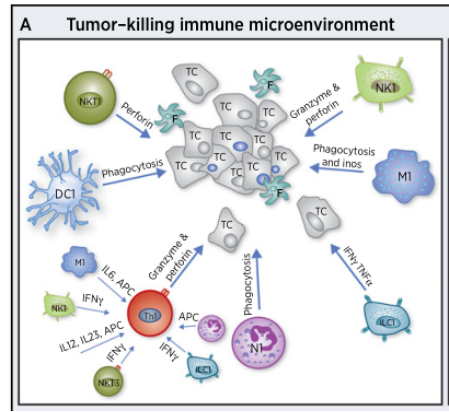
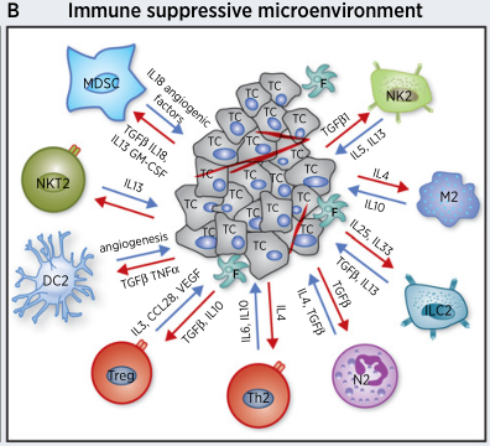
1)调节性T细胞(Treg)调节性T细胞是一个异质性的群体,主要包括CD4+ CD25h/Treg,Trl(IL-10 + T细胞)以及TGF-β+T细胞。肿瘤微环境中的趋化因子通过Treg的受体CCR4,将胸腺、骨髓、淋巴结及外周的自然产生Treg募集至肿瘤进而抑制免疫。
2)肿瘤相关巨噬细胞(TAM)在肝癌、肺癌和乳腺癌等肿瘤组织中,TAM非但不能清除肿瘤,反而主动抑制机体免疫应答,在肿瘤发生发展和转移中起了“帮凶”的作用,包括①大量表达和分泌表皮生长因子(EGF)、血小板源性生长因子(PDGF)、TGF-B、肝细胞生长因子(HGF)和基质金属蛋白酶(MMPs)直接促进肿瘤生长、转移和侵袭。
3)髓系来源的抑制性细胞(MDSC)MDSC能表达多种促血管生成因子,直接促进肿瘤血管形成同时能通过高表达的ARG1、iNOS和ROS抑制T细胞介导的适应性抗肿瘤免疫以及NK与巨噬介导的天然抗肿瘤免疫。
4)DC树突细胞,在老鼠和人类的大多数肿瘤中都发现了DCs。DCs能够通过俘获死亡的肿瘤细胞和吞噬活的肿瘤细胞取得肿瘤抗原,从而激发免疫系统。但也有研究表明,在多发性骨髓中,mDCs直接提高肿瘤细胞的克隆产生以及生存率;在卵巢癌中,pDCs通过分泌促血管生成因子促进肿瘤血管生成。
5)NK细胞,先天性细胞毒性淋巴细胞,NK和NKT。
|
Cell type |
Markers (human) |
Markers (mouse) |
Function |
|
TAM |
CD11b + |
CD11b + GR1 – |
Classically activated M1 macrophages are proinflammatory and anti-tumorigenic and |
|
DC |
CD11c + CD83 + |
CD11c + CD83 + |
DCs are monocytic antigen-presenting cells that are derived from the bone marrow. |
|
TEM |
CD11b + |
CD11b + |
TIE2 is a receptor for the angiogenic growth factor, angiopoietin. TIE2-expressing |
|
Neutrophil |
CD11b + CD66b + |
CD11b + |
Neutrophils are the most abundant circulating leukocyte in humans and are pheno- |
|
Mast cell |
CD11b – |
CD11b – CD49d + |
Mast cells are best known for their role during allergies and autoimmunity. Mast cellsare recruited to tumors, where they release factors that enhance proliferation of endo-thelial cells to promote tumor angiogenesis. |
|
MDSC |
CD11b + |
CD11b + |
MDSCs are immunosuppressive precursors of dendritic cells, macrophages and |
|
NK cell |
CD56 + CD16 + |
CD335 + NK1.1 + |
NK cells are cytotoxic lymphocytes that can kill stressed cells in the absence of antigen presentation. NK cells detect and kill tumor cells through ‘missing-self’ activation (loss of healthy cell markers) or ‘stress-induced’ activation (gain of stressed cell markers). |
|
TH cell |
CD3 + CD4 + |
CD3 + CD4 + |
CD4 + T H cells can be divided into T H 1 and T H 2 lineages. T H 1 cells secrete proinflam-matory cytokines and can be anti-tumorigenic. T H 2 cells secrete anti-inflammatory cytokines and can be pro-tumorigenic. The ratio of T H 1 to T H 2 cells in cancer corre-lates with tumor stage and grade. |
|
Treg cell |
CD4 + CD25 + |
CD4 + CD25 + |
T reg cells have primarily pro-tumorigenic roles by suppressing immunosurveillance; |
|
TC cell |
CD3 + CD8 + |
CD3 + CD8 + |
CD8 + cytotoxic T (T C ) cells are effector cells of the adaptive immune system. They |
|
B cell |
CD19 + CD20 + |
B220 + CD19 + CD22 + |
B lymphocytes are important mediators of humoral immunity. In cancer, they can |
四、肿瘤相关免疫抑制因子
|
肿瘤相关免疫抑制因子 |
作用及意义 |
|
转化生长因子β |
属于调节细胞生长和分化的转化生长因子超家族。TGF-B促进肿瘤浸润和转移的机制有:①诱导肿瘤周围的基质环境改变;②诱导上皮细胞-间充质转化;③促血管新生和抑制宿主免疫系统杀伤肿瘤细胞。 |
|
白介素-10(IL-10) |
肿瘤细胞能产生IL-10,主要通过以下途径来抑制肿瘤免疫:①下调APC表面的MHC、共刺激分子和甘露糖受体的表达,上调共抑制分子,减弱抗原呈递能力;②抑制效应性细胞如 CTL、NK和y6T细胞的增殖和细胞毒素的产生;③抑制一氧化氮的产生来干扰IFN-y 对Mp的活化; |
|
前列腺素E2(PGE2) |
PGE2能诱导产生抑制型T细胞和抑制型Mp,降低LAK细胞的活性,抑制抗原特异性T细胞增殖和产生细胞因子等;与此同时,PGE2还能抑制APC的分化和功能;能抑制Ta1、NK细胞和Mp的抗肿瘤活性,并上调T12相关细胞因子如L-10的产生。 |
|
B7-Hs 共抑制分子 |
B7-Hs 共抑制分子在大多数人类肿瘤中有广泛表达,而在正常组织罕见。T细胞活化除需要TCR转导的第一信号外,还需要协同刺激分子转导的第二信号。如果缺少刺激分子的第二信号将会导致T细胞的无反应性或者是特异性免疫耐受。 |
|
趋化因子 |
趋化因子及其受体家族在肿瘤免疫中的作用主要有以下几点:1募集免疫细胞进入肿瘤组织调控机体免疫功能,如集TAM,CXCL9、CXCL10趋化T细胞②直接调控肿瘤细胞,促进肿瘤细胞的增殖、侵袭和转移,如CCL12/CXCR4指导肿瘤细胞的定向转移;③cxC 型趋化因子促进肿瘤血管生成 |
|
代谢酶 |
吼噪胺2,3-双加氧酶和iNOS、NADPH氧化酶和精氨酸酶均在肿瘤的免疫抑制中发挥重要作用。前者通过直接降解T细胞增殖和分化所必需的色氨酸来阻滞T细胞的克隆增殖扩增甚至促进T细胞死亡,后者抑制由NK细胞和巨噬细+肪晋雀抗肿瘤免疫。 |
TME中的细胞因子
|
促肿瘤 |
抑肿瘤 |
促/抑肿瘤 |
|||
|
分泌因子
|
生长因子
|
TGF-β |
|
|
√ |
|
VEGF |
√ |
|
|
||
|
PGF |
√ |
|
|
||
|
IGF |
√ |
|
|
||
|
HGF |
√ |
|
|
||
|
PDGF |
√ |
|
|
||
|
细胞因子
|
IL-1β |
√ |
|
|
|
|
IL-2 |
|
√ |
|
||
|
IL-4/IL-13 |
|
√ |
|
||
|
IL-10 |
|
|
√ |
||
|
IL-12 |
|
√ |
|
||
|
IL-15 |
|
√ |
|
||
|
IL-23 |
|
√ |
|
||
|
IFNγ |
|
|
√ |
||
|
GM-CSF |
|
|
√ |
||
|
Perforin |
|
√ |
|
||
|
趋化因子
|
CCL2 |
√ |
|
|
|
|
CCL4 |
|
√ |
|
||
|
CXCL1 |
√ |
|
|
||
|
CXCL12 |
√ |
|
|||
五、肿瘤微环境中的免疫检查点
疫检查点是指免疫系统的内在调控机制,可保持自身耐受性,并有助于避免在生理性免疫应答期间的附带损伤。如今,显而易见的是,肿瘤会建造微环境以逃避免疫监视和攻击,特别是通过调节某些免疫检查点通路来进行的情况。
在正常生理状态下,CD8+ 细胞毒性 T 淋巴细胞和 CD4+ 辅助性 T 细胞通过 T 细胞受体 (TCR) 与肽抗原之间的相互作用被激活,肽抗原会结合在抗原呈递细胞 (APC) 表面上呈递的主要组织相容性复合体 (MHC) 分子。要获得最佳的 T 细胞激活,还需通过在 T 细胞CD28, 4-1BB, OX40, GITR, ICOS) and APCs (ex. (除 CD80、CD86、4-1BBL、OX40L、GITRL 和 ICOSLG 之外)中表达的共刺激分子进行的配体/受体相互作用。相反,通过受体(如在 T 细胞中表达的 PD-1、CTLA-4、TIM-3 和 LAG3)与其各自在 APC 和其他微环境细胞中表达的配体之间的相互作用,共抑制信号转导会抑制 T 细胞激活。例如,PD-L1 或 PD-L2 与 PD-1 受体之间的相互作用会去磷酸化 T 细胞受体信号转导通路 的主要组分,从而使 T 细胞中的 TCR 信号转导下调。共抑制受体 CTLA-4 会与共刺激受体 CD28 竞相与 APC 上的 CD80 和 CD86 配体相互作用。受体/配体相互作用时,CTLA-4 会抑制 T 细胞增殖、细胞周期进程和细胞因子产生,而 CD28 则是激活 T 细胞所必需的。在肿瘤微环境中,癌细胞具有选配的抑制性配体及其受体,它们可调节 T 细胞效应子功能,以增强肿瘤耐受性,并避免免疫系统的根除。近年来,这些通路的药理学调节物(被称为免疫检查点疗法,尤其是针对 PD-1 和 CTLA-4 的单克隆抗体形式)已受到广泛研究,并用作治疗癌症的新免疫治疗剂。鉴于免疫检查点疗法的早期成功,为了激活抗肿瘤免疫应答而开发针对其他共抑制和共刺激受体及其配体的免疫疗法似乎是一种令人信服的治疗策略。
|
促肿瘤 |
抑肿瘤 |
促/抑肿瘤 |
|||
|
受体&免疫检查点 (表面分子) |
— |
CD24/Siglec-10 |
√ |
|
|
|
— |
CD39 |
√ |
|
|
|
|
— |
CD47 |
√ |
|
|
|
|
— |
CD73 |
√ |
|
|
|
|
— |
CD112/CD155 |
√ |
|
|
|
|
— |
4-1BB(CD137) |
|
√ |
|
|
|
— |
CD226 |
|
√ |
|
|
|
— |
B7-H3(CD276) |
√ |
|
|
|
|
— |
TIM-3 |
√ |
|
|
|
|
— |
LAG-3 |
√ |
|
|
|
|
— |
TIGIT |
√ |
|
|
|
|
— |
KIR |
√ |
|
|
|
|
— |
GITR |
|
√ |
|
|
|
— |
ICOS |
|
√ |
|
|
|
— |
OX40 |
|
√ |
|
|
|
— |
NKG2A |
√ |
|
|
|
|
— |
NKG2D |
|
√ |
|
|
|
— |
TRAIL |
|
√ |
|
|
|
— |
CSF-1R |
√ |
|
|
|
|
— |
Siglec-15 |
√ |
|
|
|
|
— |
A2aR |
√ |
|
||










 危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)
危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)  营业执照(三证合一)
营业执照(三证合一)