一、粘膜免疫系统
黏膜免疫系统涵盖了防止病原体入侵的整个机体内在表面,既包括黏膜层和上皮细胞,也包括启动和行使免疫应答的黏膜下固有层中各种散在免疫细胞及一些器官化的淋巴组织。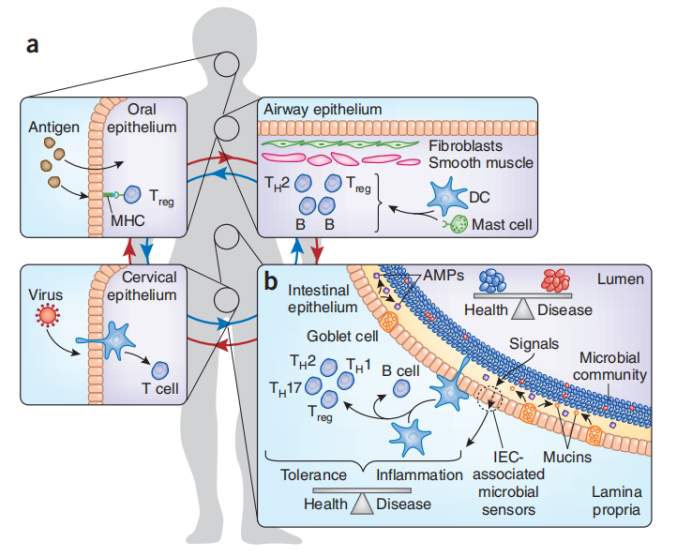
(a)最近的进展表明,粘膜位点起着全系统器官的作用。 整个身体的各种粘膜部位充当物理环境(食物,空气传播,病毒和共生抗原)和宿主粘膜防御之间的接口。(b)肠粘膜界面,一个复杂的系统,必须整合微生物群,黏液层,相关保护性化合物,上皮细胞和固有层固有免疫细胞之间的相互作用。 值得注意的是,微生物群落的状态和潜在的免疫细胞都有助于宿主的健康或疾病。
二、肠上皮细胞的屏障作用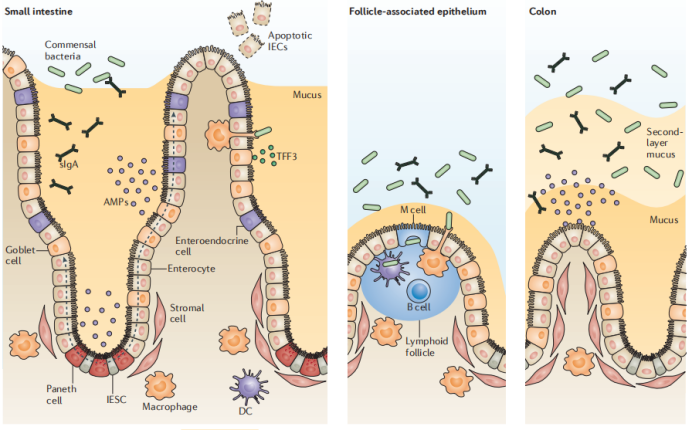
肠上皮细胞(IEC)形成生化和物理屏障,可维持腔内微生物群落与粘膜免疫系统之间的隔离。包含上皮,基质和造血细胞的肠上皮干细胞(IESC)壁iche通过隐窝驻留干细胞控制上皮细胞层的连续更新。分化的IEC(除Paneth细胞外)沿隐窝-绒毛轴向上迁移,如虚线箭头所示。分泌性杯状细胞和Paneth细胞分泌粘液和抗菌蛋白(AMP),以促进细菌从上皮表面排除。分泌型IgA(sIgA)的胞吞作用和腔释放进一步促进了这种屏障功能。微褶细胞(M细胞)和杯状细胞介导腔抗原和活细菌跨过上皮屏障转运至树突状细胞(DCs),而驻留于肠道的巨噬细胞则通过跨上皮的树突对内腔进行采样。
三、肠相关淋巴组织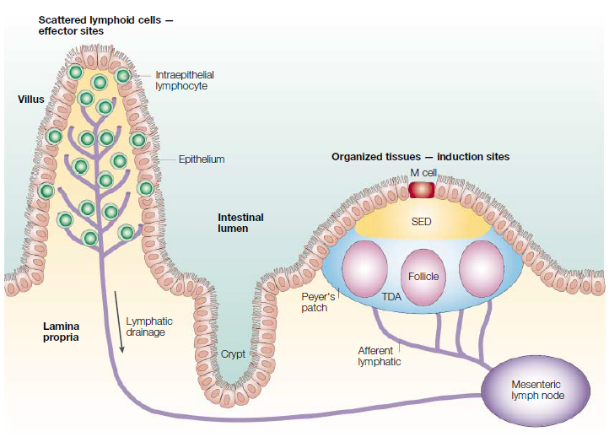
肠可以被视为不同细胞群,微生物群和微生物产物之间的共生相互作用的整合网络。肠相关淋巴组织是位于肠黏膜下的淋巴组织,主要由小肠派氏集合淋巴结(Peyer`s patch, PP),散在于整个肠道的独立淋巴滤泡(Isolated Lymphoid Follicle, ILF)及肠系膜淋巴结(Mesenteric Lymph Node, MLN)组成,是肠黏膜免疫细胞识别抗原和活化的部位。
四、肠相关免疫细胞
肠相关免疫细胞包括:
Granulocytes:Neutrophile, eosinophile
Monocytes:Macrophage, Dendritic cell
Lymphocytes:T lymphocytes、B lymphocytes、Innate lymphoid cells, ILCs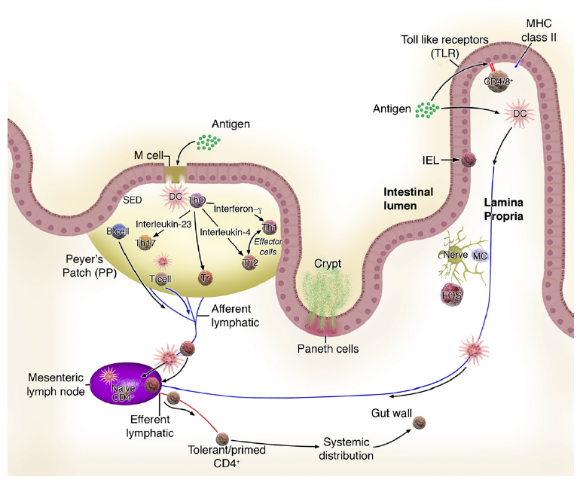
免疫细胞在肠道的变化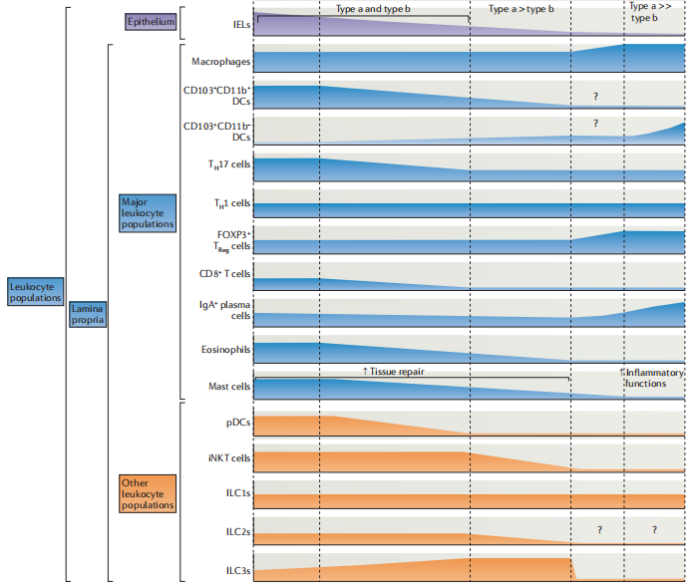
该图突出显示了小鼠肠道的区域免疫细胞表达,表明抗原含量(红色图),肠道相关淋巴组织(绿色图)和各种白细胞种群(蓝色和橙色图)沿肠道长度的频率如何变化 。问号表示尚未对其区域专业化进行特征化的区域。在人的肠道中观察到了相似的免疫细胞亚群,尽管此处它们在不同肠段中的相对比例仍然不清楚。
1、肠道免疫系统相关细胞:树突状细胞
在免疫系统中,树突状细胞(DC)是黏膜组织中启动和参与适应性免疫应答的重要细胞类型。在所有的黏膜组织中DC都十分丰富,大量地散在固有层。比起其他的免疫系统,黏膜免疫系统中的DC有其特征,并因所处微环境的不同而改变。
黏膜免疫系统中的DC种类很多,但功能上主要分为两类,分别称为效应性DC和调节性DC。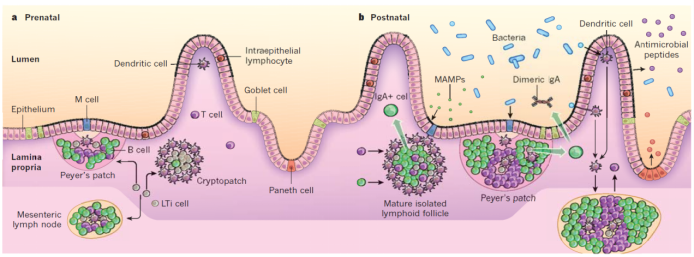
a.肠道树突状细胞的种类:
肠内免疫调节的最重要特征之一是在GALT的大部分区域存在独特的DC亚群。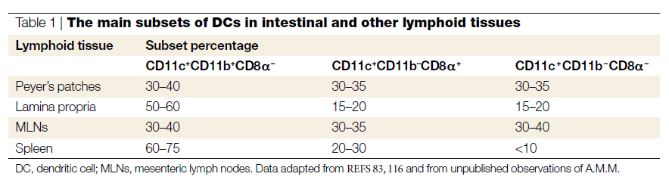

b.调节性DC的重要性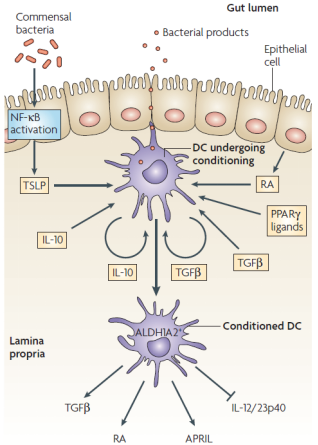

c.肠道DC的应答机制
调节性DC居多,机体处于稳态: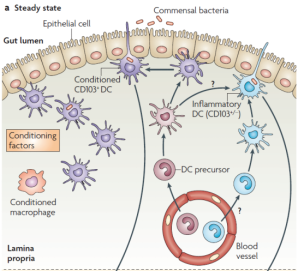

d.调节性DC居多,机体处于稳态:
2、肠道免疫系统相关细胞:T淋巴细胞
固有层T细胞绝大多数已被致敏,且完成了经由血循环的归巢过程。这些T细胞显示效应性T细胞或记忆性T细胞的表型,如人体中他们表达CD45RO、肠道归巢标志CCR9、整合素以及趋化因子CCL5(RANTES)的受体。固有层中CD4 T细胞与CD8 T细胞的比例为3:1或更大,与全身淋巴组织相似。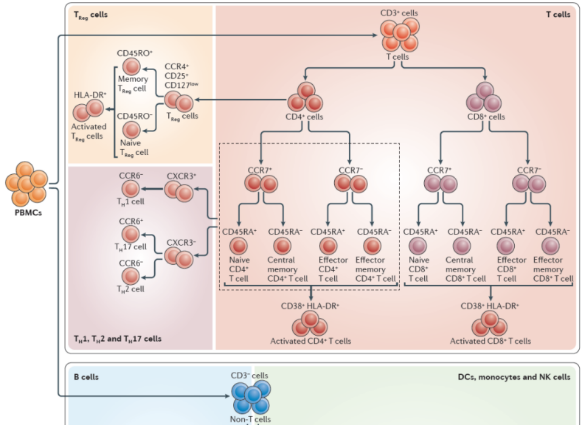
3、肠道免疫系统相关细胞:IgA+ B淋巴细胞
在健康人肠道粘膜固有层中分布有大量分泌IgA的浆细胞,在无病原体感染的情况下即可产生大量的IgA,因此IgA是黏膜免疫系统中的优势性抗体。但是在IgA缺乏的情况下,IgM可以替代IgA成为主导性抗体。
在人体中,单体形式和二聚体形式的IgA均有两种亚型,即IgA1和IgA2。不同组织中两者的比例不同,如在小肠为3:2,在结肠为2:3。大肠中产生IgA2的浆细胞数量比较多。
分泌型IgA的意义:
1. SIgA具有抑制微生物黏附于上皮组织的作用;
2. 在肠道粘膜表面的SIgA可以结合和中和病原微生物和毒素;
3. SIgA能够结合并中和已内化进入内体的抗原;
4. IgA-抗原复合物可以通过肝胆管途径排出体外;
5. SIgA能够增强M细胞对抗原的摄取和胞吞转运作用及促进派氏结中DC通过其FcaR受体摄取抗原。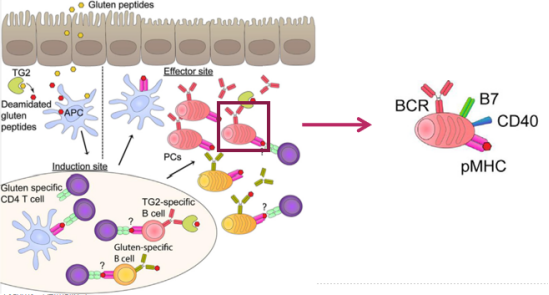
五、肠道中的细胞因子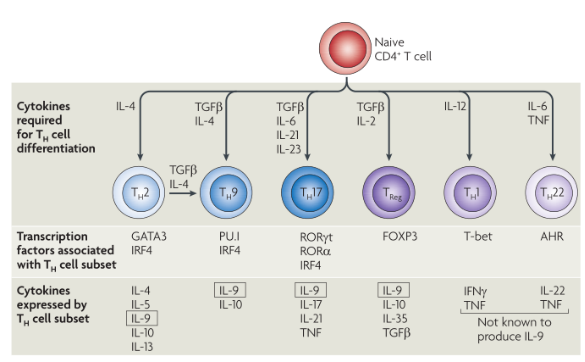
IEC对先天性和自适应性进行调节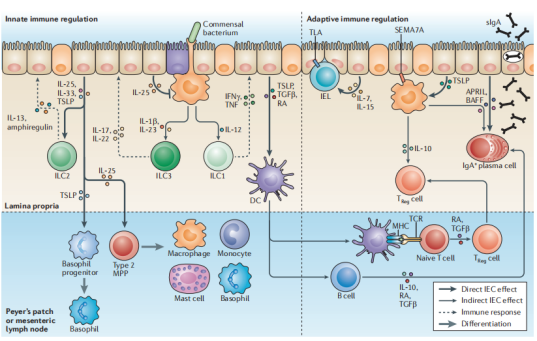
肠上皮细胞(IEC)衍生的细胞因子白介素25(IL-25)和胸腺基质淋巴细胞生成素(TSLP)分别引起嗜碱性粒细胞祖细胞和2型多能祖细胞(2MPP)的扩增和分化。IL-25,IL-33和TSLP刺激第2组先天性淋巴样细胞(ILC2s),而IL-25通过限制巨噬细胞产生促炎性细胞因子IL-1β,IL-12和IL-23来抑制先天性淋巴样细胞亚群1(ILC1)和ILC3的功能。IEC通过产生TSLP,转化生长因子-β(TGFβ)和视黄酸(RA)使树突状细胞(DCs)和巨噬细胞趋向于致耐受性表型。这些DC促进幼稚CD4 + T细胞分化为调节性T(TReg)细胞,并使B细胞成熟为分泌IgA的浆细胞。粘膜细胞来源的DC也通过RA的产生在启动的B细胞和T细胞上印有肠归巢表型。在运输到肠道后,TReg细胞的数量被巨噬细胞扩增,这些巨噬细胞通过TSLP介导的刺激以及与IEC表达的信号蛋白7A(SEMA7A)的接触依赖性相互作用而调节为产生IL-10。IEC和TSLP刺激的巨噬细胞和DC产生增殖诱导配体(APRIL)和B细胞活化因子(BAFF)促进了肠固有层B细胞的类转换重组和IgA的产生。 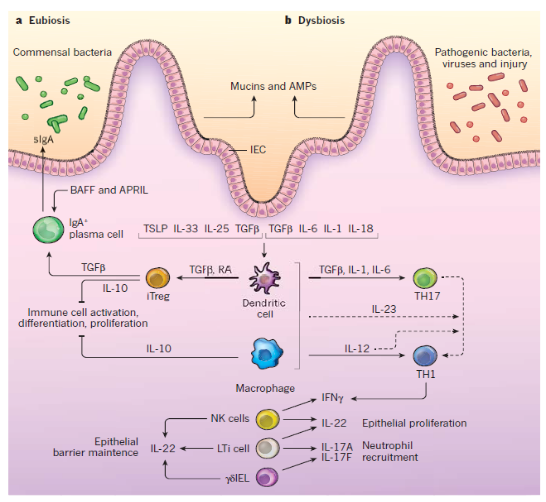
a,在对微生物群的反应中,IEC分泌粘蛋白和AMP,它们限制了微生物与上皮细胞的相互作用。在稳态,优生条件下,MAMP通过促进致耐受性巨噬细胞和树突状细胞发育的IEC刺激细胞因子(包括TSLP,IL-33,IL-25和TGFβ)的分泌。反过来,树突状细胞通过依赖TGF-β和视黄酸(RA)的过程诱导诱导的Treg(iTreg)细胞的发育。通过多种机制,包括iTregcells分泌TGFβ和IL-10以及巨噬细胞分泌IL-10,可通过抑制或减弱潜在的效应反应来维持肠道的抗炎平衡。另外,源自Treg细胞的TGF-β以及源自上皮的BAFF和APRIL促进IgA +浆细胞的发育,以确保管腔中大量的sIgA供应,这进一步限制了微生物与上皮的相互作用。
b,面对病原体入侵,粘膜损伤或营养不良,MAMPs刺激IEC(包括IL-6,IL-1和IL-18)以及引起其发育的肠道树突状细胞和巨噬细胞(包括IL-6,IL-23和IL-12)分泌促炎性细胞因子。CD4 + T细胞效应细胞TH1和TH17,由于IL-23或IL-12信号转导,后者可以转变为前者。肠道先天淋巴样细胞,包括NK样细胞,LTi细胞和γδIEL,对促炎性细胞因子作出反应,从而上调IL-22(有助于保护上皮屏障)以及IL-17A和IL-17F中性粒细胞募集。
六、肠道免疫与疾病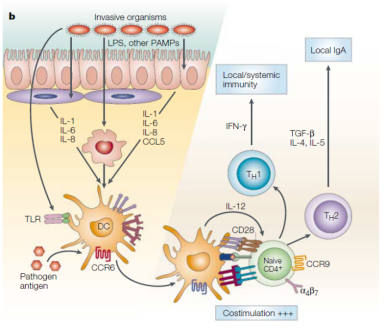
1、肠道稳态失衡
食物蛋白和共生细菌的产物被树突细胞(DC)吸收,并且在没有炎症的情况下,这些T细胞分化成调节性T细胞,其产生IL-10和干扰素-γ(IFN-γ),和/或T辅助细胞(TH)3,其产生TGF-β。
当遇到病原体时,派氏结或固有层中的DC在吸收抗原并产生IL-12后完全成熟。在迁移至MLN后,这些DC引发肠道归巢TH1细胞,其产生IFN-γ并引起进一步的炎症。
2、肠道其他相关疾病
炎症性肠炎(inflammatory bowel disease)是一类异质性的慢性弥漫性肠道炎症,与针对共生菌的免疫失调相关,其主要包括节段性回肠炎(Crohn`s disease)和溃疡性肠道炎症(ulcerative colitis)。该疾病主要见于遗传易感个体,涉及多种免疫学异常。
克罗恩病(Cohn's disease, CD)是一类病因和发病机制尚不完全清楚的胃肠道慢性炎症性肉芽肿性疾病。
溃疡性结肠炎(ulcerative colitis,UC)是一种病因尚不十分清楚的直肠和结肠慢性非特异性炎症性疾病。病变主要限于大肠粘膜与粘膜下层。临床表现为腹泻、粘液脓血便、腹痛。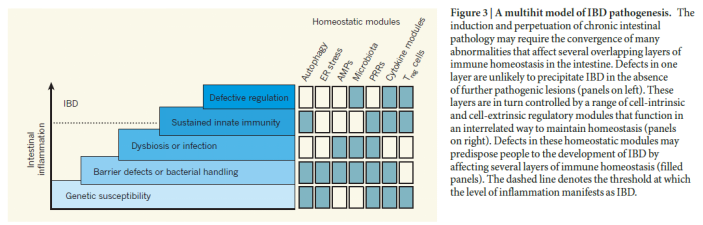
3、IBD发病机制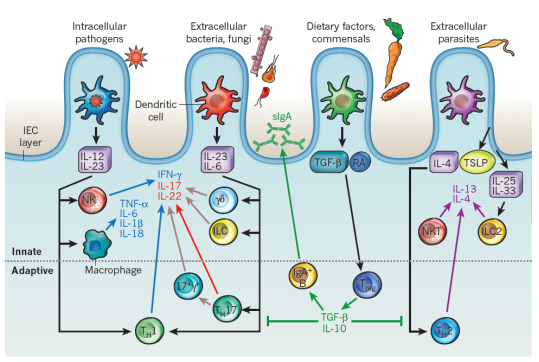
肠道共生菌群失调:由于遗传及环境变化(饮食、感染及抗生素)造成的肠道共生菌群变化可导致宿主的免疫应答异常;
Th17和Th1应答异常:肠道发生菌群失调造成免疫细胞的异常活化,促炎性因子大量产生;
Treg功能缺陷;自噬相关基因及参与内质网应激性未折叠蛋白质相关基因的调控异常。
产品推荐:
|
货号 |
产品名称 |
规格 |
|
|
CBA |
BD™ Cytometric Bead Array (CBA) Human Th1/Th2/Th17 CBA Kit |
80T |
|
|
BD™ Cytometric Bead Array (CBA) Mouse Th1/Th2/Th17 CBA Kit |
80T |
Mouse T Cell 骨架Panel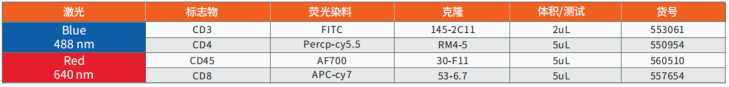
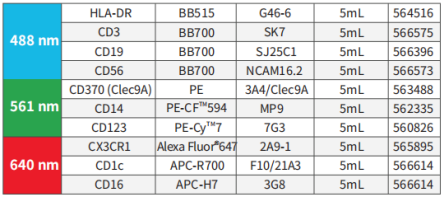
Human DC骨架panel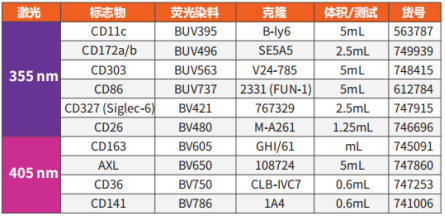










 危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)
危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)  营业执照(三证合一)
营业执照(三证合一)