大家好,上期给大家介绍了外泌体纯化方式之免疫磁珠方法。本期小编给大家介绍另外两种外泌体纯化的方法: 一、聚合物沉淀法;二、商品化试剂盒法纯化外泌体。
一 ● 聚合沉淀法
1.原理
聚合物沉淀法是一种常用的外泌体分离方法。类似于乙醇介导的核酸沉淀,高度亲水的聚合物与外泌体周围的水分子相互作用,形成疏水性微环境,从而导致外泌体沉淀[1]。在各种亲水性聚合物中,聚乙二醇(PEG)是一种众所周知的,无毒的聚合物,具有重塑周围材料的水溶性的能力,已被普遍使用[2]。
现有的基于聚合物的外泌体沉淀方法通常采用分子量为6,000至20,000 Da的PEG [2]。首先,需要进行预处理以去除大的污染物颗粒,例如细胞碎片和凋亡小体,然后将预处理过的样品与PEG溶液在4°C下孵育过夜[3]。接下来,通过低速离心(1500×g)收集沉淀的外泌体(图),有了这样简单明了的方案,该方法已被广泛用于从各种类型的样品(例如血液,细胞培养基,脑脊液,尿液和腹水)中分离外泌体[1,4,5]。由于聚合物沉淀法不需要复杂的设备,因此该方法可以轻松扩展到大批量制备,并且收率很高。这种方法还可以通过整合各种检测平台进行外来体(或蛋白质/遗传物质含量)分析的快速疾病诊断[6]。
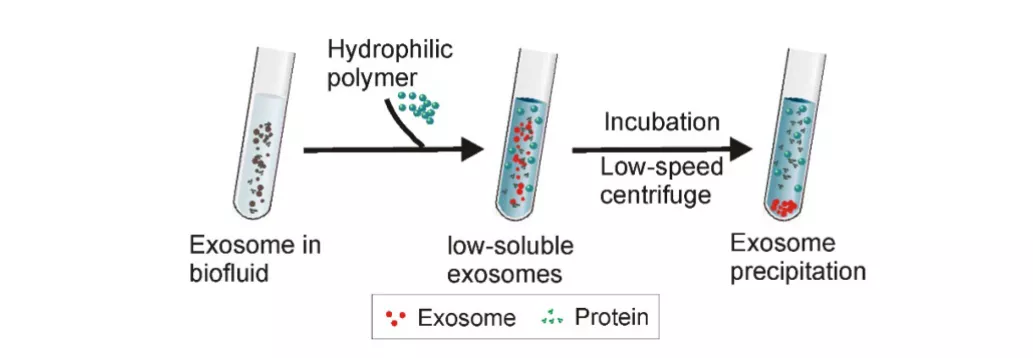
图.将高亲水性聚合物添加到含外泌体的溶液中后,外泌体周围的水分子被聚合物束缚,降低了外泌体的溶解度并诱导其沉淀;低速离心后收集外泌体[7]
通常,基于聚合物沉淀的外泌体分离的特征在于高产率。如最近使用尿液样本进行的比较研究所示,与差分超速离心和超滤方法相比,聚合物沉淀实现了最高的外泌体产量和遗传含量(即miRNA和mRNA),可用于后续的分析[8]。
2.实验步骤
-
将来自细胞培养物的含囊泡培养基在500 g离心5min,然后在4°C 2000 g离心30min,以除去细胞碎片和大的凋亡小体。
-
将培养基加入到等体积的2x PEG溶液中,以达到所需的最终PEG浓度(5-15%)。
-
加入2x PEG溶液后,通过反转将样品充分混合,并在4°C下孵育过夜(至少12小时)
-
第二天,将样品在台式离心机中以最大速度在4°C下离心1h。然后倒出锥形管,并排干五分钟,不时敲击以除去过量的PEG。
-
将得到的沉淀物悬浮在50–500μL的无颗粒PBS(pH 7.4)中。
-
然后将样品亚组保存在-80°C中,或通过使用较低浓度的PEG进行第二次PEG沉淀进一步纯化,或通过重新悬浮在PBS中并以100,000 g离心的方式洗涤和重新沉淀囊泡。(对于前一组样品,将初次PEG处理产生的沉淀物稀释在5 mL PBS中。加入等体积的2x PEG溶液,这次将最终PEG的浓度降低到5%;将后面的样品悬浮在1 mL PBS中,超速离心(100,000 g)70min,以洗涤污染性蛋白质和PEG的颗粒。)
-
最后,通过在室温下摇动最多30min,将所有样品重新悬浮在无颗粒PBS中[9]。
3.相关产品
| 产品 | 说明 | 货号 |
| miRCURY Exosome Serum/Plasma Kit | 沉淀法,从血清或血浆中提取外泌体及其他胞外囊泡 | 76603 |
| miRCURY Exosome Cell/Urine/CSF Kit | 沉淀法,从细胞培养上清、尿液及CSF中提取外泌体及其他胞外囊泡 | 76743 |
-
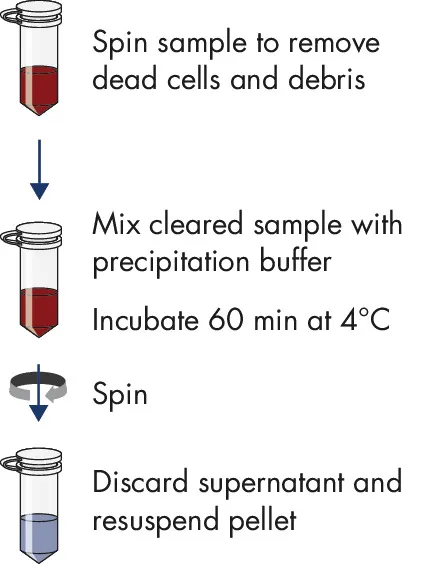
使用沉淀法,从不同起始材料中进行外泌体提取miRCURY Exosome Cell/Urine/CSF Kit(76743);尿液样本2-10 ml, CSF样本1 ml,细胞培养液1-10 ml miRCURY Exosome Serum/Plasma Kit
-
(76603):血浆/血清0.2-1.4 ml
-
2小时内完成外泌体提取
-
无需高速离心及酚/氯仿提取
-
适用于多种应用,如miRNA或RNA profiling
二 ● 商品化试剂盒-QIAGEN膜亲和法
1.原理
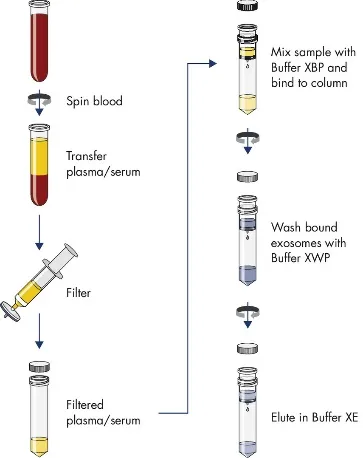
exoEasy Maxi Kit使用基于膜的亲和力结合步骤从血清,血浆或细胞培养上清液中分离出外泌体和其他EV。该方法不能通过大小或细胞来源来区分EV,也不依赖于特定表位的存在。相反,它利用了囊泡的一般生化特征,可以通过恢复样品中存在的细胞外囊泡的整个光谱范围来区分。因此,在开始实验方案之前,必须通过离心或过滤样品来完全去除细胞,细胞碎片,凋亡小体等。再结合随后的洗涤步骤,囊泡以外的颗粒状物质,例如血浆和血清中特别丰富的较大的蛋白质复合物,被大量去除。清洗柱膜后,将完整的囊泡在主要含有无机盐的水性缓冲液中洗脱,然后准备用于物理或生化分析。
| 产品 | 说明 | 货号 |
| exoEasy Maxi Kit (20) | 过柱法,直接从样本里面得到外泌体里面的RNA,4ml上样量 | 76064 |
-
适用于功能性检测及物理和生化分析
-
可在25min内纯化获得exosome及其他细胞外囊泡
-
可通过简单的离心柱实验方案平行处理多个样品
-
可提取高达4 ml的血浆或血清,或者32 ml的细胞培养上清
实验步骤
-
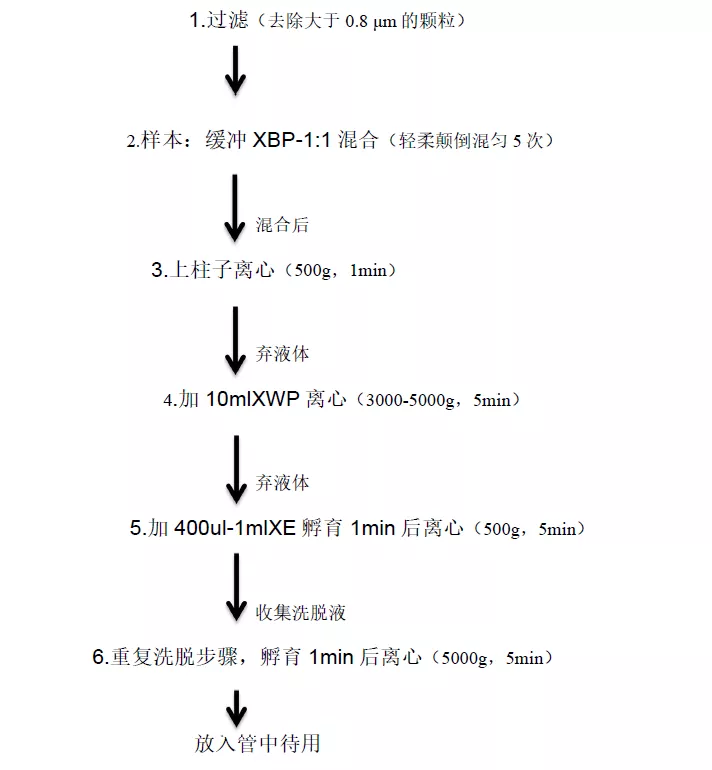
推荐使用预过滤的血浆或细胞培养上清液。需要通过过滤去除大于0.8 μm的颗粒
-
按照样本:缓冲XBP为1:1的比例混合,轻柔颠倒混匀5次。并使混合液达到室温。
-
将样本和缓冲XBP的混合液加入到柱子中,500g离心1 min。丢弃离心得到的液体,并将柱子重新放入收集管。
-
加入10 ml缓冲液XWP,5000g离心5 min,去除柱子中剩余的液体。丢弃收集管及其中的液体。
-
将柱子转移到新的收集管中
-
向柱子中的膜上加入400 μl – 1 ml缓冲液XE,孵育1 min。500 g离心5 min,收集洗脱液。
-
重复洗脱步骤,孵育1 min。5,000 g离心5 min。将洗脱液转移到合适的管中待用。
三、技术优势

参考文献
1.Martins TS, Catita J, Rosa IM, Silva OABDE, Henriques AG. Exosome isolation from distinct biofluids using precipitation and column-based approaches. PloS one. 2018; 13.
2. Garcia-Romero N, Madurga R, Rackov G, Palacin-Aliana I, Nunez-Torres R, Asensi-Puig A, et al. Polyethylene glycol improves current methods for circulating extracellular vesicle-derived DNA isolation. Transl Med Commun. 2019; 17: 6.
3. Dou YQ, Kong P, Li CL, Sun HX, Li WW, Yu Y, et al. Smooth muscle SIRT1 reprograms endothelial cells to Theranostics. 2020; 10: 1197-212.
4. Kanchi Ravi R, Khosroheidari M, DiStefano JK. A modified precipitation method to isolate urinary exosomes. J Vis Exp. 2015: 51158.
5. Wan Z, Zhao LB, Lu F, Gao XT, Dong Y, Zhao YX, et al. Mononuclear phagocyte system blockade improves therapeutic exosome delivery to the myocardium. Theranostics. 2020; 10: 218-30.
6. Merdalimova A, Chernyshev V, Nozdriukhin D, Rudakovskaya P, Gorin D, Yashchenok A. Identification and analysis of exosomes by surface-enhanced raman spectroscopy. Appl Sci (Basel) 2019; 9.
7.D. Yang, W. Zhang, H. Zhang, F. Zhang, L. Chen, L. Ma, L.M. Larcher, S. Chen, N. Liu, Q. Zhao, P.H.L. Tran, C. Chen, R.N. Veedu, T. Wang, Progress, opportunity, and perspective on exosome isolation - efforts for efficient exosome-based theranostics, Theranostics 10(8) (2020) 3684-3707.
8. Patel GK, Khan MA, Zubair H, Srivastava SK, Khushman M, Singh S, et al. Comparative analysis of exosome isolation methods using culture supernatant for optimum yield, purity and downstream applications. Sci Rep. 2019; 9: 5335.
9.M.A. Rider, S.N. Hurwitz, D.G. Meckes, Jr., ExtraPEG: A Polyethylene Glycol-Based Method for Enrichment of Extracellular Vesicles, Sci Rep 6 (2016) 23978.










 危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)
危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)  营业执照(三证合一)
营业执照(三证合一)