这一期给大家介绍一篇蛋白纯化简单上手的文章,这篇文章思路清晰,实验方法基础易掌握,适合我们初入蛋白纯化领域的小白,做几个实验,也能轻松发篇小文章,一起来看看吧!

原文链接:https://pubmed.ncbi.nlm.nih.gov/30904445/
研究摘要
Hispidalin是一种从Benincasa hispida的种子中分离得到的新型抗菌肽,对各种细菌和真菌病原体有广泛的抗菌活性。为了获得大量Hispidalin,研究者构建带有N端6×His tag和肠激酶序列的重组Hispidalin,成功在Escherichia coli和 Pichia pastoris cell中表达。结果表明,大肠杆菌来源的重组Hispidalin对所有菌株均无抗菌活性,而Pichia pastoris来源的重组Hispidalin(以下简称rhipidalin)对5种革兰氏阴性和革兰氏阳性病原菌均具有广泛的抗菌谱。研究表明rhipidalin具有抗菌活性,40min内能完全杀死所有金黄色葡萄球菌,也具有较强的热稳定性和PH稳定性,对胰蛋白酶和蛋白酶K具有耐药性,对胃蛋白酶和木瓜蛋白酶敏感度较弱,此外,rhipidalin能有效的渗透细胞膜,破坏细菌细胞的形态,经过初步优化,rhipidalin产出浓度高达98.6 µg/ml,这个结果表明rhipidalin可以被P. pastoris细胞大量生产,并且rhipidalin作为一种新的抗菌剂具有巨大的潜力和发展前景。
研究内容
1. 细菌来源的重组Hispidalin的表达、纯化及抗菌活性研究
Fig. 1A.是表达融合肽基因的核苷酸序列和预测的氨基酸序列,该研究利用0.2 mM IPTG诱导大肠杆菌BL21后,获得一条分子量约为32 KDa的蛋白条带,表明重组GST-Hispidalin在大肠杆菌中成功表达,获得重组的肽段利用亲和层析法进行纯化,用抑菌圈实验对纯化的细菌来源的Hispidalin和无GST标记的Hispidalin单体进行抑菌活性检测,结果显示它们都没有抑菌活性,即大肠杆菌可能不是一个生产均有抑菌功能活性Hispidalin的“工厂”。

Fig. 1. (A) The Hispidalin nucleotide sequence and its corresponding amino acid sequence
2. 酵母来源的重组Hispidalin的表达、纯化及抗菌活性研究
经过电击和梯度筛选,通过PCR确认了8个含有rhipidalin编码序列的转化子(见Fig. 1B,Lane M:DNA marker,Lane P: pPICZ αA-Hispidalin阳性对照,Lane N: pPICZ αA-containing GS115细胞阴性对照,Lanes 1-8是抗博来霉素转化子),随机选取一个转化子,在28℃下用1.5%纯甲醇连续诱导表达144h,为了验证酵母表达的rhipidalin的抗菌活性,收集培养96h上清液做抑菌圈的检测,Fig. 1C是L. monocytogenes (A TCC 21633)和B. subtilis L300-1抑菌圈实验,结果表明rhipidalin有较明显的抑菌效果。

Fig. 1. (B) rHispidalin-positive transformant screening by colony-PCR (C) Inhibition zone assay
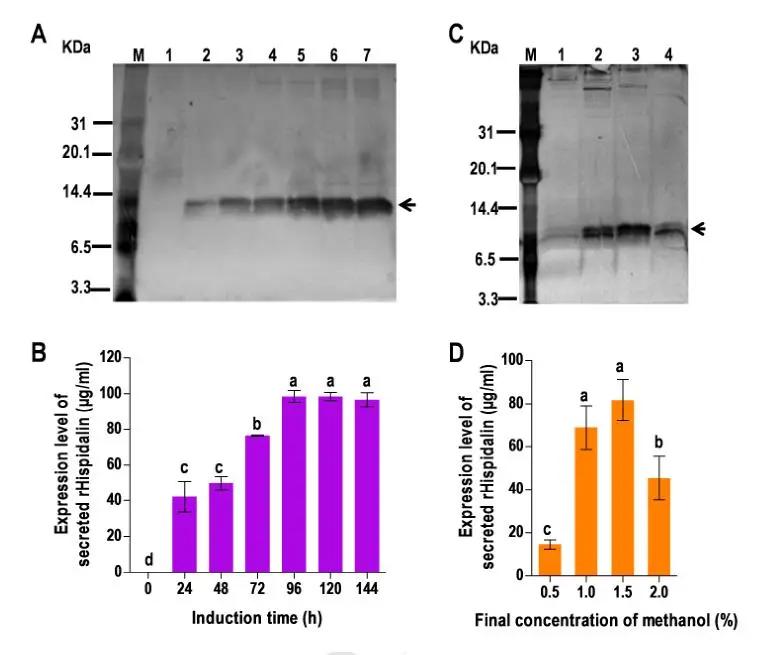
Fig. 2. Effects of induction time and methanol concentration on rHispidalin expression.
此外,该研究也验证了诱导后培养上清rHispidalin的表达,不同的诱导时间(24、48、72、96、120和144 h)下均出现一条6.5至14.4 KDa之间蛋白条,该条带近似于预测的分子量为7.9 KDa,这个结果表明rHispidalin在P.pastoris GS115细胞中成功表达(Fig. 2A)。
Fig. 2B是不同的诱导时间下,P . pastoris细胞分泌的rHispidalin表达水平,结果显示诱导时间为24h开始,rHispidalin表达开始上升,96h达到峰值,浓度为98.6µg/ml,因此,优化培养时间是96h。Fig. 2C(Lane M:marker,Lanes 1-4:培养上清(18 µl),用0.5、1.0、1.5和2.0 % (v/v)纯甲醇诱导,诱导时间96h),Fig. 2D是诱导时间96h,不同浓度的诱导剂甲醇的作用下,rHispidalin表达水平,Fig. 2C和Fig. 2D的结果表明优化后诱导剂甲醇的浓度为1.5%。上述结果表明,P . pastoris细胞是一个合适生产rHispidalin的“工厂”。
3. rHispidalin的纯化及抗菌谱和能力测定
为了研究rHispidalin的抑菌能力,P . pastoris G115培养在28°C, 220 rpm,pH 6.0,用1.5% (v/v)甲醇诱导96小时,取上清提取rHispidalin蛋白,用亲和层析柱Ni Sepharose™ 6 Fast Flow纯化 。Fig. 3. (A)是用梯度浓度的咪唑洗脱得到的纯化rHispidalin,结果说明500 mM的咪唑能有效洗脱rHispidalin,500ML的细胞培养液,最终得到纯度为90.7%、约10.2 mg的rHispidalin。Fig. 3. (B)是利用rHispidalin作用于体外培养的金黄色葡萄球菌检测其杀菌能力,图中分为三组,空白对照(黑色曲线),金黄色葡萄球菌与rHispidalin(浓度为4×MIC)共孵育(红色),金黄色葡萄球菌培养基中加入50 µg/ml庆大霉素(绿色),rHispidalin不仅能抑制细菌生长,还能杀死细菌。

Fig. 3. (A) Silver-stained Tricine-SDS-PAGE to visualize rHispidalin purified in P . pastoris (B) Killing kinetics of rHispidalin against S. aureus (A TCC 25923) in vitro
4. rHispidalin的溶血活性
Fig. 4是rHispidalin作用于人类红细胞和小鼠红细胞,检测其溶血活性,当rHispidalin浓度为100µg/ml时,没有明显的溶血活动,而当浓度升高至300µg/ml,溶血率仍然低于2%。小鼠红细胞溶血活性检测得到相似的结果,因此该结果表明rHispidalin对高级动物红细胞的溶血活性较低。

Fig. 4. Hemolytic activity of rHispidalin against (A) human erythrocytes and (B) mouse erythrocytes
5. rHispidalin对pH、温度和蛋白酶的稳定性研究
为研究rHispidalin的稳定性,采用不同pH值、不同温度、四种蛋白酶消化的方法,测定了rHispidalin对金黄色葡萄球菌(S. aureus, TCC 25923)的抑菌活性。温度范围设置为4至100℃,溶解在pH值为2至10的溶液中,Fig. 5A, B结果显示rHispidalin与未处理组有相似的抑菌效力,说明rHispidalin具有较高的热稳定性,在较宽的pH范围内具有较高的稳定性。Fig. 5C是在37℃下用不同的蛋白水解酶处理2 h后,可以清楚地观察到抑菌圈直径的变化(图5C)。rHispidalin对胃蛋白酶和木瓜蛋白酶的抑制圈直径分别下降到未处理组的60%和50%,说明rHispidalin对胃蛋白酶和木瓜蛋白酶敏感,而对胰蛋白酶和蛋白酶K不敏感,综上所述,rHispidalin对pH变化、温度冲击和蛋白酶消化均有不同程度的耐受性。
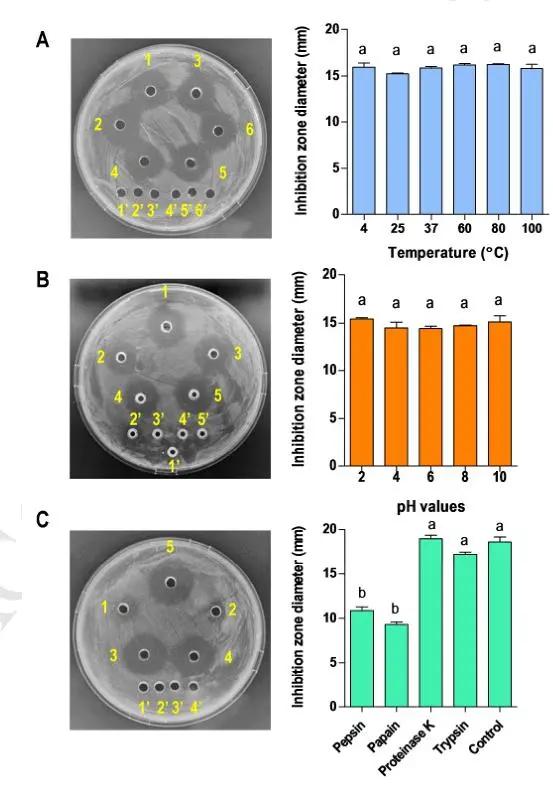
Fig. 5. Effects of temperature, pH and proteinase treatments on the antibacterial activity of rHispidalin against S. aureus (ATCC 25923).
6. 扫描电子显微镜(SEM)分析
通过扫描电镜观察rHispidalin对金黄色葡萄球菌(ATCC 25923)和大肠杆菌(ATCC 35150)表面形态的影响,以确定rHispidalin的抗菌作用模式。Fig. 6A是用PBS、1×MICrHispidalin和4×MICrHispidalin处理金黄色葡萄球菌(ATCC 25923)和大肠杆菌(ATCC 35150),结果显示PBS处理的细菌细胞表面正常、光滑、完整,金黄色葡萄球菌细胞在1×MICrHispidalin和4×MICrHispidalin处理后出现褶皱,大肠杆菌(ATCC 35150)细胞经处理后表面粗糙,有许多明显的凹痕。

Fig. 6. (A) Morphological changes of S. aureus (ATCC 25923) and E. coli O157 (ATCC 35150) treated with PBS, 1×MIC Hispidalin or 4×MIC Hispidalin.(B) Fluorescent microscope analysis of propidium iodide (PI) uptake during the membrane permeabilization assay
7. 细菌膜破坏活性测定
Fig. 6B是荧光显微镜分析膜透性试验中碘化丙啶(PI)的摄取情况,DIC-PBS:PBS处理细菌细胞的光镜图像,红色的PBS和4×MIC分别代表用PBS和4×MIC rHispidalin处理的细菌细胞的荧光图像,从结果看与PBS处理的细菌细胞相比,rHispidalin处理的金黄色葡萄球菌(ATCC 25923)和大肠杆菌(ATCC 35150)细胞的胞质PI显著增加,表明rHispidalin可以渗透大肠杆菌和金黄色葡萄球菌的胞质膜,这一结果与扫描电镜(SEM)的结果一致,提示rHispidalin介导的膜破坏机制可能是其抗菌能力增强的重要原因。
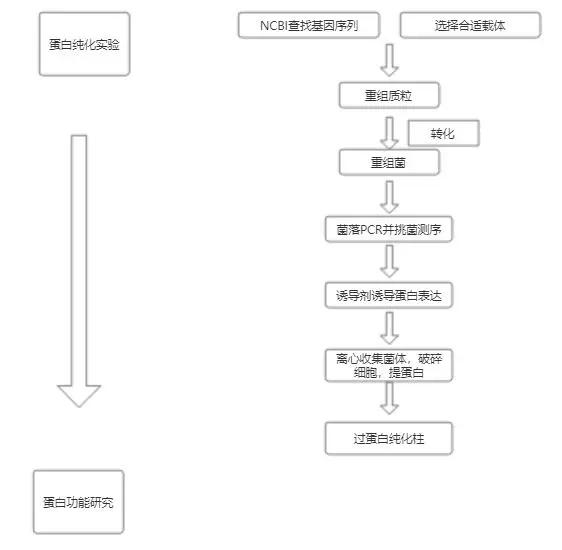
技术路线










 危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)
危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)  营业执照(三证合一)
营业执照(三证合一)