蛋白纯化中,载体构建是非常重要的一步。选择什么载体和标签,很大程度上关系到后面蛋白的表达效率和纯化纯度。今天小编就和大家一起看一下载体如何选择吧~

本研究主要比较了两种不同的原核表达载体pET-28b和pGEX-6p-1对CP05-GFP融合蛋白的诱导表达及其纯化的效率。其中,pET-28b表达载体含两个His标签,大小为0.84KD,具有有利于纯化、能纯化可溶性/包涵体蛋白且标签小、对重组蛋白无影响等优点。pGEX-6p-1表达载体含一个GST标签,大小为26kD,其具有增强蛋白可溶性,屏蔽毒性蛋白等优点,同时具有仅能纯化可溶性蛋白且标签较大,对重组蛋白的影响较大的缺点。
表达载体的构建
对于pET-28b原核表达载体,本研究设计了两种引物:一种是在融合蛋白两端都含有His-tag,另一种是只在融合蛋白的N端含有His-tag。具体序列如下:
(双His-Tag)CP05-GFP-F:
CGGGATCCATGGTGAGCAAGGGCGAGGAGCTGT;
(双His-Tag)CP05-GFP-R:
CGGAATTCCTTGTACAGCTCGTCCAT;
(单His-Tag)CP05-GFP-F:
CGGGATCCATGGTGAGCAAGGGCGAGGAGCTGT;
(单His-Tag)CP05-GFP-R:
CGGAATTCCTCTTGTACAGCTCGTCCAT;
(GST-Tag)CP05-GFP-F:
GATCGGTGGTGGTGGTAGCTGTCGGCATTCTCAGATGACTGTGACGTCTCGTTTGTGA;
(GST-Tag)CP05-GFP-R:
TCGATCACAAACGAGACGTCACAGTCATCTGAGAATGCCGACAGCTACCACCACCACC。
利用PCR扩增获得目的片段并进行琼脂糖凝胶电泳验证,结果如下:
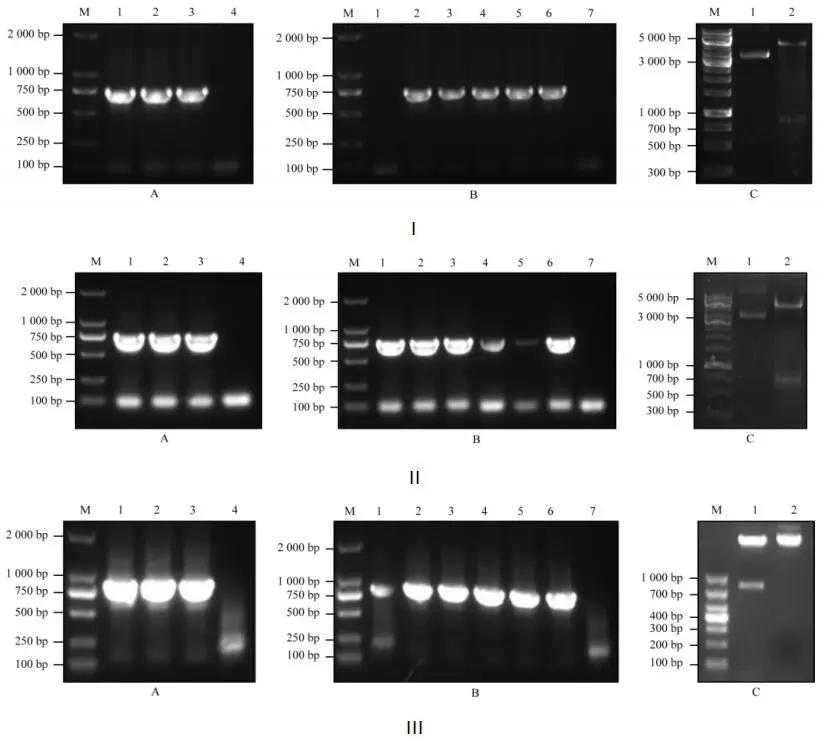
图1:载体构建
ⅠA1~3,ⅡA1~3,ⅢA1~3:PCR扩增产物;ⅠA4,ⅡA4,ⅢA4:PCR扩增阴性对照;ⅠB1~6、ⅡB1~6、ⅢB1~6:菌落PCR扩增产物;ⅠB7,ⅡB7,ⅢB7:菌落PCR阴性对照;ⅠC1,ⅡC1,ⅢC2:原质粒;ⅠC2,ⅡC2,ⅢC1:双酶切产物
不同标签目的蛋白的诱导表达
原核表达载体构建成功后,经感受态细胞转化,大肠杆菌培养后,加入不同浓度的IPTG诱导,裂解菌跑SDS-PAGE,用考马斯亮蓝染色检测是否有目的蛋白的表达。
通过比较CP05-GFP(双His-Tag)蛋白、CP05-GFP(单His-Tag)蛋白与CP05-GFP(GST-Tag)蛋白的表达量,本研究发现CP05-GFP(GST-Tag)蛋白的表达量最高,CP05-GFP(单His-Tag)蛋白的表达量次之,CP05-GFP(双His-Tag)蛋白的表达量最低(图2)。
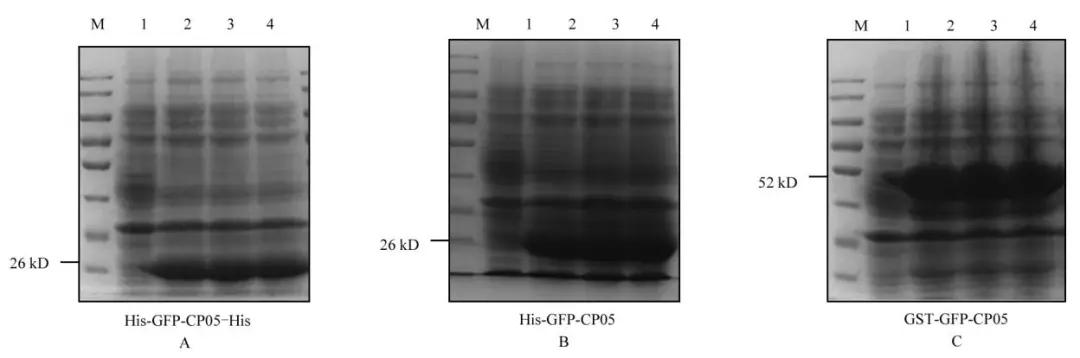
图2:目的蛋白的诱导表达
1,2,3,4:IPTG的浓度为0mmol/L,0.3mmol/L,0.5mmol/L,0.8mmol/L;A:CP05-GFP(双His-Tag)蛋白的诱导表达检测;B:CP05-GFP(单His-Tag)蛋白的诱导表达检测;C:CP05-GFP(GST-Tag)蛋白的诱导表达检测
不同标签目的蛋白的纯化
将经考马斯亮蓝染色检测能表达目的蛋白的菌株接种到含卡那霉素或氨苄青霉素的新鲜LB液体培养液中。将含有诱导剂IPTG的培养液于37℃、200r/min条件培养6h后进行目的蛋白纯化。将纯化蛋白过程中各步骤所收集的30μL样品制样,配制SDS-Page,利用考马斯亮蓝染色检测纯化效果。
CP05-GFP(双His-Tag)蛋白的纯化效率高于CP05-GFP(单His-Tag)蛋白的纯化效率,并且CP05-GFP(GST-Tag)蛋白的纯化效率显著高于CP05-GFP(双His-Tag)蛋白的纯化效率(图3)。
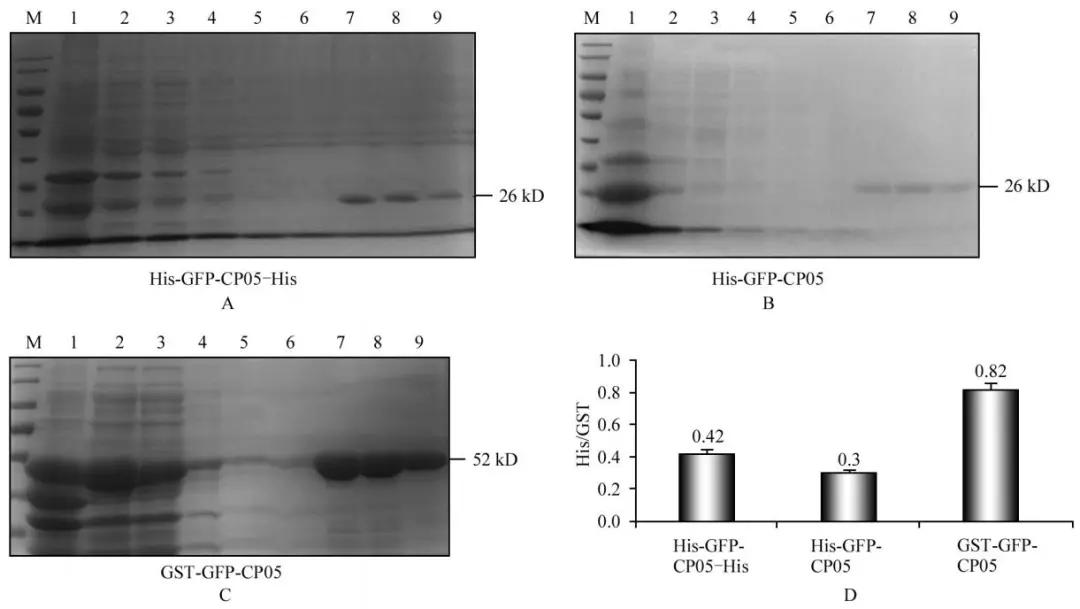
图3:His/GST标签蛋白纯化效果及目的蛋白纯化效率的比较
A,B,C:M:Marker;1:细菌裂解沉淀;2:细菌裂解液;3:过柱液;4:洗涤液1;5:洗涤液2;6:洗涤液3;7:洗脱液1;8:洗脱液2;9:洗脱液3;A:CP05-GFP(双His-Tag)蛋白的纯化;B:CP05-GFP(单His-Tag)蛋白的纯化;C:CP05-GFP(GST-Tag)蛋白的纯化;D:His/GST标签蛋白纯化效率
通过引物设计、载体构建、表达鉴定及蛋白纯化我们发现:pET-28b-CP05-GFP(双His-Tag)原核表达系统能够表达并纯化出CP05-GFP蛋白,但其表达量低易纯化;pET-28b-CP05-GFP(单His-Tag)原核表达系统能够表达并纯化出CP05-GFP蛋白,其表达量高但不易纯化:pGEX-6p-1-CP05-GFP(GST-Tag)原核表达系统可表达出足量的CP05-GFP(GST-Tag)蛋白,并且易纯化。但是,就后续的应用而言,虽然CP05-GFP(GST-Tag)蛋白的表达和纯化的效率最高,但是GST-tag比较大,对后续的应用影响比较大,因此,可以根据后续研究目的的需要对GST-tag进行酶切试验。His-tag比较小,对表达出的目的蛋白影响比较小,但是其表达和纯化效率不理想。综上,可根据研究目的选择合适的载体进行融合蛋白的表达和纯化。
没有任何一款载体是所有蛋白通吃的,因此我们需要根据具体的实验要求来进行选择,比如说所需纯度、实验器材、经济成本等等。
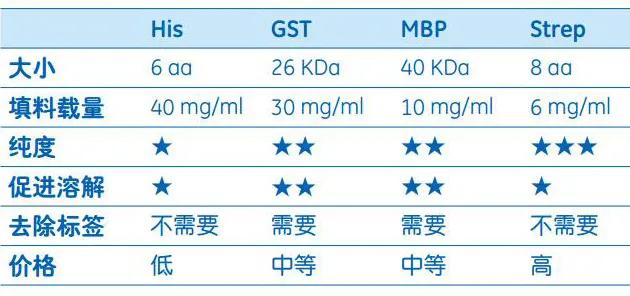
最后,附上亲和层析常用的四种标签的区别,方便大家的选择。
相关产品
| 货号 | 名称 | 特性 |
| 17524802 | Histrap HP 5*5ml | His标签预装柱 |
| 17526801 | Ni Sepharose HP 25ml | His标签填料 |
| 17531801 | Ni Sepharose 6FF 25ml | His标签填料 |
| 17528202 | GSTrap HP 5*5ml | GST标签预装柱 |
| 17075601 | Glutathione Speharose 10ml | GST标签填料 |
参考文献:
[1] 邱淑彬,荆韧威,郭正隆,谢晓东.两种不同的原核表达载体蛋白表达及纯化的比较[J].基因组学与应用生物学,2020,39(09):4136-4144.
[2] Gao X.J., Ran N., Dong X., Zuo B.F., Yang R., Zhou Q.B., Moulton H.M., Seow Y.Q., and Yin H.F., 2018, Anchor peptide captures, targets, and loads exosomes of diverse origins for diagnostics and therapy, Sci. Transl. Med., 10(444): 195










 危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)
危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)  营业执照(三证合一)
营业执照(三证合一)