小分子一直是分子互作研究的热门对象,通常指分子量小于1000道尔顿的分子,如化药、中药、多肽、植物激素、金属离子等。小分子相互作用检测由于其分子量小,响应值低,亲和力弱等特点,对仪器灵敏度提出了很高的要求。Biacore灵敏度最高可达0.015RU,无分子量检测下限,优于市面同类产品技术上百倍,一天可分析多达400个样品。因此,Biacore成为了小分子互作检测的必备工具。
Biacore在小分子领域的研究涉及了生命活动的很多方面,如:
(1) 化药研发
(2) 多肽研究
(3) 中药活性成分研究
(4) 植物激素
(5) 食品含量测定
(6) 农药残留检测
(7) 疾病的分子机理研究等
接下来使用BiacoreT200仪器,解析蛋白与小分子互作实验操作流程。
Biacore T200 检测蛋白与小分子互作操作指南
实验前准备
• S 系列 CM5 芯片,货号:29-1049-88( 一片装 )、BR-1005-30( 三片装 )、29-1496-03( 十片装 ),若蛋白与小分子的分子量比大于 100,换用 S 系列 CM7 芯片。( 注:每张芯片若一次性使用,可检测三对不同的互作,若再生后重复使用,只要蛋白一直有活性,就可一直使用 )。
• 氨基偶联试剂盒( 货号:BR-1000-50),( 注:里面的 EDC 和NHS,溶解后,200ul 每管分装,-20℃冻存, 后续实验前,各取一管融化后使用即可 )。
• 偶联 Buffer:10mM 醋酸钠 pH4.0( 货号:BR-1003-49) 或 10mM 醋酸钠 pH4.5( 货号:BR-1003-50)。
• 缓冲液:10 x PBS-P+ ( 货号:28-9950-84)。
• 分析纯 DMSO,去离子水 (0.22 μm 膜过滤,若纯水仪已含该滤芯,可无需再次过滤直接使用 )。
• 蛋白:浓度一般需大于 0.5 mg/ml。蛋白总量至少 20 μg 以上。
• 小分子 LMW:母液浓度建议大于 20 mM,体积在 30 μL 以上,纯度 >90%,溶在 100% DMSO 里。
• 其他耗材:无盖 1.5 ml EP 管( 货号:BR-1002-87),橡胶瓶盖 2 型( 货号:BR-1004-11),96 孔板( 货号:BR-1005-03),96 孔板封口膜 ( 货号:28-9758-16)。
实验步骤
芯片的放置与缓冲液置换
• 将运行缓冲液 (200 mL 1×PBS Buffer 即可 ),水瓶,废液瓶分别放置在左右托盘中,并插入相应的进液管。
• 点击 Biacore T200 Control Software 工具条中的 ![]() 或
或 ![]() 点击 Eject Chip,打开芯片舱门。选择 New Chip,现在 Chip type 为 CM5。
点击 Eject Chip,打开芯片舱门。选择 New Chip,现在 Chip type 为 CM5。
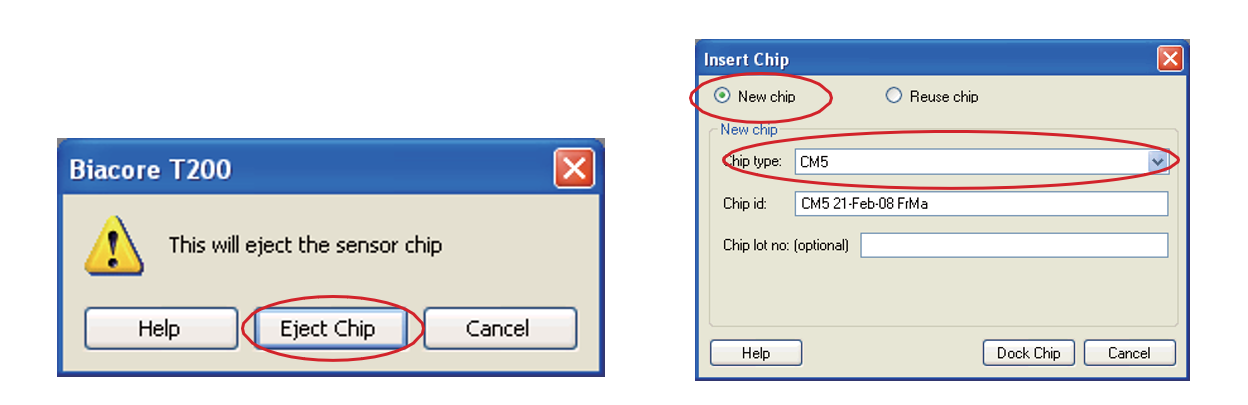
• 手持芯片,有字的一面朝上。按照芯片上的箭头方向,将芯片轻轻推入卡槽,最后合上芯片舱的舱门。点击 Dock Chip。结束后,选择 Tools → Prime 命令,点击 Start。结束后,点击 Close,系统自动转入待机 (Standby) 状态。



蛋白偶联
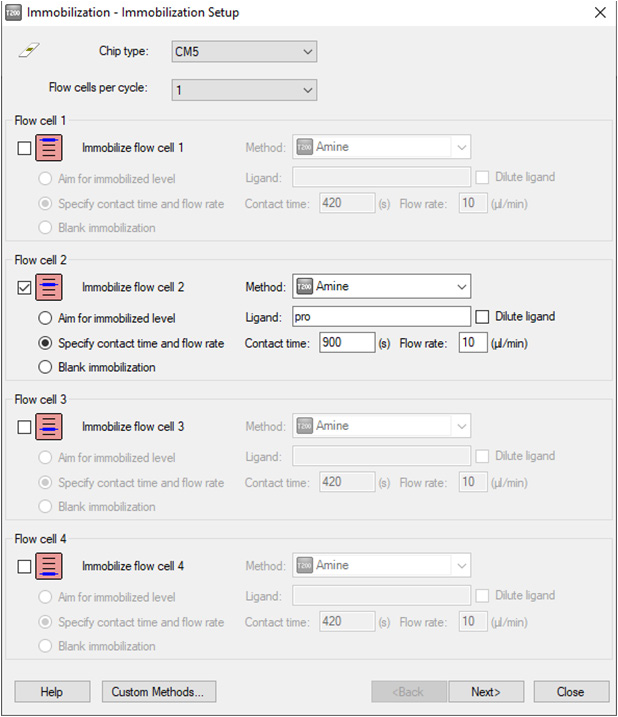
• 点击控制软件 File 下面的 Open/New wizard template,选择 immobilization,双击。在 Chip type 中选 CM5,在 Flow cells per cycle 选 1。勾选 Flow cell 2 (如 2 已用,可选择 4),method 选用 amine, Ligand 输入配体名称,选用 specify contact time and flow rate 实现高偶联,按下表输入 contact time,本次实验输入 900s。点击 2 次 Next。
表 1. 偶联量与配体工作浓度参考表
| 分子量比(蛋白 / 小分子) | ≤50 | 50~100 | >100 |
| 芯片类型 | CM5 | CM7 | |
| 目标偶联量 | ~8000 RU | ~15000 RU | >20000 RU |
| 配体工作浓度 | 20μg/mL | 40 μg/mL | 50 ug/mL |
| contact time | 600s | 900s | 900s |
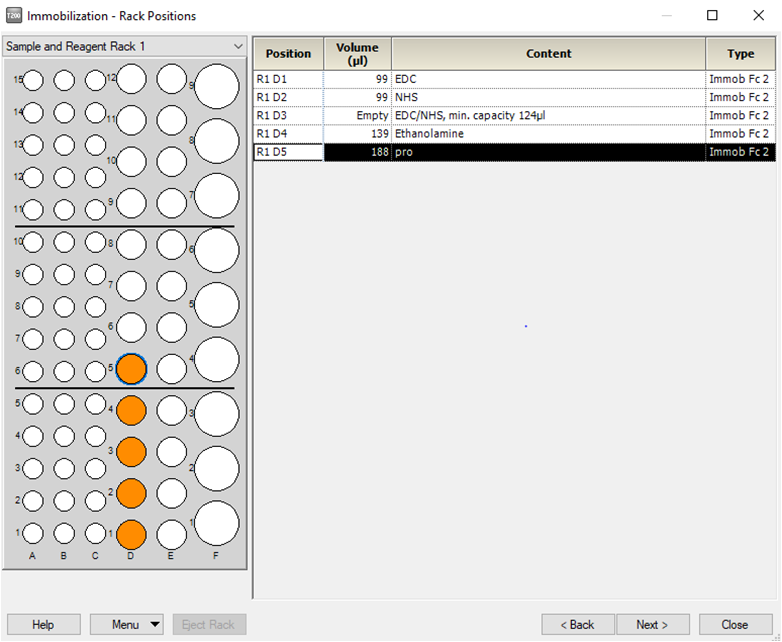
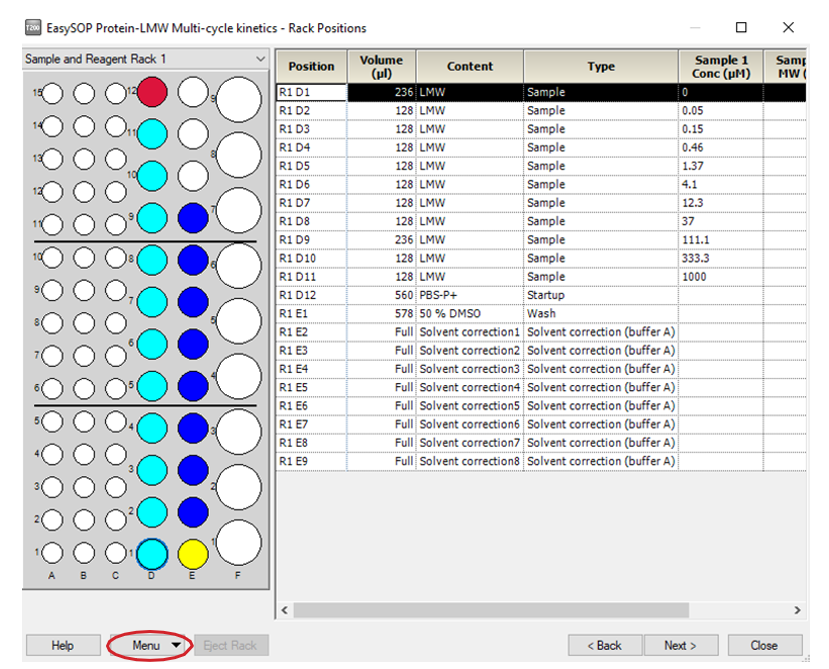
• 在左侧下拉菜单中选用Sample and Reagent Rack 1,在 Menu 里选Automatic Positioning 自动排放样品位置或自行通过鼠标拖拽到指定位置。根据下图中样品名称及体积( 大于该指定体积即可 ) 进行样品准备。其中配体蛋白用 pH4.0 的醋酸钠稀释至 50 μg/mL ( 或按上表配制相应浓度 )。点击左下方 Eject Rack,取出样品架,将准备好的样品放到对应位置。盖上试管架盖子,将样品架送回样品舱。( 注:所有 EP 管的盖子务必剪去 )。
• 点击 Next,点击 start,保存 method 与 result 文件。系统将自动在芯片表面包被目标偶联量的配体蛋白,并自动生成偶联报告。
• 偶联结束后,即可进入下一步实验,无需等待基线平衡。
运行缓冲液及样品配置
• 配置运行缓冲液和溶剂校正曲线
小分子样品的运行缓冲液选用含 5%DMSO 的 1×PBS-P+(视样品溶解性可调整 DMSO 含量,最高不超过 10%)
取 105 mL 10×PBS-P+ 用去离子水稀释到 1L,配成 1.05×PBS-P+。并按照下表,加入 DMSO,配置5%DMSO 运行缓冲液和 4.5%、5.8% 溶剂校正母液(running buffer 中 DMSO 浓度并非绝对 5%,可视小分子样品溶解度情况而定,0-10% 均可。若 running buffer 中 DMSO 浓度变化,则溶剂校正母液也相应变化,只要 cover running buffer 中 DMSO 浓度即可)。将系统左侧托盘中的原运行缓冲液换成含 5%DMSO 的 1×PBS-P+,并插入相应的进液管。
| 4.5% DMSO | 5.8% DMSO | 5.0% DMSO running buffer | |
| 1.05 x PBS-P+ | 9.5ml | 9.5ml | 950 ml |
| 100% DMSO | 0.45ml | 0.58 ml | 50ml |
| Final volume | ~ 10 ml | ~ 10 ml | 1000 |
按照下表混合 4.5% 和 5.8% 母液配置 5%DMSO 浓度校正曲线(DMSO 标准液的数量并非一定要 8 个, 通常 4-8 个均可。总体积也并非一定要 1.4ml,这些均可根据实际情况自行调整 )
| Buffer/Vial | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 4.5% DMSO | 0 | 200 | 400 | 600 | 800 | 1000 | 1200 | 1400 |
| 5.8% DMSO | 1400 | 1200 | 1000 | 800 | 600 | 400 | 200 | 0 |
• 小分子样品准备
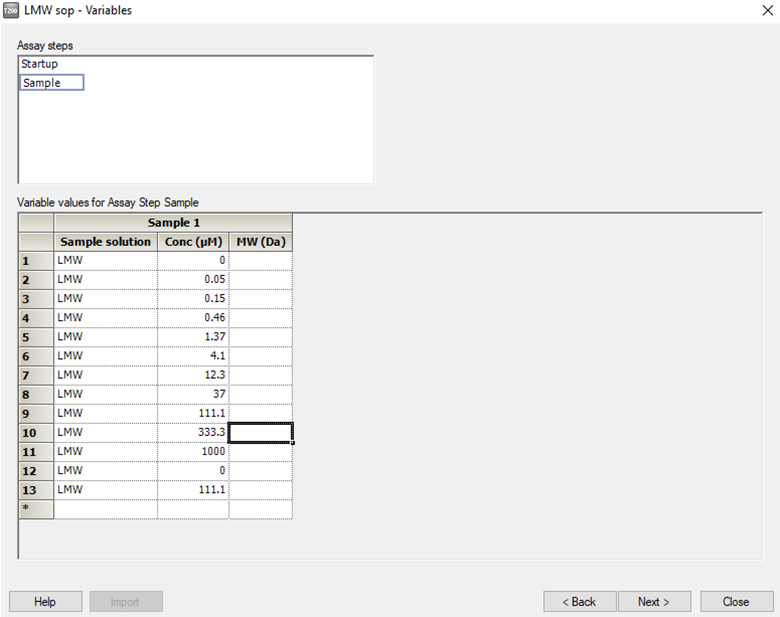
用不含 DMSO 的 1.05×PBS-P+ 缓冲液稀释 20 mM 小分子母液 20 倍,得到 1 mM 含 5%DMSO 的1×PBS-P+ 中的小分子 400 μL,再用配好的含 5% DMSO 的 Running Buffer 将分析物向下三倍稀释 10个浓度梯度 ( 各 200 μL),分别是 1000 μM, 333.3 μM, 111.1 μM, 37 μM, 12.3 μM, 4.1 μM, 1.37 μM, 0.46μM, 0.15 μM, 0.05 μM。间隔设置一个重复浓度,增加一个 0 浓度。
多循环动力学检测
• 点击控制软件 File 下面的 Open/New Method,然后双击打开 Biacore Methods,再双击 LMW kinetics。
• 在 General Settings 界面,将 Concentration unit 改为 μM,Detection 改为 Dual,若 flow cell 2,3,4 都偶联了蛋白,Detection 下面可以选 Multi,后面对应的第 5 步可选 2-1,3-1,4-1,其他不做修改。

• 在Assay Steps 界面,可以调整检测项目和重复次数。Startup 和sample 的重复次数通常分别为3 和1, solvent correction 通常检测开始时一次,结束时一次,每隔 30cycle 一次。检测温度默认 25 度,也可根据需要进行修改等。如无 control sample,可在此页面选择 control sample 后,点击左侧 Delete 按钮,将其删除。
• 在 Cycle Types 界 面,选择 LMW kinetics,点击下方 Sample1,将 Contact time 改为 60s, Dissociation time 改为 120s。其他项无需修改。Extra wash 用 50%DMSO 清除管路中残留的小分子(extra wash 不流经芯片表面,不会影响配体活性 )。
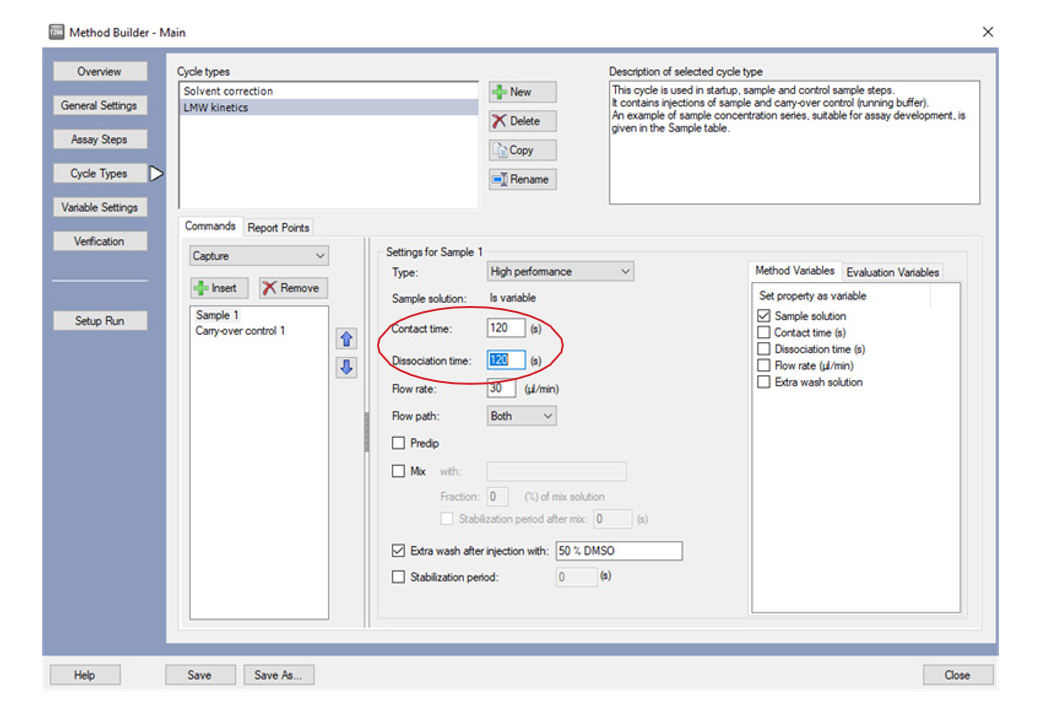
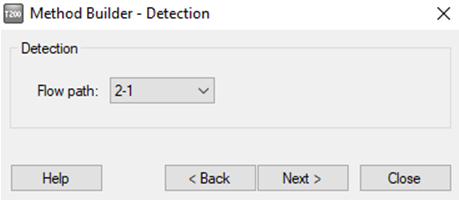
• 点击 Verification,如果方法有问题,在此页面会报错,并根据报错提示返回相应步骤进行修改。如果无问题,点击 setup Run。在 detection 界面将 Flow path 点为 2-1 或 4-3(具体视蛋白偶联的通道而定)。
• 点击 next, 进入分析物信息填写。Startup 中 Sample solution 填写 PBS-P+,Sample 中 Sample solution 填写样品名称,Conc 填写分析物系列浓度(由低到高、三倍稀释)。注意要设置重复浓度和零浓度。推荐浓度如下:
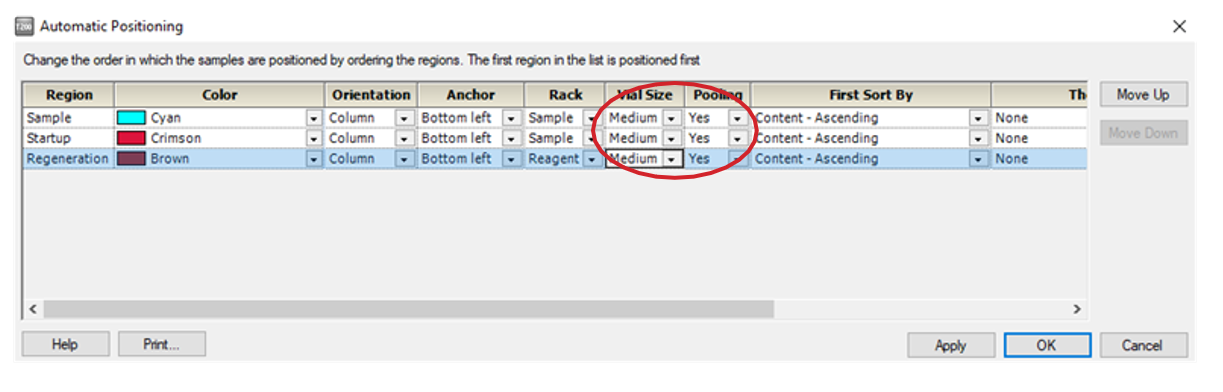
• 点击 3 次 Next,进入 Rack Positions 界面,将 Reagent Rack 改为 Sample and Reagent Rack1(若需要用96/384 孔板,则选择Reagent Rack1 或2,同时在下方96 well microplate 中选择对应的孔板类型)。点开 Menu 后选 Automatic Positioning 进入下面界面后, Vial Size 根据需求进行调整,1.5 mL EP 管请选择 medium,pooling 选择 Yes(相同的样品会自动合并),点击 OK。点击左下方 Eject Rack, 取出样品架。根据图示样品位置进行放置,放入样品体积略大于显示体积即可。注:所有 EP 管的盖子务必剪去。盖好橡胶盖防止挥发,并按指定位置放置。盖上试管架盖子,将样品架送回样品舱。点击 Next,对方法进行保存,再对数据路径(可使用系统 默认的,也可自行指定,注意所保存的文件名及指定文件夹名均不能有中文字符)进行保存,仪器便会开始自动运行。
结果分析
• 打开 Biacore T200 Evaluation Software,点击![]() ,找到保存的结果文件。点击左侧 Plot 中的Binding to reference,检查各个点是否趋于一致或小于 binding level 中对应响应值的 20%,再检查binding level 各个点的响应值是否存在明显的浓度依赖。如是,直接跳到下一步。注:若 Binding to reference 各个点的响应值也存在浓度依赖且大于binding level 中对应响应值的 20%,即存在非特异性结合。此时可尝试提高运行缓冲液中盐离子浓度或提高 P20(货号:BR-1000-54)浓度不超过 1%。若 baseline 中各个点的响应值上飘,可加入再生步骤。
,找到保存的结果文件。点击左侧 Plot 中的Binding to reference,检查各个点是否趋于一致或小于 binding level 中对应响应值的 20%,再检查binding level 各个点的响应值是否存在明显的浓度依赖。如是,直接跳到下一步。注:若 Binding to reference 各个点的响应值也存在浓度依赖且大于binding level 中对应响应值的 20%,即存在非特异性结合。此时可尝试提高运行缓冲液中盐离子浓度或提高 P20(货号:BR-1000-54)浓度不超过 1%。若 baseline 中各个点的响应值上飘,可加入再生步骤。
• 点击 solvent correction 进行溶剂校正分析。溶剂校正曲线一般要求落在 -500 到 +1000RU,两条竖线落在矫正曲线范围内,拟合的 Chi2 小于 2。如果超出此范围较多,多由于 DMSO 浓度配置不准确造成。最后,点击 OK。


• 点击上方中间位置的 Kinetics/Affinity,在下拉栏里点击 Surface bound。在跳出的窗口中选择合适的、至少 5 个连续浓度进行拟合。不需要的浓度,可在样品浓度表格中将此浓度前的对号去掉即可。Curve 选择 FC=2-1corr(或 FC=4-3corr)。
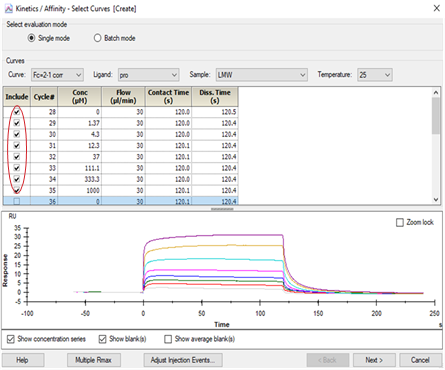
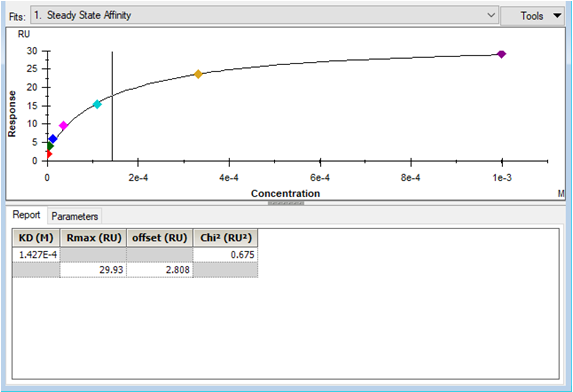
• 点击右下角 Next,选择右下角 Affinity(当传感图为 “ 时间依赖的动力学特征 ” 时,选 Kinetics,所以本实验也可用 kinetic 拟合),点击 Next,Model 选择 Steady State Affinity,点击左上角 Fit 进行数据拟合,点击右下角Finish 完成。经拟合,小分子LMW 与该蛋白pro 的亲和力KD=1.427x10-4 M。(对于亲和力拟合,KD 竖线最好落在样品浓度范围内,并尽量小于最高浓度的一半位置,若 KD 竖线>最高浓度,则可提高进样浓度梯度,或在上一步选择更高浓度的、至少 5 个连续浓度的样品进行拟合。)
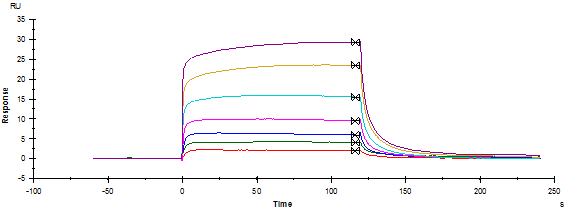
• 将鼠标放在图上,点击右键可以直接 copy graph(small,medium,large)用于文章发表,也可以右键点击 export curve,导出 txt 文本后自行用第三方软件作图。
相关试剂:
| 货号 | 产品名称 | 规格 |
| 29104988 | Series S Sensor Chip CM5-1-pack | 1片 |
| BR100530 | Series S Sensor Chip CM5 | 3片 |
| 29149603 | Series S Sensor Chip CM5, 10-pack | 10片 |
| BR100050 | Amine Coupling Kit | / |
| BR100349 | Acetate 4.0 | 50ml |
| BR100350 | Acetate 4.5 | 50ml |
| BR100352 | Acetate 5.5 | 50ml |
| BR100351 | Acetate 5.0 | 50ml |
| BR100357 | Glycine 3.0 | 100ml |
| BR100356 | Glycine 2.5 | 100ml |
| BR100355 | Glycine 2.0 | 100ml |
| BR100354 | Glycine 1.5 | 100ml |
| 28995084 | PBS-P+ 10X | 1L |
| BR100672 | PBS-N 10X | 1L |
| BR100287 | Plastic Vials 1 5 ml | / |
| BR100411 | Rubber Cap type 2 | / |
| BR100503 | Microplate 96 well | / |
| 28975816 | Microplate Foils (96 well) | / |










 危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)
危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)  营业执照(三证合一)
营业执照(三证合一)