mRNA的COVID-19疫苗的成功,离不开几十年来对脂质载体给药系统的研究。该技术已被用于向目标细胞和组织传递各种生物活性分子,如小分子抑制剂和疫苗成分。脂质载体技术与传统的药物传递方式相比有很多优势,包括增加药物的稳定性、生物利用度和分布。
脂质纳米颗粒(Lipid nanoparticles,LNPs)是脂质载体给药系统中的重要技术之一,已成为基于寡核苷酸治疗药物的一个重要进展。封装在脂质纳米颗粒中的寡核苷酸在传递过程中受到保护,不受酶降解,并有效地传递到细胞中,在细胞中载体颗粒中的内容物被释放并被翻译为治疗蛋白。鉴于LNPs对基于寡核苷酸的治疗具有巨大的革命性潜力,新一波研究人员正在追求基于LNPs更有针对性的应用。
如何设计一个脂质纳米颗粒的药物载体?
在选择脂类及其如何配制成LNPs时,应考虑以下几个因素。
1.脂质摩尔比决定了颗粒的脂质组成,并影响其大小、多分散性和功效。建议参考此前已开发的类似应用,从相关文献入手,以确定脂质摩尔比。下表展示了FDA批准的LNPs药物的脂质摩尔比:
| Patisiran | BNT162b2 | mRNA-1273 | |
| 内容药物类型 | siRNA | mRNA | mRNA |
| Ionizable Cationic Lipid(可电离阳离子脂质体) | DLin-MC3-DMA | ALC-0315 | SM-102 |
| Neutral Phospholipid(中性磷脂) | 1,2-DSPC | 1,2-DSPC | 1,2-DSPC |
| Sterol Lipids(固醇脂) | Cholesterol | Cholesterol | Cholesterol |
| PEGylated Lipids(PEG化磷脂) | DMG-PEG(2000) | ALC-0159 | DMG-PEG(2000) |
| 脂质摩尔比* | 50:10:38.5:1.5 | 46.3:9.4:42.7:1.6 | 50:10:38.5:1.5 |
FDA批准的LNPs药物中的脂质摩尔比(*Ionizable cationic lipid : neutral phospholipid : cholesterol : PEGylated lipid)
(相关产品链接请见文末)
2.脂质与寡核苷酸的重量比影响包封效率。大多数LNPs的配方为脂质:寡核苷酸重量比为10:1。
3.可电离脂质氮:寡核苷酸磷酸(N:P)摩尔比表示可电离阳离子脂质阳离子叔胺与寡核苷酸主链阴离子磷酸基团之间的电荷平衡。这一性质是电离阳离子脂质与寡核苷酸络合的基础。LNP的N:P比率通常在6左右。
4.脂酸解离常数(脂质pKa)是脂质在相同浓度下的电离和非电离形态的pH值。脂质pKa影响LNP的包封效率、疗效、传递和毒性。 对于RNA传递,脂质pKa一般在6-7之间。已经确定了不同给药途径的具体范围。静脉给药和肌肉给药的最佳脂质pKa范围分别为6.2-6.6和6.6-6.9。
5.水缓冲液的三个重要参数是它的组成、离子强度和pH值。缓冲液稳定溶液中的寡核苷酸,可电离的阳离子脂质在酸性水缓冲液中混合后变成质子化和正电荷。LNP制剂中常用的缓冲液为25-50 mM的醋酸钠或柠檬酸钠,pH为4-5。LNPs被透析到中性缓冲液中,如pH 7.4的PBS中储存和使用。
6.颗粒大小改变给药颗粒的药代动力学。 更小的颗粒通常有更长的循环半衰期,因为它们逃避单核吞噬细胞机制的清除。小于100nm的颗粒可轻易通过有孔的内皮细胞穿透靶组织。颗粒大小取决于制备方法。根据LNP制备方法的不同,可以使用挤压来实现更小、更均匀的颗粒尺寸。
7.两种最常用的给药途径是静脉注射和肌肉注射。 静脉给药的LNP主要分布在肝脏和脾脏,但也分布在肺部。带净正电荷、中性电荷和负电荷的LNPs可分别靶向肺、肝和脾。在配方中加入胆固醇或聚乙二醇化脂质,以及增加LNP的大小,增加了脾脏的分布。肌肉注射通常用于疫苗,因为它有助于淋巴结靶向和激活免疫反应。当使用疫苗时,抗原提呈细胞(APCs),如巨噬细胞和树突状细胞,被招募到交付点,在那里它们可以遇到疫苗抗原。 然后它们转移到淋巴结,刺激T细胞反应。值得注意的是,针对某一特定给药途径进行优化的制剂通常不适用于其他给药途径。
8.制备方法决定了LNPs的性质,包括尺寸、均匀性和包封效率。 在选择制备方法时,还应考虑成本、可扩展性、可再现性和时间承诺。
LNPs的制备步骤
本文给出了一系列用于生产LNP的大致流程,包括LNP生命周期的整个范围,从LNP从实验台上的准备开始,到如何使用LNP,以及在体外/体内实验中使用LNP时的预期结果。
1.LNP的准备
在开始之前,确保所有的供应品、试剂和工作环境是RNase-free的。siRNA和mRNA在化学上对RNase不稳定,RNase是降解RNA寡核苷酸的酶。图1总结了LNP形成的步骤。
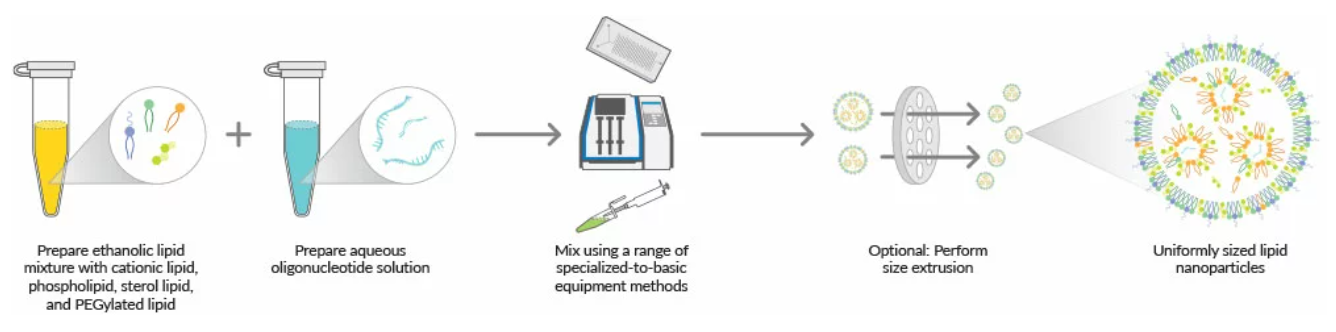
LNP制备工作流程
2.混合
LNPs的制备方法是将乙醇脂混合物与含有寡核苷酸的酸性水缓冲液混合(如下图)。通常使用1:3的乙醇脂混合物与水缓冲液的比例。有几种方法适用于实验室规模的小体积LNP生产。
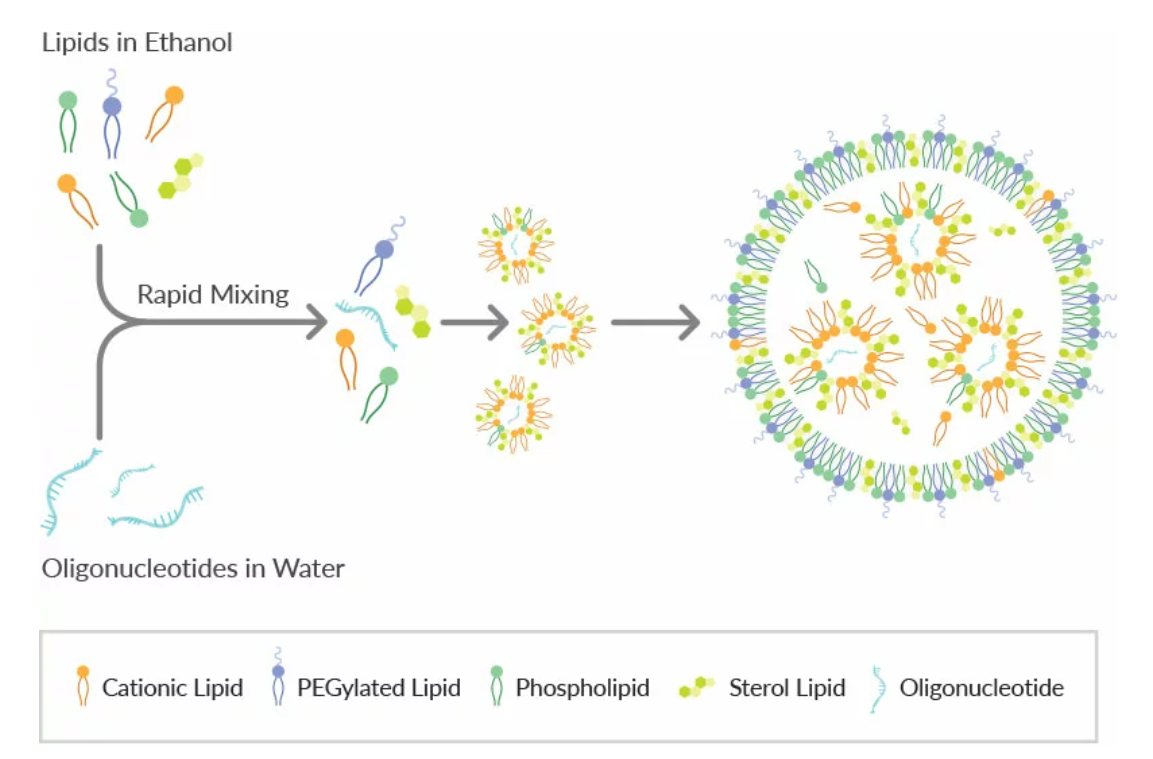
含寡核苷酸的LNP形成示意图
下文和下表对其中的四种混合方法进行了比较,这些方法适用于一系列从专业到基本的设备。
微流体混合设备:自动化微流体混合设备或微流控芯片是快速高效制备LNPs的方法。这些器件能够以高度可控、可重复的方式快速混合,从而获得均匀的LNPs和高封装效率。在这些装置中,乙醇脂混合物和寡核苷酸水溶液的单独流被迅速结合。脂质纳米颗粒形成时,两股溶液混合,并收集到一个单独的管中。可以通过改变流量比和总流量等参数来微调LNPs。
T型或y型混合器:这些混合器可以用普通和实惠的实验室材料组装。T型或y型接头可安装两个入口,连接到装有脂质混合物或寡核苷酸溶液的单独注射器,一个出口将LNPs引导到收集管中,进口流量可以控制注射泵。
乙醇注射:此方法适用于所有实验室。乙醇脂混合物和寡核苷酸水溶液的混合是在磁搅拌板的帮助下进行的。将乙醇脂混合物注入酸性寡核苷酸水溶液中,不断搅拌,继续搅拌30分钟。但这种方法可能产生更多不均匀的LNPs,包封效率较低,容易发生变化。
手工混合:这是乙醇注射的一种更简单的替代方法。 将乙醇脂混合物转移到酸性寡核苷酸水溶液中,通过快速移液混合15秒。 将混合物静置10分钟。 与乙醇注射法一样,手工混合LNPs得到的是包封效率较低的非均质LNPs,且结果多变。
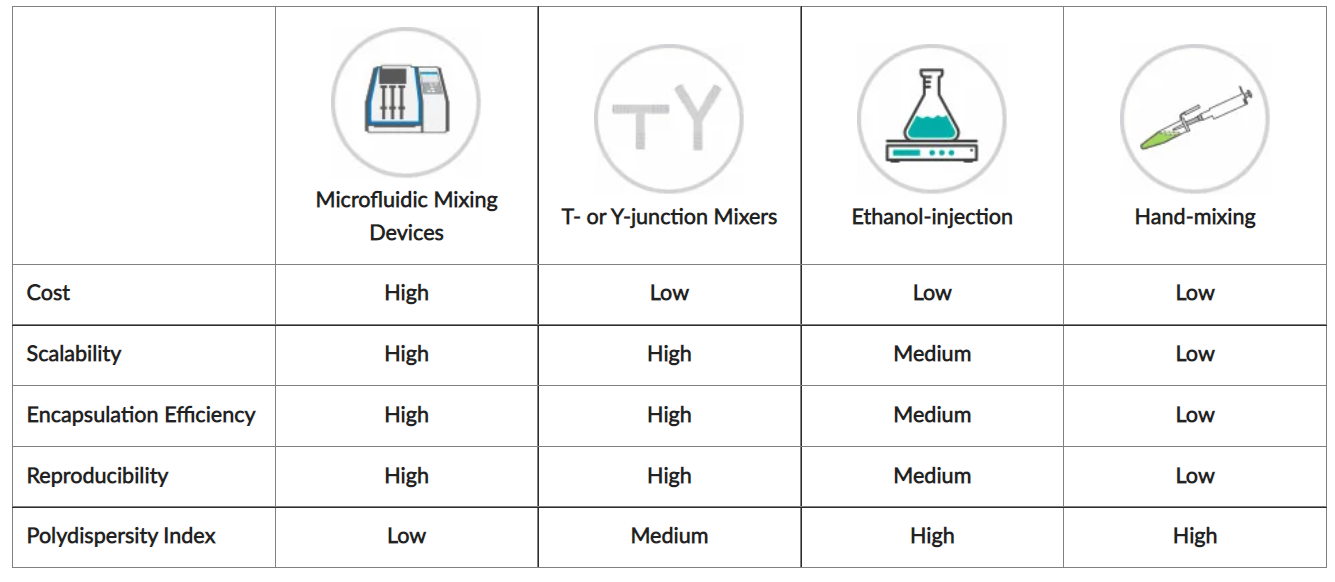
几种LNP制备方法的特点比较
3.最终制备步骤
LNPs的最终制备是在混合步骤中形成后进行的。 以下步骤可确保这些废物在贮存和使用期间均质、稳定,并无任何残留的化学或生物污染物。
挤压:挤压减小了颗粒尺寸,并产生均匀的颗粒尺寸分布。 这一步通常用大量混合方法进行,如乙醇注射和手工混合方法。
透析:使用适当的分子量截断(MWCO)管在储存缓冲液中透析LNPs。 这一步除去未封装的货物,多余的脂质成分和乙醇从最后的准备。 透析还可以调节LNPs从酸性制备缓冲液到中性储存液的pH值。
过滤消毒:过滤是LNPs灭菌的推荐方法。过滤-储存前用0.22μm滤网消毒LNPs,以去除细菌或其他污染物。 对于较大颗粒或高黏性溶液,可采用其他灭菌方法,如高压灭菌或辐照,尽管这些方法可能会影响岭土核电站的结构完整性。
LNPs的稳定性和储存
LNPs准备好后,可立即使用或储存以备以后使用。下面呈现了存储过程中可能影响LNP解决方案完整性的因素,并提供如何限制存储不稳定性的提示。
1.物理稳定性是指LNPs在贮存期间的结构完整性。 粒子融合或聚集,以及封装货物的泄漏是物理不稳定的例子。
确保大小分布保持小而均匀:
· 在LNP配方中使用阴离子或聚乙二醇化脂质来防止颗粒融合/聚集
防止货物渗漏:
· 在LNP配方中加入胆固醇
存储要求:
· 调节存储温度,缓冲液和pH值
· 避免冻融循环
2.化学稳定性决定了LNP脂质和货物组分在分子结构上的抵抗性。 水解、氧化和酯交换可导致寡核苷酸和脂质降解或形成脂质-寡核苷酸加合物并失去功效。
控制内容药物的分解:
· 使用不含RNase的试剂和用品
· 考虑具有抗降解的糖-磷酸盐主干修饰的寡核苷酸货物
防止脂质氧化:
· 在储存过程中加入抗氧化剂,如α-tocopherol,或者冷冻保护剂,如海藻糖或蔗糖
存储要求:
· 调节存储温度,缓冲液和pH值
· 避免冻融循环
3.生物稳定性与LNPs避免在体外或体内系统中早期降解的能力有关。 影响生物稳定性的因素包括脂质组成、颗粒大小和表面电荷。
减少血清蛋白调理:
· 包括聚乙二醇脂质
· 减少颗粒大小
· 达到接近中性的zeta电位
· 增加LNP亲水性
减少早期漏货:
· 按照存储需求
· 使用可电离的阳离子脂质
· 包含长脂和/或不饱和脂
· 在LNP配方中加入胆固醇
4.贮存是影响LNP制剂稳定性的一个关键参数。
一般说来,LNPs可在4°C下保存长达1周,或在-80°C下冷冻干燥保存。存储温度、缓冲液和pH值可能需要优化。建议在冷冻时加入冻干或不加冻干的低温保护剂。
LNP的特性
在体外或体内使用前对LNP的表征对于实验的可重复性至关重要。适用于LNP表征的分析方法见下表:

(*Adapted from Schoenmaker, L., et al. 2021 and Lin et al. 2014)
1.LNP的大小(LNP size)描述了LNP的平均直径。 LNP的大小影响生物分布和细胞摄取,从而影响LNP的有效性。多分散性指数(PDI)是衡量LNP粒径分布的一个指标。均匀、大小均匀的样本具有较小的PDIs,而大小分布不均的样本具有较大的PDIs。通过优化脂质成分、增加混合速率、选择不同的制备方法或添加挤出步骤,可以降低LNP制剂的LNP大小和PDI。
2.Zeta电位(Zeta potential)是LNP周围的静电电位。一般来说,接近中性的zeta电位是可取的。阴离子型LNPs可能被带负电荷的质膜静电排斥,而阳离子型LNPs可能具有细胞毒性。 zeta电位可以通过改变N:P来调节。
3.封装效率(Encapsulation efficiency)是LNP中所含寡核苷酸的量与混合过程中所使用的起始量的比较。 微流体混合方法产生最高的封装效率。
4.颗粒浓度(Particle concentration)的定量是必要的,以确保实验之间的比较结果。 另外,也可以确定脂质和RNA组分的最终浓度。 LNPs可通过超离心浓缩或按需要稀释。
5.脂质和内容药物的完整性(Lipid and cargo integrity)对LNPs的有效性和稳定性至关重要。 有关更多信息,请参阅下面的存储和稳定性部分。
验证
LNPs通过内吞作用被靶细胞内吞。内含体逃逸是在内吞作用后LNP的内容物被运送到胞浆的过程。 可电离的阳离子脂质在内体腔内的酸性环境中质子化并带正电荷,这破坏了带负电荷的内体膜,促进被包裹的寡核苷酸被释放到胞质中,在细胞质中翻译。
可以通过简单的分子生物学技术来确认LNPs的体外疗效。可分别通过qPCR或Western blot检测感兴趣的基因或蛋白的敲低或表达。基于细胞的报告基因测定也被用于确定LNP的有效性。
寡核苷酸产物在体内的蛋白表达遵循一个目标依赖的时间过程。 编码功能性蛋白质的封装寡核苷酸在数小时内就会产生蛋白质浓度的变化,而那些编码的货物可以在几天到几周内产生抗体反应。 由于寡核苷酸容易降解,因此经常需要使用反复给药方案来实现持续的蛋白表达。ELISA和多重分析可用于测量靶蛋白和抗体反应,以及细胞因子和趋化因子浓度,这为了解LNP的免疫原性和耐受性提供了深入的认识。
给药后LNP的命运取决于脂质组成、LNP设计和给药途径。经静脉给药后,LNPs通常分布到肝脏和脾脏。 肌内给药的目的是针对淋巴结,但经常诱导局部和远端(如肝脏)蛋白表达。 因此,用于LNP的脂质在这些组织中也可检测到。LNPs中使用的脂类具有生物相容性,可迅速降解,一般在给药后24至48小时内消除。为了确定脂质组织浓度,可以使用基于质谱的方法。
文章部分相关产品:
化合物
| Cat No. | 产品名称 | CAS No. | 纯度 | 产品类型 |
| 34364 | DLin-MC3-DMA | 1224606-06-7 | ≥95% | 可电离阳离子脂质体 |
| 34337 | ALC-0315 | 2036272-55-4 | ≥98% | 可电离阳离子脂质体 |
| 33474 | SM-102 | 2089251-47-6 | ≥98% | 可电离阳离子脂质体 |
| 34372 | Lipid 5 | 2089251-33-0 | ≥95% | 可电离阳离子脂质体 |
| 35337 | Lipid 29 | 2244716-55-8 | ≥98% | 可电离阳离子脂质体 |
| 35051 | L-319 | 1351586-50-9 | ≥95% | 可电离阳离子脂质体 |
| 25726 | DODAP | 127512-29-2 | ≥98% | 可电离阳离子脂质体 |
| 34363 | DLin-KC2-DMA | 1190197-97-7 | ≥98% | 可电离阳离子脂质体 |
| 34336 | ALC-0159 | 1849616-42-7 | ≥95% | PEG化磷脂 |
| 33945 | DMG-PEG(2000) | 160743-62-4 | ≥90% | PEG化磷脂 |
| 9003100 | Cholesterol | 57-88-5 | ≥95% | 固醇脂 |
| 15100 | 1,2-DSPC | 816-94-4 | ≥98% | 中性磷脂 |
LNP探索工具盒
| Cat No. | 产品名称 | 产品作用 |
| 36970 | Lipid Nanoparticle (LNP-MC3) Exploration Kit | 用于准备含有DLin-MC3-DMA的LNPs |
| 35426 | Lipid Nanoparticle (LNP-0315) Exploration Kit | 用于准备含有ALC-0315的LNPs |
| 35425 | Lipid Nanoparticle (LNP-102) Exploration Kit | 用于准备含有SM-102的LNPs |
测量LNP诱导的免疫反应的试剂盒
| Cat No. | 产品名称 | 靶点 |
| 501240 | Mouse IgG ELISA Kit | 小鼠免疫蛋白 |
| 501030 | Interleukin-6 (human) ELISA Kit | IL-6 |
| 583311 | Interleukin-1β (human) ELISA Kit | IL-1β |
| 502220 | SARS-CoV-2 Neutralizing Antibody SimpleDetect ELISA Kit | 新冠中和抗体 |










 危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)
危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)  营业执照(三证合一)
营业执照(三证合一)