引言
特殊临床病人的血,往往很难以收集,从少量的血液中,尽可能多的分离目的免疫细胞,对我们的研究还是有很大的益处的。
本文借助文献、工作中的操作经验及不同试剂的品牌商的咨询,为大家整理了,如何从一管人的血液样本中,分离淋巴、单核、中性粒细胞和血清样本,其中包含PBMC的制备步骤,针对只需要PBMC的老师,也可以借鉴一下。
整体流程图如下:

一、准备工作:
温度设置:离心机18-22℃,室温最好也可以控制在这个范围,所有试剂提前拿出复温
主要试剂:
Ficoll-Paque PLUS(浓度1.077,17144002,Cytiva)
红细胞(RBC)裂解缓冲液(自配,或555899,BD)
HBSS(0.5 M EDTA)和PBS(0.5 M EDTA)
注:
①此方法,主要建立在Ficoll分离 PBMC技术上。温度低于最佳温度,会导致Ficoll密度增加,进而增加PBMC层的红细胞和粒细胞的污染,及最下面的沉淀层粒细胞的减少。温度高于最佳温度,会导致Ficoll密度减小,进而导致PBMC层得率减小,及粒细胞层污染。
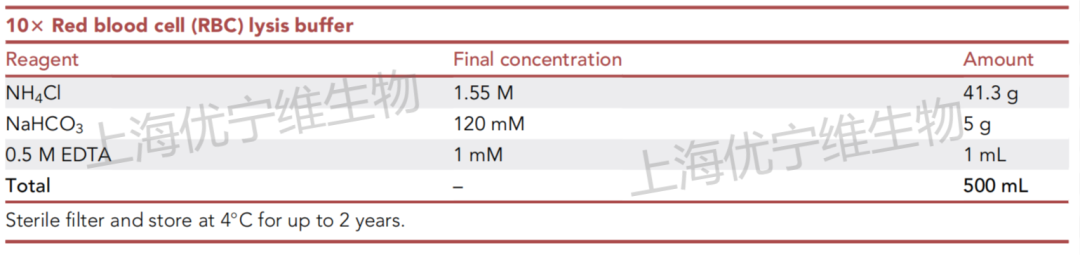
②自行配置红细胞裂解液,可参考下表:
(不论是配的还是买的,使用浓度为1×,保存液一般为10×)
二、血液样本的收集
紫色EDTA抗凝管收集的新鲜血液样本,室温18-22℃保存,务必当天完成操作
注:
①立即处理可产生最佳效果,最长不易超过8 h,越快越好;
②如果抽血和分离之间的延迟>1 h,可将抗凝管保存在冰上,并在分离处理前加热至18-22℃复温,较长时间的延迟会损害粒细胞和单核细胞的活力;
③若后续实验不关注单核细胞群的活化等具体检测,亦可使用绿色肝素抗凝管;若比较关注免疫细胞功能性检测,推荐换为绿色肝素抗凝管;
④注意抗凝管中血量,过高过低,均会对后续免疫细胞检测有影响:
3 ml抗凝管——2 ml血液 10ml抗凝管——8 ml血液
三、PBMC样本的制备
1. 血液样本稀释:用不含Ca离子Mg离子的PBS或HBSS对样本进行2-4倍的稀释;
注:Ca离子Mg离子会激活粒细胞
2. 轻轻地将预稀释的血液放入铺好Ficoll-Paque plus的离心管中(1.2步骤比例推荐见下图);

3. 水平离心机,400xg,离心40 min,降速设为0或最低;
4. 离心后所得样本分层如下图:
① 最上层即为血浆,可分装保存用于后续实验,或直接吸取丢弃;

② 第二层白膜层即为PBMC(单个核细胞层:包含单核细胞+淋巴细胞);
③ 最下层深红色为粒细胞+红细胞层(留存,后面制备中性粒细胞时使用)
注:取第二层PBMC白膜层分群不清晰时,吸弃上清后,可以留一定体积白膜层上下的液体,注意后续充分洗涤即可
5. 洗涤:
① 洗液(PBS或HBSS)补满全管体积,300×g,5 min,弃上清;
注:洗涤细胞沉淀时,先加小体积(1 mL)重悬浮细胞,再补满洗液;
② 重复上一步操作1-2次,直至上清液透明;
注:上清液清晰透彻可保证血小板的清除干净,它们粘附在单核细胞上,会导致污染,并影响单核细胞活力和活化

6. 重悬沉淀,待用即可,若有红细胞残留,可以短时5-8 min裂红。
注:一般10 ml裂红液足以清除90 ml血液制备的PBMC中的红细胞残留
四、单核细胞和淋巴细胞的制备
选择美天旎的有柱式磁珠分选对CD14+单核细胞进行阳性分选(130-050-201,CD14 MicroBeads, human,Miltenyi),被CD14磁珠标记,滞留在磁场中的细胞,洗脱后即为单核细胞;非磁珠结合的,直接流出的液体部分即为相对纯净的淋巴细胞。

操作步骤,相应产品的说明书已写的非常详尽了,这里仅给大家介绍些特殊注意事项:
1. 从第三补得到的PBMC开始,4℃保存和操作,保持细胞活力;
2. 磁珠孵育为4℃,不可在冰上进行;
3. 厂家推荐搭配的分选柱为LS柱,制造商的说明是可用于10^7-2×10^9 个细胞。实验发现每个LS柱最多有1×10^8个PBMC是一个有效的理想选择,过多会堵塞柱子。
注:
除美天旎的磁珠阳选试剂盒外,还有很多的分离方法:
①贴壁培养粘附法:得率相对较低,且纯度往往低于50%,一般不推荐;
②阴性分选法:有可能会导致血小板污染,使单核细胞污染和活化,且影响活性;
③其他品牌的磁珠阳选法:由于没有分选柱,需要靠大磁珠并大量的富集在细胞表面,会过度激活单核细胞,且往往影响后续流式抗体的结合,影响结果的检测。
五、中性粒细胞的制备(*此部分全程在18-22℃操作,温度变化会激活粒细胞)

1. 用巴氏管或移液枪,在不干扰底层红色沉淀的基础上,吸弃上层的Ficoll液体;
注:如果在清除过程中底部分层受到干扰,可以500×g离心5 min。

2. 红细胞裂解液加满至50 ml, 500×g离心5 min;
注:迅速,避免长时间暴露于裂红液,会溶解粒细胞导致受损及出现“粘稠”。
3. 不涡旋,不弃液,直接将该管(命名为管0)顶部20 ml转到新离心管1,再将接下来顶部的20 ml转移到新管2;
4. 管1和2加入30 ml裂红液,管0加入40ml裂红液(即分别加入裂红液补满管50 ml),孵育5min;
5. 500×g离心5 min;
6. 轻轻除去上清液,用1 ml 裂红液重悬细胞沉淀;
7. 可以最多将6管上一步骤6得到的细胞悬液混合在一起,用裂红液补至50 ml,孵育5 min;
8. 500×g离心5 min;
注:如果此时沉淀白色或在白色沉淀上方仅包含一个红色薄环,则进行下一步骤9,如果沉淀保持红色,重复步骤7、8消除红细胞。
9. 吸弃上清,用15 ml PBS清洗细胞沉淀;
10. 500×g离心5 min;
11. 吸弃上清,在PBS中重悬细胞(1~5×10^6细胞/mL)。
注:通常,50mL的血液可以产生5~20×10^7的中性粒细胞。
参考文献
[1] Cui C , Schoenfelt K , Becker K , et al. Isolation of polymorphonuclear neutrophils and monocytes from a single sample of human peripheral blood.[J]. STAR protocols, 2021, 2(4):100845.
[2] Mccoy J P . Handling, Storage, and Preparation of Human Blood Cells[M]. John Wiley & Sons, Inc. 2001.










 危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)
危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)  营业执照(三证合一)
营业执照(三证合一)