作者:Tommy Weiss Sadan博士和Melanie R. Grably博士
电压依赖性钾离子通道(KV4)在大脑和心脏中均有表达,它们调节认知功能和心脏输出量。衰老与心血管疾病和认知能力下降的趋势增加有关,但和这些衰弱性疾病之间的联系尚不明确。在这里,我们展示了KV4离子通道可能将心血管疾病和神经元功能障碍联系在一起,并展示了来自Alomone实验室的一系列功能工具来研究这种可能性。
简介
结构
钾离子通道是一个庞大而多样的蛋白超家族,通常根据其结构和激活方式进行分组。电压门控钾离子通道(KV)包含了这个蛋白超家族的很大一部分,并根据与其果蝇(Shaker、Shab、Shal和Shaw)的序列同源性进一步分为12个亚家族。Shal型钾离子通道也称为KV4.1、KV4.2和KV4.3(哺乳动物),在大脑和心脏中高度表达,分别调节神经元兴奋性和心脏起搏等多种生理功能。在衰老及其相关疾病的背景下,本文将主要关注这些类型的钾离子通道。
Shal型钾离子通道与其他钾离子通道具有相同的原型结构,如细胞质羧基末端、T1组装结构域、6个α螺旋跨膜结构域(S1-S6)和孔环(P-Loop),对钾离子具有选择性。螺旋状的S4区段在其他S亚基中是独特的,因为它被认为是电压传感器,由带正电荷的精氨酸和赖氨酸残基密集簇构成。膜去极化时,S4结构域介导蛋白质构象的改变,并为钾离子通路打开通道。
KV离子通道活性的调控是一个复杂的多步骤过程,取决于许多因素,包括蛋白-蛋白相互作用、细胞信号事件、转录和翻译后活动,下文将详细说明。
转录调控
KV4的表达受多种因素影响,包括转录活性的变化。Argenziano等人发现睾酮控制着心脏中KV4.3的表达。作者使用 Anti-KV4.2 Antibody (#APC-023,Alomone)发现,非那雄胺和氟他胺(通过不同机制阻止雄激素信号转导的药物)会降低大鼠右心室中KV4.3的表达,这表明睾酮和雄激素信号转导在钾离子通道表达中发挥作用。
Micro RNA(miRNA)miR-223-3p在急性心肌缺血(AMI)大鼠模型中高表达/上调。使用Anti-KV4.2抗体(#APC-023)进行WB实验分析表明,miR-223-3p的表达与KV4.2的表达成反比。通过在原代新生大鼠心室肌细胞中表达miRNA,测试并验证了miR-223-3p负向调节KV4.2表达的可能性。事实上,miR-223-3p对KV4.2的抑制被Antagomir沉默miR-223-3p12所取消。miR-223-3p对KV4.2的影响似乎是特异性的,因为其他KV离子通道(即KV4.3)的蛋白水平没有被miRNA改变。
在神经系统中,裂解的GLP-1肽可刺激海马神经的长期电位(LTP)信号。使用Anti-KV4.2抗体对海马裂解液进行的WB实验分析表明,小鼠长期服用GLP-1(9-36)后,该蛋白的表达量减少,这与LTP信号的增加有关。
亚细胞运输和定位
钾离子通道的空间分布对细胞的正常功能非常重要。对于神经元等结构复杂的细胞来说尤其如此。最近有人研究了离子通道在调节KV4离子通道分布中的可能作用。使用抗KV4.3抗体对海马组织匀浆的细胞膜/膜部分进行WB实验,结果显示TRPC6的敲除导致细胞膜相关KV4.3的减少和细胞膜蛋白丰度的增加。此外,使用Anti-KV4.3抗体对大鼠脑切片进行免疫组化染色显示,给予TRPC6 siRNA的大鼠在齿状回细胞和副发光素(PV)阳性GABA能中间神经元中的KV4.3集群减少(图1),支持TRPC6可能在调节KV4.3亚细胞分布中的作用。
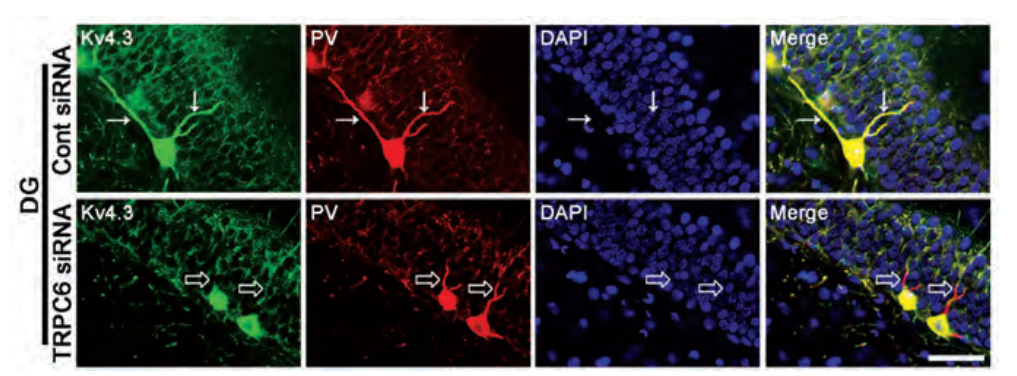
图1.TRPC6 siRNA对KV4.3定位的影响。
使用Anti-KV4.3抗体(#APC-017)对大鼠脑切片进行免疫组化染色。在对照条件下(上图),KV4.3染色(绿色)在GABA能神经元中强表达,并与parvalbumin免疫染色(红色)共定位。在TRPC6 siRNA的作用下(下图),KV4.3在树突中的分布明显减少。
经Frontiers公司许可,改编自参考文献9。
研究表明,糖蛋白Nectin-2α和KV4.2之间的新型相互作用可使KV4.2定位到胆碱能神经元相邻体节的特化质膜区域。使用Anti-KV4.2抗体进行高分辨电子显微镜观察证明了这种相互作用。此外,小鼠Nectin-2α的基因消减减少了胆碱能神经元顶膜的KV4.2荧光信号,证实了Nectin-2α-KV4.2的相互作用对KV4.2的定位非常重要。
KV4通过翻译后修饰调控
糖基化是一种常见的翻译后修饰,对许多生物过程都很重要,包括蛋白质在内质网(ER)中的折叠和蛋白质向质膜的转运。最近,Endie等人研究了水杨酸(一种带负电的糖)修饰对小鼠心室肌细胞KV离子通道的影响。为了研究潜在的机制,作者使用抗KV4.2抗体和抗KV1.5 (KCNA5)抗体(#APC-004)通过WB实验比较蛋白表达。尽管蛋白表达没有明显变化,但作者认为KV离子通道的硅酸修饰是微调KV离子通道活性的关键步骤。
KV4相互作用蛋白
KV离子通道活性的多样性可受蛋白-蛋白相互作用的影响。例如,Turnow等人证明KV4.3- DPP10a相互作用调节瞬态钾电流(Ito)。他们使用免疫荧光技术,利用抗KV4.3抗体在人心房肌细胞和中国仓鼠卵巢(CHO)中提供了KV4.3-DPP10a共定位的证据。此外,他们使用功能测试证明了这种相互作用与生理相关,因为在CHO21中没有DPP10a时钾电流是不可见的。
同样,Wang等人使用Anti-KV4.2抗体在大鼠新皮质脑切片和嗅球中证实了KV4.2-KChIP3-DPP10a之间的相互作用,并认为该蛋白复合物介导体内阈下钾电流。
心血管疾病中的KV4离子通道
钾离子通道调节正常心脏功能的电驱动力。特别是,它们起到恢复膜极化和平衡钠离子和钙离子等去极化离子的作用。
心肌肥厚是对心功能不全的一种适应性反应,在心肌肥厚后经常观察到心脏电活动受损。M3毒蕈碱受体是胆碱能受体的成员,支配心脏细胞并控制其电功能。Chen等人研究了M3过度表达是否能减轻心脏肥大后的不良电信号。为了验证这一假设,作者产生了过度表达M3毒蕈碱受体的转基因小鼠。使用Anti-CHRM3 Antibody(#AMR-006),作者通过WB实验证实了M3受体的过度表达,并观察到心脏电活动在横主动脉收缩模型后与假对照组相当。为了确定M3过度表达恢复心脏功能的潜在机制,作者检查了各种离子通道的表达,这些离子通道控制钾离子的流出,因此有可能重建正常的心脏节律。他们发现,M3毒蕈碱受体提高了Kir2.1的表达,但使用抗KV4.3抗体测定的KV4.3没有变化。
最近,一项在中国人群中进行的基因调查发现,KV4.3基因(KCND3)中的一个错义突变与心房颤动(房颤)有关。该突变导致KV4.3蛋白中的Thr 361置换为Ser(Thr→Ser)。为了深入研究导致心房颤动的机制,Huang等人在HEK293T细胞中表达了野生型KV4.3或其突变对应物以及KChIp2。利用该系统,他们发现Thr→Ser突变增加了KV4.3的总表达量并增加了其膜定位,这是用抗KV4.3抗体进行WB实验测定的结果(图2)。此外,作者测量了钾电流,发现Thr→Ser与KV4.3的功能增益有关。
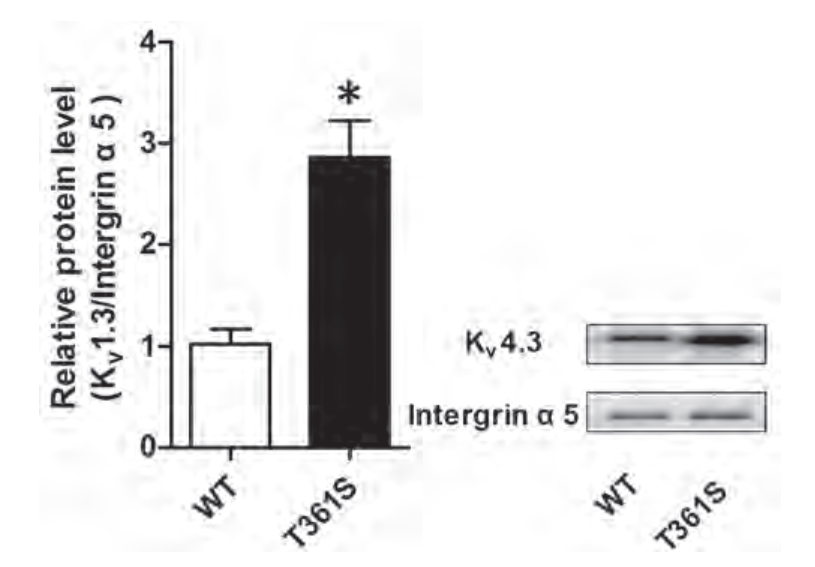
图2.带有缺义突变的KV4.3的细胞表面表达。
转染野生型(WT)KV4.3或KV4.3(T361S)突变体的HEK 293细胞的WB实验分析。用抗KV4.3抗体(#APC-017)免疫检测细胞表面KV4.3显示,与WT相比,突变体的细胞表面表达增加。Integrin α5用作负载对照。
经Impact Jourals许可,改编自参考文献8。
相反,Cheng等人证实,KV4.3在心肌细胞中过度表达可保护小鼠免于心力衰竭。具体而言,作者使用抗KV4.3抗体显示了KV4.3表达升高与钙调素依赖性蛋白激酶(CaMKII)磷酸化降低之间的联系,并认为这种保护作用是由于钙平衡所致。
最近的研究发现了KV相互作用蛋白中的新型突变,这些突变可对心脏功能产生削弱性影响,如引起心律不齐的Brugada综合征。因此,Portero等人发现了与该综合征相关的KVβ2突变。使用体外表达系统,作者能够证实Arg到Gln的置换并不影响KV4.3的表达,正如使用Alomone实验室的相应抗体进行WB实验所看到的那样,而是以一种尚未发现的方式影响心脏电生理学。
同样,Tsai等人在台湾人群中发现KChIP1拷贝数变异是房颤的强遗传预测因子。为了研究KChIP1如何参与房颤,作者使用Anti-KChIP1 (KCNIP1)抗体(#APC-141)在成年大鼠心脏中进行蛋白-蛋白相互作用研究,并使用抗钾离子通道KV4.2和KV4.3抗体或抗钙离子通道CaV1.2 (CACNA1C)抗体(#ACC-003)进行再检测。出乎意料的是,没有检测到这些蛋白,这表明KChIP1调节心脏性能的机制不同。作者尝试了一种基因方法,在心房细胞系HL-1中沉默KChIP1,发现钾离子电流和膜去极化发生了显著变化,表明KChIP1本身调节钾离子外向电流。
神经元功能障碍中的KV4离子通道
衰老导致的认知能力下降与海马中CA1和CA3锥体神经元功能失调有关。Simkin等人推测,导致老年大脑认知能力下降的CA3锥体神经元发射增加可能是由KV离子通道引起的。给予Phrixotoxin-1(#STP-700),一种选择性和强效的KV4.2和KV4.3离子通道阻断剂,可显著改善老年大鼠CA3神经元的电生理活性(图3)。其他结果表明,KV4.2抑制可能会延缓衰老过程中的神经退行性过程。
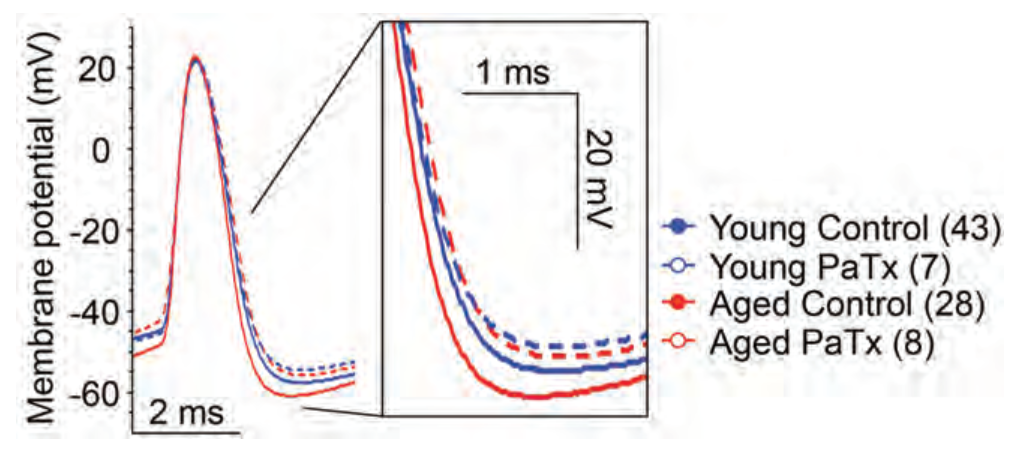
图3.Phrixotoxin-1抑制KV4.2和KV4.3可逆转衰老相关的快速过极化。
老化(红色)和年轻(蓝色)CA3神经元单个正向诱发动作电位的代表性轨迹,记录吸管中含有(虚线)和不含(实线)1 µM Phrixotoxin-1 (#STP-700)(PaTx)(从AP阈值开始)。PaTx处理将老化CA3神经元的快速后超极化(fAHP)降低到与年轻神经元相似的值。
经神经科学学会许可,改编自参考文献17。
帕金森病是渐进性神经退行性过程的另一个例子,α-突触核蛋白的蓄积可损害脆弱的神经元,如黑质(SN)多巴胺能神经元。在α-突触核蛋白A53T突变的基因工程小鼠中,观察到SN多巴胺能神经元(DA)选择性的高发射率。与体内模型类似,从突变的α-突触核蛋白DA神经元中分离出的神经元显示出更高的发射率,其模式表明起搏器电流发生了变化。电压门控的KV4离子通道先前被证明可控制多巴胺能神经元的起搏。应用特异性KV4离子通道阻断剂Phrixotoxin-2(#STP-710)完全阻止了对照组和α-突变体神经元之间电生理记录的差异(图4A)。此外,使用Anti-KV4.3抗体对小鼠脑切片进行免疫组化染色显示,KV4.3在α-突触核蛋白突变小鼠的黑质中表达更高(图4B)。这表明KV4活性或表达的改变是这种表型差异的基础。
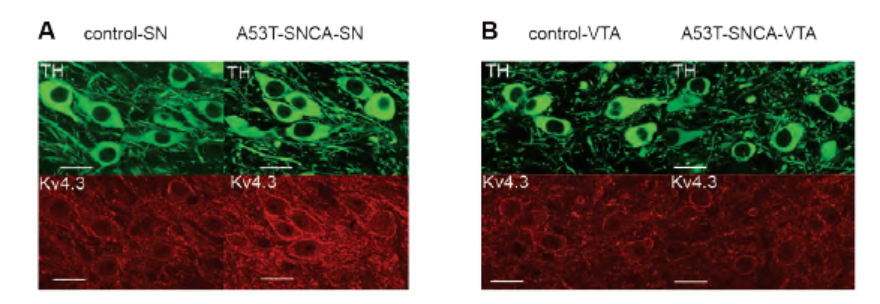
图4.KV4.3在α-突触核蛋白突变小鼠DA神经元中的表达增加。
使用Anti-KV4.3抗体(#APC-017)对小鼠脑切片进行免疫组化染色。A. KV4.3在α-突触核蛋白突变小鼠黑质DA神经元中的表达增加(右下图)。B. α-突触核蛋白突变小鼠腹侧被盖区DA神经元中KV4.3的表达不增加(右下图)。
经神经科学学会许可,改编自参考文献19。
不同类型的细胞对α-突触核蛋白水平升高的反应不同。例如,迷走神经背运动核(DMV)可耐受高水平的α-突触核蛋白,与SN多巴胺能神经元相比,其凋亡程度较轻。此外,α-突触核蛋白的积累会改变SN多巴胺能神经元的电活动,但对DMV神经元没有明显影响。与野生型相比,α-突触核蛋白A53T突变的小鼠脑切片免疫组化染色显示出相似的KV4.3水平和表达模式。
研究KV4离子通道的药理学方法
在过去的十年中,靶向KV4离子通道的小分子/肽抑制剂的清单已大幅增加。现在可以利用这些工具发现KV4离子通道参与的新功能和生物过程。例如,Phrixotoxin-1和AmmTx3 Toxin(#STA- 305)针对KV4.3和KV4.2的多肽毒素阻断剂被用于研究毒素瞬态钾离子电流如何影响前Botzeiger-1型神经元节律性及其对呼吸的影响。
类似地,特异性KV4.2阻断剂Heteropodatoxin-2 (#STH-340)被用于揭示第5层锥体神经元丛树突突触可塑性的新机制,丛状树突的低频电刺激会诱发长期增强活动。
参考文献
Argenziano, M. et al. (2017) J. Physiol. Sci. 67, 217.
Birnbaum, S.G. et al. (2004) Physiol.Rev. 84, 803.
Chen, X. et al. (2017) Cell.Physiol.43, 915.
Cheng, J. et al. (2017) Oncotarget 8, 104037.
Day, S.M. et al. (2017) Hippocampus 27, 1264.
Ednie, A.R. and Bennett, E.S. (2015) J. Biol.Chem.290, 2769.
Giudicessi, J.R. and Ackerman, M.J. (2012) Nat.Rev. Cardiol.9, 319.
Huang, Y. et al. (2017) Oncotarget 8, 115503.
Kim, J.E. et al. (2017) Front.Cell Neurosci.11, 413.
Lai, H.C. and Jan, L.Y. (2006) Nat.Rev. Neurosci.7, 548.
Lasser-Katz, E. et al. (2017) J. Neurosci.37, 47.
Liu, X. et al. (2016) Cell.Physiol.39, 102.
Phillips, W.S. et al. (2018) J. Neurosci.38, 3039.
Portero, V. et al. (2016) J. Am.Heart Assoc. 5, e003122.
Sandler, M. et al. (2016) Neuron 90, 1028.
Shiotani, H. et al. (2018) J. Comp.Neurol.526, 1527.
Simkin, D. et al. (2015) J. Neurosci.35, 13206.
Snyders, D.J. (1999) Cardiovasc.Res. 42, 377.
Subramaniam, M. et al. (2014) J. Neurosci.34, 13586.
Tsai, C.T. et al. (2016) Nat.Commun.7, 10190.
Turnow, K. et al. (2015) Basic Res. Cardiol.110, 5.
Wang, W.C. et al. (2015) J. Comp.Neurol.523, 608.
Wulff, H. et al. (2009) Nat.Rev. Drug Discov.8, 982.
部分相关产品推荐
| 货号 | 产品名 | 描述 |
| APC-023 | Anti-KV4.2 Antibody | 离子通道抗体 |
| AMR-006 | Anti-CHRM3 Antibody | 离子通道抗体 |
| APC-017 | Anti-KV4.3 Antibody | 离子通道抗体 |
| APC-004 | Anti-KV1.5 (KCNA5) Antibody | 离子通道抗体 |
| APC-141 | Anti-KChIP1 (KCNIP1) Antibody | 离子通道抗体 |
| ACC-003 | Anti-CaV1.2 (CACNA1C) Antibody | 离子通道抗体 |
| STP-700 | Phrixotoxin-1 | 钾离子通道阻断剂 |
| STP-710 | Phrixotoxin-2 | 钾离子通道阻断剂 |
| STA- 305 | AmmTx3 Toxin | KV4.3和KV4.2离子通道阻断剂 |
| STH-340 | Heteropodatoxin-2 | KV4.2离子通道阻断剂 |
关于Alomone
Alomone是来自以色列的离子通道专家,提供与离子通道和膜蛋白(TRP通道、钠/钾/钙通道、水通道、GPCRs)相关的抗体、拮抗剂/激动剂(小分子化合物和毒素)、神经生长因子等。
优宁维作为Alomone在中国区的独家授权代理商,建立了中国现货库,为广大客户带去更快的物流,更好的服务。










 危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)
危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)  营业执照(三证合一)
营业执照(三证合一)