一提到安定或地西泮,人们就会想到抗抑郁药和抗焦虑药。如果您有药理学背景,您可能还会想到苯二氮卓(BDZs)这类古老的药物。但氧化应激和肾上腺素能受体的调节又是怎么回事呢?罗马国立卫生研究院的一项新研究对地西泮等β-AR激动剂治疗期间β1-和β2-肾上腺素能受体(β1- AR和β2-AR)的调节提供了一些令人着迷的见解1。
在这项研究过程中,研究人员使用了针对 β-ARs 细胞外表位的特异性抗体和流式细胞术来评估单核细胞中这些受体的细胞表面调控。他们发现地西泮会刺激氧化应激的调节剂,进而影响细胞表面的 β1-AR 密度。此外,他们还发现这些受体不易受激动剂介导的下调影响。
什么是β-肾上腺素能受体?
β-肾上腺素能受体属于 G 蛋白偶联受体(GPCR)超家族,通过激活腺苷酸环化酶对儿茶酚胺做出反应。GPCR 具有复杂的信号调节机制,如下调细胞表面受体密度2。
β-ARs亚型β1-、β2-和β3-ARs在组织分布、脱敏机制和激活特定信号通路方面各不相同,在控制心脏功能和调节免疫活动方面发挥着不同的作用。因此,人们非常希望了解调节 β-AR 表达的机制,以便针对与 β-AR 失调相关的疾病开发出更有效的疗法。因此,在开发治疗因 β-AR 失调引起的疾病的方法时,β-AR 表达是研究的首要候选对象。
虽然人们对激动剂介导的人类β2-肾上腺素能受体下调了解很多,但对人类 β1-AR下调的了解却较少。有趣的是,一些研究表明,氧化应激在调节 β-AR 的表达中发挥作用3,包括选择性地降低小鼠心肌细胞中 β1 肾上腺素能受体的表达。
外周苯并二氮杂卓受体(PBR)又名线粒体转运蛋白(TSPO),在调节氧化应激、线粒体生理机能和细胞能量方面起着至关重要的作用。它还能使压力过大的心肌细胞的细胞能量和氧化还原平衡正常化。因此,研究人员假设 PBR 信号传导可能参与了细胞表面 β-AR 密度的调节。
为了验证这一点,他们研究了不同的PBR配体如何影响单核细胞中β1和β2-AR的表面密度。
合适的研究试剂
抗体特异性显然是所有研究人员都非常关注的问题。但当涉及到 GPCR 等具有挑战性的靶标时,对抗体的信心至关重要。本研究的研究人员使用了Alomone的抗体来检测细胞表面β1-和β2-肾上腺素能受体的表达。
研究小组在流式细胞术和免疫荧光测定中使用了FITC 直标抗体: Anti-β1-Adrenergic Receptor (extracellular)-FITC Antibody (#AAR-023-F)和Anti-β2-Adrenergic Receptor (extracellular)-FITC Antibody (#AAR-016-F)。由于这些抗体靶向细胞外表位,设计用于识别小鼠、大鼠和人类样本中的β1和β2肾上腺素能受体,因此他们在表达β1和β2肾上腺素能受体亚型的细胞(如人类THP-1细胞)以及缺乏β1-AR、β2-AR或两种AR的基因敲除(KO)小鼠单核细胞中进行了测试。
用抗β1-和抗β2-肾上腺素能受体抗体进行免疫测定
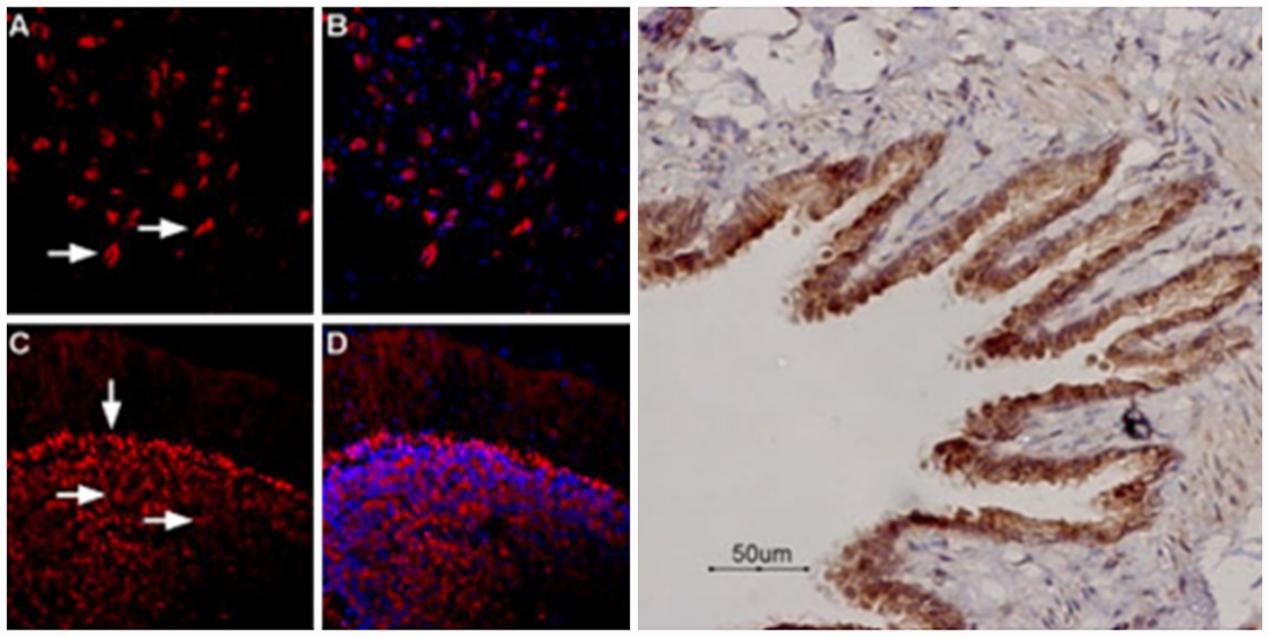
(左图)使用 Anti-β1-Adrenergic Receptor (extracellular) Antibody (#AAR-023)(1:400)对大鼠背侧剑突核和小鼠小脑进行免疫组化染色。A. β1-肾上腺素受体染色(红色)出现在大鼠背侧剑突核的神经元中(水平箭头)。C. 在小鼠小脑的颗粒细胞(水平箭头)和浦肯野细胞层(垂直箭头)中检测到 β1-肾上腺素受体染色(红色)。B、D. 用 DAPI 作为反染色剂进行核染色(蓝色)。(右图)使用抗β2-肾上腺素能受体(细胞外)抗体(#AAR-016)(1:100)对大鼠肺部石蜡包埋切片进行免疫组化染色。β2-肾上腺素受体在呼吸道上皮细胞中表达。血色素用作反染色。
流式细胞仪显示,抗体清楚地标记了细胞表面内源性表达 β-AR 的 THP-1 细胞中的受体。
现在很清楚,Alomone的β-AR抗体能结合β-AR,但它们能区分β1和β2-AR吗?研究小组利用分离自小鼠的外周血单核细胞显示,野生型小鼠细胞中β1-和β2-AR表达的MFI值明显高于KO型小鼠细胞。Alomone 的 β-AR 抗体成功结合了 β-AR 并区分了 β1- 和 β2-AR 亚型。抗体验证完成后,研究的三个主要问题就开始了:β1-AR 和 β2-AR 是否受 β-AR 激动剂的不同调节?氧化应激和 PBR/TSPO 配体对 β-AR 表面密度有影响吗?造成 β-AR 表达变化的机制是什么?
β1-和β2-肾上腺素能受体是否受到不同的调控?
以前的研究表明,与β2-AR相比,β1-AR对激动剂的下调具有抵抗力4。为了验证这一点,研究人员用肾上腺素或异丙肾上腺素(一种外源性儿茶酚胺)刺激单核细胞长达 48 小时。流式细胞术和Alomone针对β-ARs的选择性抗体显示,内源性β2-肾上腺素能受体的细胞表面密度降低了,而β1-ARs则不受影响。这种对β-ARs的不同调控可能对开发针对不同组织中β肾上腺素能受体的治疗药物具有重要意义。
氧化应激会影响β1-和β2-肾上腺素能受体的密度吗?
之前的研究表明,通过急性过氧化氢或慢性多柔比星治疗诱导的氧化应激会降低心肌细胞中β1-AR的表达5,基于这一研究,研究小组想看看氧化应激是否也会影响β1-肾上腺素能受体的密度。
研究人员用地西泮(PBR/TSPO 的配体)处理单核细胞,发现它导致了 β1-AR 密度的降低,但 β2-AR 的丰度没有变化。与β-受体阻滞剂普萘洛尔不同,PBR/TSPO拮抗剂PK1119能够逆转地西泮的作用,这表明PBR/TSPO参与了β1-ARs细胞表面密度的调节。
这一发现表明,对β-ARs的影响实际上并非由氧化应激介导,因为在地西泮处理后没有观察到氧和氮自由基的产生发生变化。
β1-肾上腺素能受体密度变化背后的机制是什么?
到目前为止,我们已经看到,β1-和β2-AR 在单核细胞中确实受到不同程度的调节,β1-AR 对激动剂介导的下调具有更强的抵抗力。相反,暴露于地西泮后,β1-AR 密度降低,我们发现 PBR 拮抗剂 PK11195 可拮抗这种效应。为了推断这些结果的机制,研究人员研究了地西泮如何影响转录和受体合成,以及单核细胞对 GRK-2 的表达,GRK-2 是一种参与 β 肾上腺素能受体脱敏和内化的激酶6。他们还研究了地西泮对β1和β2肾上腺素能受体与Gα蛋白亚基或β-arrestin-2相互作用的影响。
有趣的是,他们发现地西泮对β1-AR或GRK-2的mRNA或蛋白水平均无影响,也不影响β-AR亚型与Gα蛋白或β-arrestin-2的相互作用。然而,PBR/TSPO在调节β1-AR表面密度方面的作用似乎很明显。因此,研究人员推测地西泮可能会通过改变其向质膜的再循环来影响β1-AR的表面密度。
对心血管的影响
这项研究为了解β-AR行为和相互作用的复杂调控机制提供了重要见解。考虑到β-AR在心血管治疗中的重要性(例如以β-受体阻滞剂的形式),这些研究结果表明,靶向PBR/TSPO可能是调节β1-AR表达的一种有前途的策略。
这项研究还强调了验证抗体的重要性,即使是高度特异性的抗体也需要验证!Alomone 的抗体能让您灵活地使用多种免疫测定来揭示最复杂的机制。
文章部分相关产品
靶向膜结合受体具有挑战性。这就是Alomone几十年来一直在内部生产和验证一系列抗体的原因。如果您喜欢这篇文章讨论的研究,您可能会对以下这些独特的工具感兴趣:
| 产品名称 | 货号 | 产品描述 | 规格 |
| Anti-β1-Adrenergic Receptor (extracellular)-FITC Antibody | AAR-023-F | β1-AR(胞外)FITC直标抗体 | 15μL/50μL/2×50μL/5×50μL/10×50μL |
| Anti-β2-Adrenergic Receptor (extracellular)-FITC Antibody | AAR-016-F | β2-AR(胞外)FITC直标抗体 | 50μL/2×50μL/5×50μL/10×50μL |
| β-Adrenergic Receptor Antibody Explorer Kit | AK-500 | β-AR抗体组合套装 | 6 Vials |
| Rabbit IgG Isotype Control-FITC | RIC-001-F | 兔IgG同型对照-FITC标记 | 50μL |
| Muscarinic Toxin 3 | M-140 | M1 和 M4 毒蕈碱受体及肾上腺素受体的拮抗剂 | 0.1mg/0.25mg/0.5mg/1mg/5mg |
关于Alomone
Alomone是来自以色列的离子通道专家,提供与离子通道和膜蛋白(TRP通道、钠/钾/钙通道、水通道、GPCRs)相关的抗体、拮抗剂/激动剂(小分子化合物和毒素)、神经生长因子等。
优宁维作为Alomone在中国区的独家授权代理商,建立了中国现货库,为广大客户带去更快的物流,更好的服务。
References
1.Matarrese P, Maccari S, Gambardella L, Vona R, Barbagallo F, Vezzi V, Stati T, Grò MC, Giovannetti A, Catalano L, Molinari P, Marano G, Ambrosio C. Benzodiazepine diazepam regulates cell surface β1-adrenergic receptor density in human monocytes. Eur J Pharmacol. 2023 Jun 5;948:175700. doi: 10.1016/j.ejphar.2023.175700. Epub 2023 Mar 29. PMID: 37001579.
2.Gainetdinov RR, Premont RT, Bohn LM, Lefkowitz RJ, Caron MG. Desensitization of G protein-coupled receptors and neuronal functions. Annu Rev Neurosci. 2004;27:107-44. doi: 10.1146/annurev.neuro.27.070203.144206. PMID: 15217328.
3.Zhu J, Steinberg SF. β1-adrenergic receptor N-terminal cleavage by ADAM17; the mechanism for redox-dependent downregulation of cardiomyocyte β1-adrenergic receptors. J Mol Cell Cardiol. 2021 May;154:70-79. doi: 10.1016/j.yjmcc.2021.01.012. Epub 2021 Feb 6. PMID: 33556394; PMCID: PMC8068644.
4.Liang W, Austin S, Hoang Q, Fishman PH. Resistance of the human beta 1-adrenergic receptor to agonist-mediated down-regulation. Role of the C terminus in determining beta-subtype degradation. J Biol Chem. 2003 Oct 10;278(41):39773-81. doi: 10.1074/jbc.M304482200. Epub 2003 Jul 29. PMID: 12888573.
5.Park M, Steinberg SF. Carvedilol Prevents Redox Inactivation of Cardiomyocyte Β1-Adrenergic Receptors. JACC Basic Transl Sci. 2018 Aug 28;3(4):521-532. doi: 10.1016/j.jacbts.2018.06.002. PMID: 30175276; PMCID: PMC6116783.
6.Iaccarino G, Ciccarelli M, Sorriento D, Galasso G, Campanile A, Santulli G, Cipolletta E, Cerullo V, Cimini V, Altobelli GG, Piscione F, Priante O, Pastore L, Chiariello M, Salvatore F, Koch WJ, Trimarco B. Ischemic neoangiogenesis enhanced by beta2-adrenergic receptor overexpression: a novel role for the endothelial adrenergic system. Circ Res. 2005 Nov 25;97(11):1182-9. doi: 10.1161/01.RES.0000191541.06788.bb. Epub 2005 Oct 20. PMID: 16239589.










 危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)
危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)  营业执照(三证合一)
营业执照(三证合一)