免疫细胞培养的六个基本流程:样本制备、细胞分选、分型鉴定、扩增&培养、质量优化、后续研究。小优已经给大家详细介绍了《免疫细胞培养通关技巧之样本制备》和《免疫细胞培养通关技巧之细胞分选》,今天我们继续一起学习分型鉴定的相关内容。
分型鉴定(Phenotyping):利用细胞表面标记物进行细胞鉴定,目前常用的方法是流式细胞术。
写在前面:
如果我们利用流式分选得到目的细胞,一般来说,分选后需要回测细胞进行目的细胞的纯度验证,即分型鉴定,也就是说流式分选后目的细胞的分型鉴定与分选所用的细胞标记物基本相同。
如果我们利用磁珠分选得到目的细胞,就意味着我们需要再设计一个流式实验进行分型鉴定。
下面,小优给大家介绍通过流式细胞术进行免疫细胞分型鉴定需要确定的【六大方面】:
01 细胞数量
分选后的细胞悬液需要进行计数,一般为5~10*106/ml,确保有足够的细胞数量可以上机。
02 细胞表面标记物
细胞表面标记物的重要性不言而喻,细胞分选时也会涉及到,分型鉴定时我们也需要通过细胞表面标记物来进行圈门逻辑的设置。需要注意的是,分型鉴定后的细胞需要进行体外扩增培养,不能选择细胞的胞内标记物(胞内检测需对细胞进行固定破膜处理,最后得到的就是死细胞了)。
比如磁珠分选小鼠脾脏Treg细胞后进行流式分型鉴定的圈门逻辑如下:

图1 流式鉴定小鼠脾脏Treg细胞圈门逻辑
03 荧光素标记
流式分选和流式鉴定的配色原则是一致的,抗体偶联荧光素的选择原则,小优在【细胞分选】中已经给大家汇总啦,小伙伴们按需查看。
04 死活染料
如果分选后的细胞立即进行分型鉴定,一般不用染死活,冻存细胞建议加入死活染料染色。
目前流式用死活染料分为两大类:胺基类染料、核酸类染料。两者的原理、使用阶段、对应的特定通道小优也给大家做了汇总。由于核酸类死活染料可选产品少,占据了一些重要的荧光通道,小优也建议大家优先抗体配色后进行核酸类死活染料的荧光搭配选择。

图2死活染料原理及对应的特定通道
Tips:
①使用FVS等胺基类染料时,需要使用无叠氮钠和无蛋白的DPBS溶液进行洗涤和重悬细胞;
②染完FVS之后,需要使用含有蛋白(FBS、BSA)的染色液洗涤两次,使游离的FVS染料失效,便于后续染色;
③核酸类染料的加入为所有操作的最后一步,临上机前5-10 min加入即可,无需洗涤;
④核酸类染料与核酸空间共价结合,荧光弱,染色后,避免洗涤,剧烈涡旋或过度用力吹打,避免核酸类死活染料的脱落,导致假阴性;
⑤核酸类死活染料染色后,需及时上机(1h内),避免染料的毒副作用导致额外的死细胞产生;
⑥核酸类死活染料4℃保存,不能冻存。
05 流式对照
流式对照对于实验的成功也是至关重要的,小优在下表里也给大家列举了一些对照的作用以及它们的应用场景。

图3 流式对照汇总
Tips:
Fc受体阻断剂推荐使用,可减少抗原抗体的非特异性结合以及产生过强的背景信号,可使用:
①商业化Fc Block
②样本种属或流抗来源种属的血清
③样本种属或流抗来源种属的IgG
06 染色方案
染色方案也可通过预实验来确定,主要是为了防止荧光选择不当,导致染色信号过强或过弱。需要考虑的因素包括但不限于抗体用量、染色体积、孵育时间、孵育温度、洗涤次数等。
Tips:
①不同的检测指标、抗体品牌、荧光素标记、抗体批次都会导致抗体的效价不同,要得到最优的实验方案和结果,我们要对每一个抗体进行抗体滴定实验以确定最佳的抗体用量(具体操作方案可参考视频教程 :https://www.bilibili.com/video/BV13t4y1B7Ch/?spm_id_from=333.999.0.0&vd_source=1aa714d23cbae1f961f525e8197e9960);
②一般来说,染色体积不变,抗体用量不变(细胞数量10倍左右的浮动范围稳定);染色体积增加,必须增加抗体用量以保持抗体浓度稳定;
③染色体积一般为50-100μl;
④抗体孵育时间与温度:最常用的是4℃,30-60 min,可减少非特异性结合,荧光最稳定不易淬灭;临床检测最常用室温(20℃左右),15-30 min;
⑤细胞离心,推荐300g-500g,5 min,抗体的洗涤推荐直接使用流式管操作,1次洗液用量2ml;
⑥为了保证细胞的活力,染色后需尽快上机。
小优也给大家针对上述内容做了重点汇总:
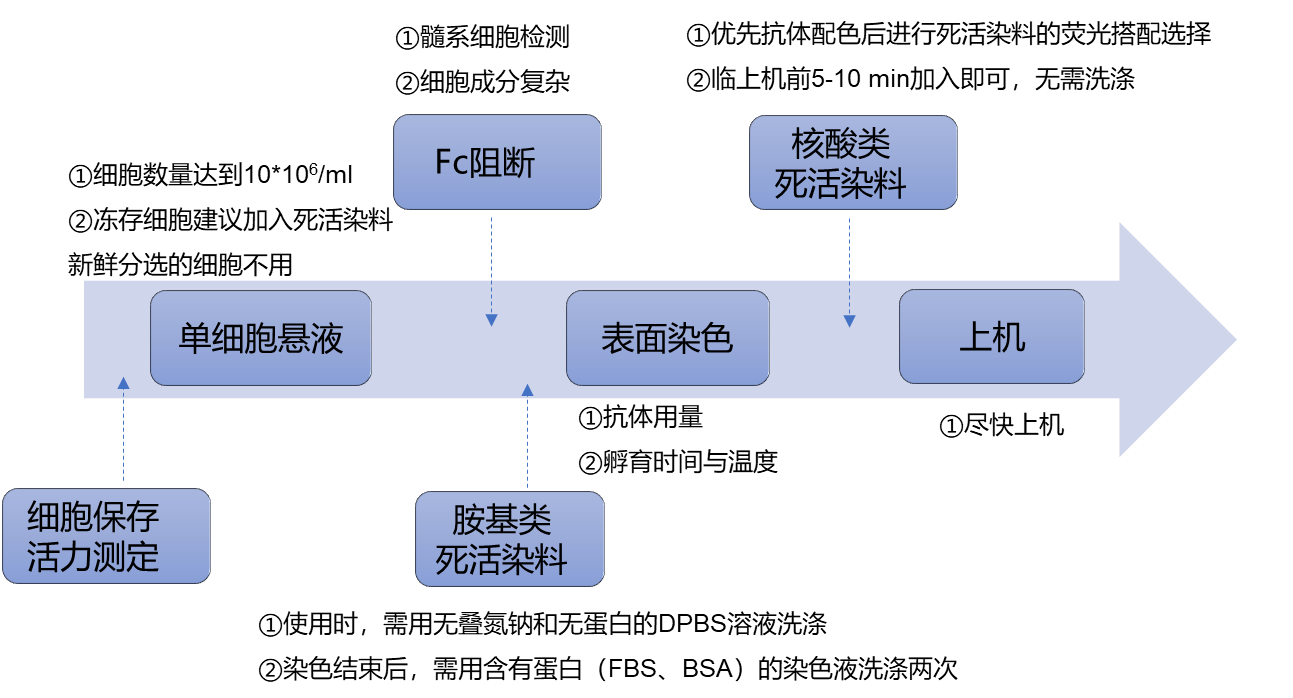
图4 利用流式进行免疫细胞分型鉴定重点总结
写在最后:
如果磁珠分选后的细胞我们不能立即进行分型鉴定,那就涉及到细胞的保存以及活力测定。
短期保存:将分选得到的细胞用适量含10%-20%灭活小牛血清的Hanks、Tc-199、RPMI1640或其他培养基重悬至合适密度,置于4℃保存。
长期保存:液氮深低温(-196℃)保存细胞,可加入10%二甲亚砜(DMSO)作为保护剂。
活力测定:最简便常用的方法为台盼蓝染色法。台盼蓝是一种阴离子型染料。这种染料不能透过活细胞正常完整的细胞膜,故活细胞不着色;死细胞的细胞膜通透性增加,染料可通过细胞膜进入细胞,故死细胞着色呈蓝色。
做好细胞的保存、复苏及复苏后的活力测定,就可以按照上面的步骤再通过流式细胞术进行细胞的分型鉴定了!
好啦,免疫细胞培养通关技巧之分型鉴定的内容也给大家介绍完了,下一个扩增&培养,我们不见不散呀!
资料来源:
图片来源于优宁维;视频来源于哔哩哔哩半瓶流式小美腻
部分相关产品:
| 货号 | 产品名称 |
| 557659 | APC-Cy7 Rat Anti-Mouse CD45(30-F11) |
| 553061 | FITC Hamster Anti-Mouse CD3e(145-2C11) |
| 550954 | Ms CD4 PerCP-Cy5.5 RM4-5 100ug |
| 557192 | APC Rat Anti-Mouse CD25(PC61) |
| abs9358-10mL | PI染色液 |
| abs9104-1mg | 7-AAD |
| abs47047616-50ml | DAPI染色液 |
| 565799 | Green Nucleic Acid Stain |
| 564904 | DRAQ7 |
| 565803 | Red Nucleic Acid Stain |
| 562247 | Fixable Viability Stain 450 |
| 564406 | Fixable Viability Stain 510 |
| 565694 | Fixable Viability Stain 575V |
| 564407 | Fixable Viability Stain 520 |
| 564995 | Fixable Viability Stain 570 |
| 564996 | Fixable Viability Stain 620 |
| 564405 | Fixable Viability Stain 660 |
| 564997 | Fixable Viability Stain 700 |
| 564219 | Human BD Fc Block(Fc1.3216) |
| 553141 | Purified Rat Anti-Mouse CD16/CD32 (Mouse BD Fc Block)(2.4G2) |
| 550270 | Purified Mouse Anti-Rat CD32(D34-485) |










 危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)
危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)  营业执照(三证合一)
营业执照(三证合一)