Nature文献解析:疼痛竟然还可以帮助癌症?快来一看究竟!
在癌细胞复杂的生物学特性中,有一个很少被讨论但却至关重要的组成部分:神经纤维。 近期,一篇发表在Nature上的文献《Nociceptor neurons affect cancer immunosurveillance》解释了黑色素瘤如何利用神经纤维生存【1】。黑色素瘤似乎利用了疼痛的力量来破坏我们身体的防御机制。
黑色素瘤与神经相互作用
癌症丰富的神经纤维网络是导致其发病的不常见因素之一【2】。例如,在前列腺癌中,神经祖细胞最终会有助于肿瘤的发展和扩散【3】。虽然神经纤维嵌入肿瘤内并不是什么新鲜事,但这种相互作用的后果,尤其是与疼痛信号感觉神经元(痛觉神经元)的相互作用的后果,却一直难以捉摸。在这项令人难以置信的合作研究中,科学家们发现,当黑色素瘤细胞与这些痛觉神经元相互作用时,它们不仅会促进这些神经元的生长和活动,而且还会提高它们对疼痛刺激的敏感性【4】。
提高疼痛探测器的灵敏度
黑色素瘤会主动影响邻近痛觉感受器的行为,使其反应更加敏感。研究人员能够证明,当在黑色素瘤细胞存在的情况下培养痛觉感受器时,它们对疼痛刺激的反应会增强,这说明了黑色素瘤的操纵能力。
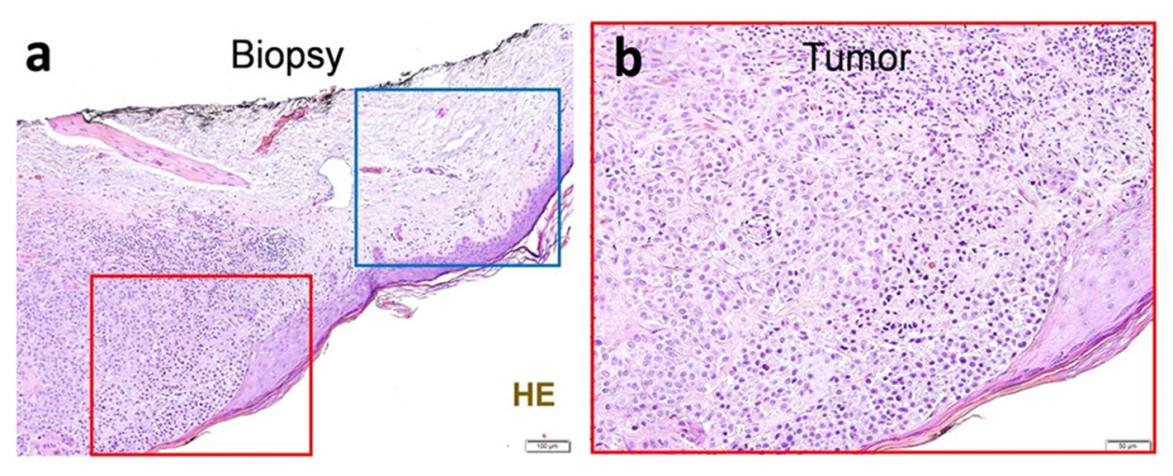
在探索黑色素瘤与神经的相互作用时,他们注意到,尽管人类恶性细胞和免疫细胞都不表达神经元起源基因(通过 RNA 测序确定),但在黑色素瘤患者的活检组织中却能看到它们的表达。使用Alomone Lab的Anti-TRPV1 antibody(#ACC-030)来识别TRPV1+神经元,他们发现这些神经元与痛觉有关,与邻近的健康组织相比,这些神经元在黑色素瘤中的表达量大约增加了两倍。有趣的是,他们发现肿瘤浸润淋巴细胞(TILs)的数量与这些疼痛受体的增加有关(图 1)。
支配患者黑色素瘤的 TRPV1+ 神经元
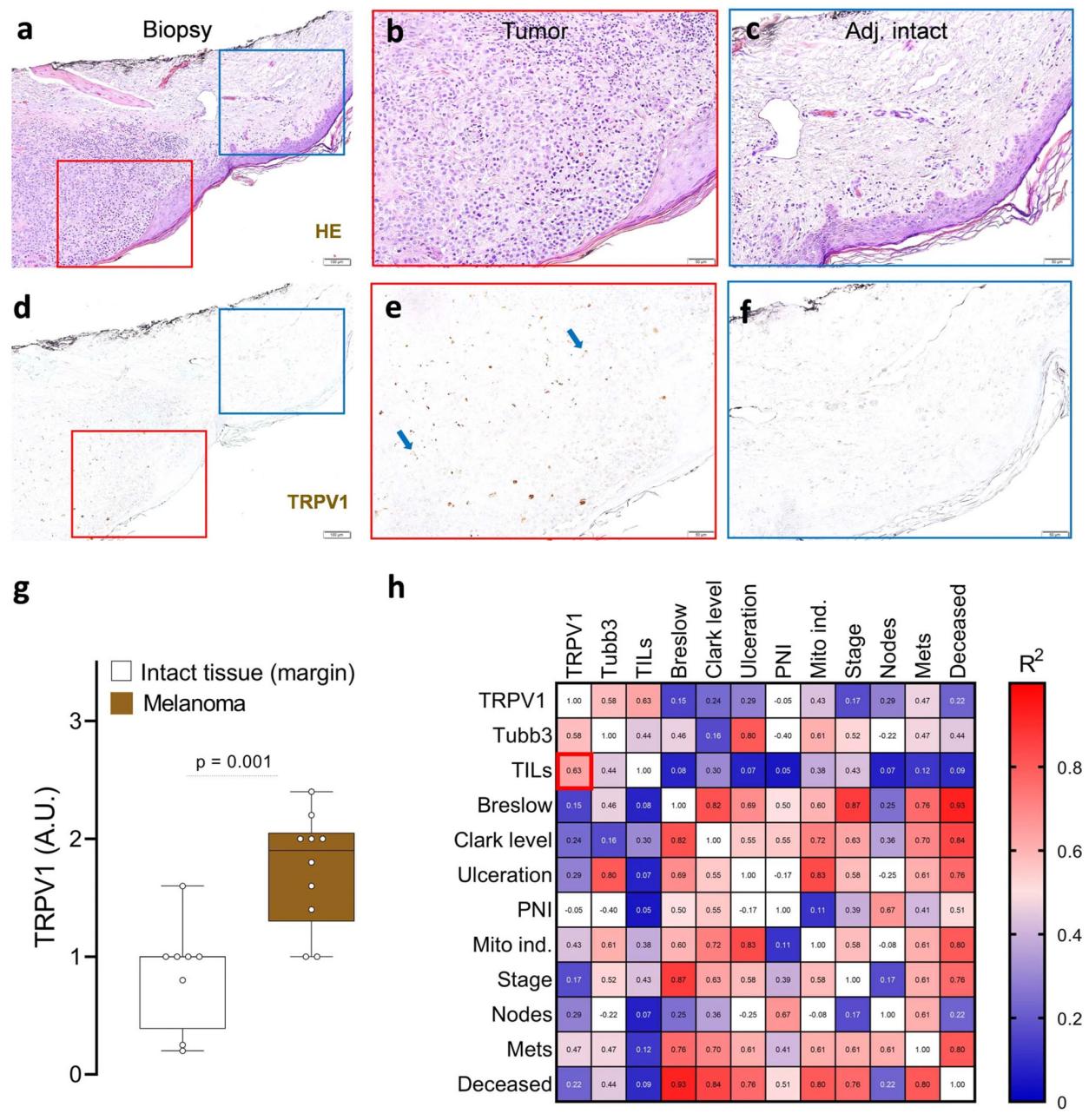
图 1.患者黑色素瘤切片经苏木精-伊红染色(a-f),并通过免疫组化方法分析 TRPV1(d-f;棕色)神经元的存在(使用Alomone的Anti-TRPV1 antibody (#ACC-030))与邻近的健康皮肤(蓝色方框划定;a,c,d,f)相比,肿瘤(红色方框划定;a-b,d-e)中的 TRPV1+ 神经元(g)含量增加。肿瘤切片中 TRPV1 免疫标记的增加主要与肿瘤浸润白细胞(h)水平的增加相关,这是对患者病理报告进行回顾性相关分析后得出的结果。数据显示为具有代表性的免疫组化图像(a-f)、框须图(从最小值到最大值;框从第 25 百分位数到第 75 百分位数,中间线表示中位数),其中单个数据点已给出(g)或显示皮尔逊相关性(R2)的热图(h)。人数如下:a-f:n=10;g:完整(n=8)、肿瘤(n=10);h:n=10。切片由两名经验丰富的医学病理学家盲法评分。P 值显示在图中,通过双侧非配对学生 t 检验确定(g)。比例尺 = 100 μm(a,d),50 μm(b,c,e,f)。图片和图例来自 Balood, M. et al. (2022) Nature, 611(7935), 405-412.
为了深入探讨这一问题,我们将表达 GFP 的黑色素瘤细胞引入特定品种的小鼠体内,结果发现肿瘤周围和内部存在大量 NaV1.8+ 痛觉感受器神经元。其他体外研究表明,当 TRPV1+ 感受器和黑色素瘤细胞一起培养时,感受器会主动向黑色素瘤细胞生长。这种行为类似于癌症的新血管生成,即形成新的血管为肿瘤提供营养。
黑色素瘤似乎有能力改变痛觉感受器的敏感性。涉及有害配体的测试表明,黑色素瘤细胞会提高这些痛觉感受器的反应能力,从而导致痛觉感受器的敏感性增强。当DRG神经元与黑色素瘤细胞共同培养时,培养基中会主动释放降钙素基因相关肽(CGRP),这是一种免疫调节神经肽。基因表达分析证实,与疼痛和疼痛调节有关的基因在接触黑色素瘤细胞后发生了显著变化。
SLPI 在痛觉感受器敏化中的作用
为了了解黑色素瘤致敏痛觉感受器的机制,我们开发了一种模拟黑色素瘤环境的共培养系统。一个重要发现是,当黑色素瘤细胞与DRG神经元或特异性细胞毒性T细胞共培养时,分泌型白细胞蛋白酶抑制剂(SLPI)在黑色素瘤细胞中过度表达。研究发现,SLPI 除了已知的功能外,还能激活 DRG 神经元,尤其是痛觉神经元。这种激活导致这些神经元释放 CGRP,从而揭示了黑色素瘤可能用于提高疼痛敏感性的途径。体内试验进一步证实,将SLPI引入小鼠体内确实会导致疼痛敏感性增强。
研究人员还发现,黑色素瘤分泌的SLPI可作用于痛觉感受器,启动钙离子流入、神经肽释放和热超敏反应。这表明,这些痛觉感受器可以检测到恶性细胞的存在,并可能对其做出反应。一个耐人寻味的观察结果是,对热痛敏感性的提高与肿瘤内特异性免疫细胞的增加呈正相关(图2)。
SLP1激活并作用于痛觉神经元
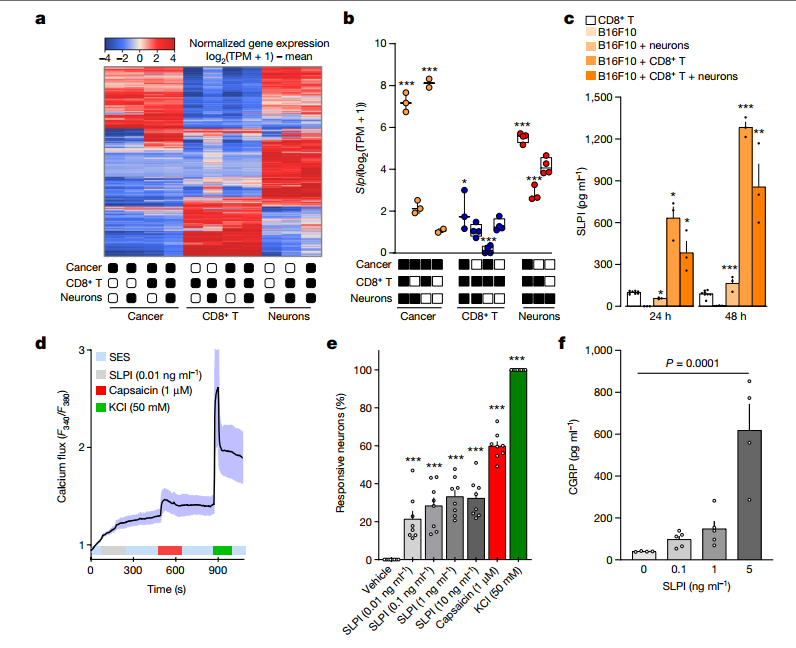
图2:肿瘤分泌的SLPI驱动伤害感受器神经元释放CGRP。a-c、幼稚DRG神经元(Trpv1cre::- cherff - egfpfl /WT)、B16F10-mCherryOVA细胞和ova特异性细胞毒性CD8+ T细胞单独或联合培养。48 h后,收集细胞,纯化FACS并进行RNA测序。a,分类神经元分子图谱的分层聚类描述了每组中富集的不同转录本组。b,计算deg,当与ova特异性细胞毒性CD8+ T细胞、DRG神经元或两者共培养时,发现Slpi在癌细胞中过表达。c, B16F10-mCherry-OVA细胞在与原始DRG神经元和ova特异性细胞毒性CD8+ T细胞共培养(24 h或48 h)时分泌SLPI,在48 h后效果最大。d - f,使用钙显微镜,我们发现SLPI (10 pg ml−1 - 10 ng ml−1)激活了大约20%培养的初始DRG神经元(d,e)。用SLPI激活培养的神经元(3小时)也会导致CGRP的显著释放(f)。数据显示为显示标准化基因表达的热图(log2(1 + TPM) - mean (a)),框和哨子图(如图1b,c) (b)所定义)或mean±s.e.m。(氟)。N如下:a,b: N = 2-4组;c:除CD8+ T细胞外,其余各组n = 3 (n = 8);D: n = 17;E: n = 8 /组;f: 0 ng毫升−1 (n = 4), 0.1 ng毫升−1 (n = 5), 1 ng毫升−1 (n = 5), 5 ng毫升−1 (n = 4)。c-f的实验独立重复了三次,结果相似。测序实验不重复(a,b)。P值采用事后Bonferroni (b,e,f)或双侧未配对Student 's t检验(c)进行单因素方差分析。*P≤0.05,**P≤0.01,***P≤0.001。
CGRP 的作用:一把双刃剑
神经肽 CGRP 是这一恶性联盟的关键角色之一。CGRP 由这些超敏痛觉感受器大量产生,它有一个阴险的作用:直接导致 CD8+ T 细胞衰竭,而 CD8+ T 细胞是我们的免疫系统抵御黑色素瘤的主要屏障。这又是为什么呢?T 细胞,尤其是具有细胞毒性的 CD8+ 细胞,完全有能力消除癌细胞等威胁。但 CGRP 似乎消耗了它们的活力,损害了它们抵御黑色素瘤入侵的能力。
利用三阴性黑色素瘤小鼠模型,将 B16F10-mCherry-OVA 细胞引入八周大的小鼠体内。研究结果表明,在没有痛觉感受器的情况下,小鼠的寿命不仅延长了约 2.5 倍,而且肿瘤的生长也明显减少。值得注意的是,在肿瘤生长减少的同时,细胞毒性肿瘤浸润 CD8+ T 细胞也在增加。相反,在通过注射Alomone的Resiniferatoxin #(R-400)(TRPV1通道蛋白的激活剂)后,PD-1+LAG3+TIM3+ CD8+ T 细胞的比例明显下降(图 3)。
这些数据描绘了一幅令人信服的图景,暗示痛觉神经元在驱动瘤内衰竭 T 细胞群方面发挥着关键作用。有证据显示,在瘤内 CD8+ T 细胞明显衰竭前数天就出现了热超敏反应,这进一步支持了这一假设。值得注意的是,这种痛觉过敏在任何可测量的肿瘤生长之前就已出现。
细胞衰竭之所以重要,是因为衰竭的 T 细胞失去了功能效力,包括产生关键免疫分子(IFNγ、TNF 和 IL-2)的能力和增殖能力。这些 T 细胞还会同时增加衰竭标记物(如 PD-1、LAG3 和 TIM3)的表达,从而降低它们消灭癌细胞的效率。
基因消融痛觉感受器可保护抗肿瘤免疫力
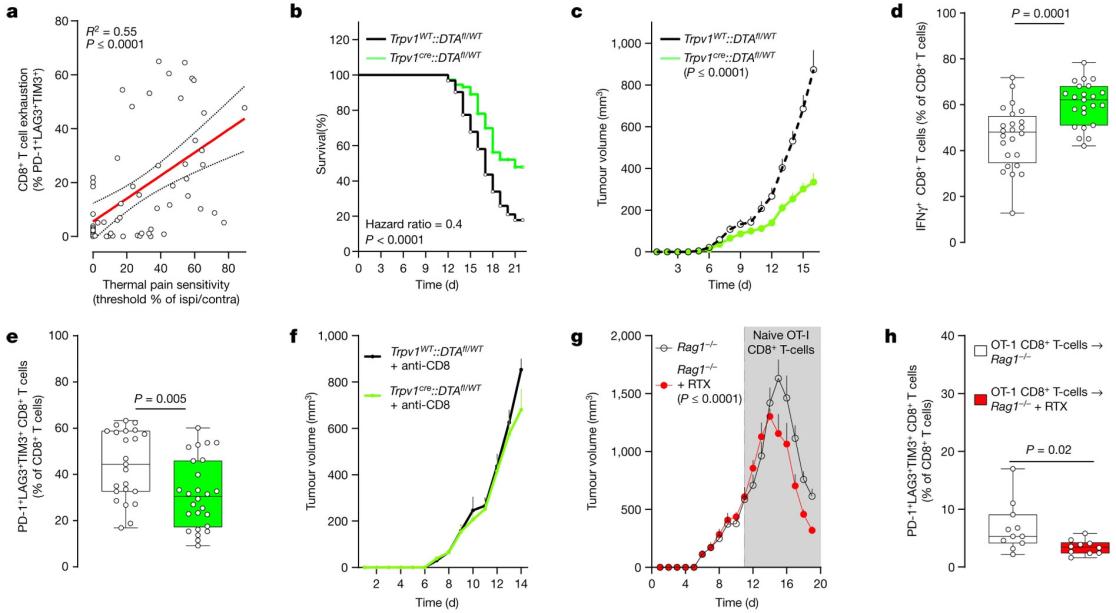
图 3:a,野生型小鼠的左后爪注射异位 B16F10-mCherry-OVA 细胞(2 × 105 cells,i.d.)。肿瘤接种后第13天,瘤内CD8+ T细胞衰竭与热痛觉过敏呈正相关(R2 = 0.55,P ≤ 0.0001)。热痛超敏度代表同侧爪子(接种肿瘤)与对侧爪子的退缩潜伏期比值。 b, 将异位 B16F10-mCherry-OVA (5 × 105 cells,i.d. )接种到八周大的雄性和雌性小鼠的侧腹,这些小鼠的感觉神经元完好无损(Trpv1WT::DTAfl/WT)或被消融(Trpv1cre::DTAfl/WT)。c-f, 接种肿瘤 16 天后,感觉神经元消减的小鼠肿瘤生长减少(c),IFNγ+ CD8+ T 细胞的肿瘤浸润增加(d),PD-1+LAG3+TIM3+ CD8+ T 细胞的比例减少(e)。B16F10-mCherry-OVA(5 × 105 cells,i.d.)肿瘤体积的减少在全身性耗竭 CD8+ T 细胞的神经感受器缺失小鼠中不存在(f;评估至第 14 天;抗 CD8,每只小鼠 200 μg,i.p.,每 3 天一次)。g,h, 为了化学性地耗竭它们的神经感受器神经元,Rag1-/- 小鼠被注射了 RTX (Resiniferatoxin (R-400))。28 天后,给小鼠接种 B16F10-mCherry-OVA (5 × 105 个细胞,i.d.)。与药物暴露的 Rag1-/ 小鼠相比,RTX 注射的小鼠经收养转入天真 OVA 特异性 CD8+ T 细胞(静脉注射,1 × 106 个细胞,当肿瘤达到约 500 mm3 时)后,肿瘤生长(g;评估至第 19 天)和衰竭(h)均有所减少。数据显示为线性回归分析 ± s.e.(a)、Mantel-Cox 回归(b)、平均值 ± s.e.m.(c,f,g)或箱辐图(如图 1b,c 所定义),并给出了单个数据点(d,e,h)。n 如下:a:n = 60;b:完好(n = 62),消融(n = 73);c:完好(n = 20),消融(n = 25);d:完好(n = 24),消融(n = 23);e:完整(n = 23),消融(n = 26);f:完整 + 抗 CD8(n = 10),消融 + 抗 CD8(n = 8);g:载体(n = 12),RTX(n = 10);h:载体(n = 11),RTX(n = 10)。实验独立重复两次(a,f-h)或六次(b-e),结果相似。P 值通过简单线性回归分析(a)、Mantel-Cox 回归分析(b)、双向方差分析及事后 Bonferroni 检验(c,f,g)或双侧非配对学生 t 检验(d,e,h)确定。图片和图例来自 Balood, M. et al. (2022) Nature, 611(7935), 405-412.
为了解决早期消融神经元亚群可能导致的代偿性变化,研究人员使用肉毒杆菌神经毒素A(BoNT/A)对神经元进行了沉默处理。BoNT/A能有效减少肿瘤生长,同时不影响肿瘤细胞和CD8+ T细胞的功能。然而,其疗效似乎取决于痛觉神经元的存在。我们采用了另一种方法,对已知的痛觉感受器选择性策略的沉默效果进行了研究。QX-314 被用来阻断大孔离子通道,从而产生持久的电阻断。值得注意的是,QX-314 不仅能减少黑色素瘤的生长,还能保持瘤内 CD8+ T 细胞的完整性和功能性,从而加强了其在癌症领域的潜在治疗作用。
更广阔的视野和对癌症治疗的影响
本文所述研究探讨了黑色素瘤中痛觉神经元的存在如何增加 CGRP 的产生,进而影响肿瘤附近 CD8+ T 细胞的能力。CGRP 水平的升高与 CD8+ T 细胞中免疫检查点受体的高表达相关,从而导致它们对抗肿瘤的能力减弱。
这种神经和免疫系统的交会对黑色素瘤研究和癌症治疗具有深远的影响。深入了解 CGRP 在降低 CD8+ T 细胞抗癌能力方面的作用至关重要。我们现在知道,当痛觉感受器神经元的活动受到抑制时,CD8+ T 细胞的功能仍能保持,这突出表明了 CGRP 在 T 细胞衰竭中的重要作用。此外,RAMP1拮抗剂BIBN4096在减少肿瘤生长和CD8+ T细胞衰竭频率方面表现良好,这表明该药物有可能针对有利于肿瘤进展的神经-免疫相互作用。
这项研究的一些数据表明,黑色素瘤研究和癌症治疗有可能取得突破。作者推测,通过干扰CGRP-RAMP1轴,有可能使CD8+ T细胞重新焕发活力,增强机体对抗黑色素瘤等癌症的先天能力。这不仅为开发针对CGRP-RAMP1轴的药物打开了大门,也为那些对目前的免疫疗法(如免疫检查点抑制剂)产生抗药性的患者带来了希望。通过解决助长癌症环境的神经-免疫联系,可以设想出新的治疗策略,协同神经和免疫系统的力量对抗恶性肿瘤。
黑色素瘤细胞与引发疼痛的神经元之间的这种交织有助于我们理解疼痛的进展。虽然疼痛与癌症的交会乍看之下可能有悖常理或不太可能,但了解其动态变化很可能会为黑色素瘤研究领域提供新的治疗策略。
部分相关推荐试剂
一、抗体
1、Anti-TRPV1 (VR1) Antibody (#ACC-030)
2、Anti-Rat TRPV1 (VR1) (extracellular) Antibody (#ACC-029)该抗体可识别不同的表位,因此也可用作检测 TRPV1通道蛋白的对照。该抗体只能用于大鼠样本。
3、Guinea pig Anti-TRPV1 (VR1) Antibody (#ACC-030-GP)该抗体在豚鼠中培养,可与我们的任何兔抗体一起用于多重染色研究。该抗体与 #ACC-030 的表位相同。
4、Anti-Rat-TRPV1 (VR1) (extracellular)-ATTO Fluor-488 Antibody (#ACC-029-AG)荧光标记的一抗,可与我们的任何兔抗体一起用于多重染色研究。该抗体只能用于大鼠样本。
5、Anti-Human TRPV1 (extracellular)-FITC Antibody (#ACC-334-F)这种 FITC 连接的抗体可用于在活细胞流式细胞仪中检测TRPV1通道蛋白。
6、Anti-Human TRPV1 (extracellular)-APC Antibody (#ACC-334-APC)这种 APC 结合物抗体可用于在活细胞流式细胞仪中检测TRPV1通道蛋白。
二、激活剂和阻断剂
1、Resiniferatoxin (#R-400).
用途:TRPV1 通道蛋白的强效选择性激活剂
2、5′-Iodoresiniferatoxin (#I-800)
用途:TRPV1 通道蛋白的强效阻断剂
3、A 784168 (#A-345)
用途:TRPV1 通道蛋白的强效阻断剂
4、6′-Iodoresiniferatoxin (#I-805)
用途:TRPV1通道蛋白激活剂
5、Capsaicin(#C-125)
用途:TRPV1 通道蛋白的强效激活剂
TRPV1通道蛋白研究试剂盒
| 靶点 | 货号 | 产品名 | 内容物 |
| TRPV1 | EK-115 | TRPV1 Channel Activator Explorer Kit | 8支激活剂 |
| TRPV1 | AK-211 | TRPV Channel Antibody Explorer Kit | 13支抗体,13支封闭多肽 |
| TRPV1 | ESB-300 | TRPV1 Channel Basic Research Pack | 2支抗体,2支封闭多肽,1支激活剂,2支阻断剂 |
| TRPV1 | ESP-300 | TRPV1 Channel Premium Research Pack | 3支抗体,3支封闭多肽,1支激活剂,2支阻断剂 |
| TRPV1 | ESD-300 | TRPV1 Channel Deluxe Research Pack | 4支抗体,4支封闭多肽,1支激活剂,2支阻断剂 |
关于Alomone
Alomone是来自以色列的离子通道专家,提供与离子通道和膜蛋白(TRP通道、钠/钾/钙通道、水通道、GPCRs)相关的抗体、拮抗剂/激动剂(小分子化合物和毒素)、神经生长因子等。
优宁维作为Alomone在中国区的独家授权代理商,建立了中国现货库,为广大客户带去更快的物流,更好的服务。
【1】Balood M, Ahmadi M, Eichwald T, et al. Nociceptor neurons affect cancer immunosurveillance[J]. Nature, 2022.
【2】Zahalka A H, Frenette P S. Nerves in cancer[J]. Nat Rev Cancer, 2020, 20(3): 143-157.
【3】Magnon C, Hall SJ, Lin J, et al.Autonomic nerve development contributes to prostate cancer progression.Science. 2013 Jul 12;341(6142):1236361.
【4】Balood M, Ahmadi M, Eichwald T, et al. Nociceptor neurons affect cancer immunosurveillance. Nature. 2022;611(7935):405-412







