
靶向CD123的三功能NKp46-CD16a-NK细胞衔接器控制急性髓系白血病
背景部分介绍:
急性髓系白血病(AML)是成人中最常见的急性白血病,其特点是骨髓(BM)和外周血中髓系前体的克隆扩增。AML的医疗需求明显未得到满足,高达50%的患者在初始化疗后复发,老年患者的预后仍然很差。
一些靶向免疫疗法,如单克隆抗体、双特异性T (TCE)和杀伤细胞接合分子,以及嵌合抗原受体(CAR-T)细胞,目前正在临床评估中。它们靶向AML原细胞上表达的各种抗原,其中CD33和CD123抗原是最常见的靶标。
CD123是IL-3受体(IL-3Rα)的α链,在AML中经常高水平表达,主要表达于白血病干细胞或祖细胞,与预后不良相关。在一些临床试验中,靶向CD123的细胞毒抗体显示出有限的抗白血病活性,即使是经过特异性设计以增加抗体依赖性细胞毒性(ADCC)。相比之下,TCE分子和CAR-T细胞具有一定的临床疗效,但也具有高毒性,这证实了替代靶向方法的必要性。
在这种情况下,基于NK细胞的治疗可能为靶向AML细胞提供新的治疗视角和更安全的替代方案,没有T细胞治疗常见的并发症,如细胞因子释放综合征或神经毒性。由于NK细胞的完全激活需要不同激活受体的协同作用,作者开发了一种基于抗体的NK细胞接合器(NKCE)技术,用于生成针对癌细胞上表达的抗原的三功能分子(NKp46-CD16a-NKCEs),并在NK细胞上协同NKp46和CD16a,如下图。NKp46 (NCR1, CD335)是一种在哺乳动物中高度保守的活化细胞表面糖蛋白。NKp46在所有NK细胞、ILC1和非常小的T细胞和ILC3亚群上表达。NKp46信号通过与CD3ζ和FcRγ的关联介导NK细胞活化、细胞毒性和细胞因子释放。

主要结果部分:
●在AML细胞上表达的CD64抑制抗CD123抗体的ADCC活性,由于CD64可与抗体Fc片段发生互作
●CD123-NKCE对AML细胞具有较强的细胞毒活性
●在体内CD123-NKCE控制AML肿瘤生长
●与CD123-TCE相比,CD123-NKCE介导人外周血单核细胞的药效学效应,细胞因子释放可以忽略不计
结果具体介绍:
1.首先验证了在AML细胞上表达的CD64抑制抗CD123抗体的ADCC活性

作者对来自7组样本的AML原代细胞进行抗CD123的抗体处理,发现抗cd123抗体(CD123-IgG1+)介导了来自患者(前3组)约一半样本的原细胞的杀伤,但对来自另一部分(后4组)样本的细胞几乎没有活性a。因此将样本分为两组:CD123-IgG1+应答者和CD123-IgG1+无应答者。同时也说明这两组之间的差异不能简单地用CD123表达的差异来解释。流式实验发现两组之间的一个显著差异是,在CD123-IgG1+应答者的AML母细胞中不存在FcγR表达,而在CD123-IgG1+无应答者的细胞中存在FcγR表达,后者的细胞表达CD32和/或CD64 b。进一步的实验及分析发现CD64在ADCC耐药中起主导作用,因为CD123-IgG1+杀伤活性只有在缺乏CD64表达的情况下才能恢复。这些结果支持了一种假设,即高亲和力FcγR CD64在靶细胞表面顺式捕获抗体Fc可能与NK细胞上与CD16a的反式结合竞争,从而干扰了ADCC c。
2. CD123-NKCE对AML细胞具有较强的细胞毒活性
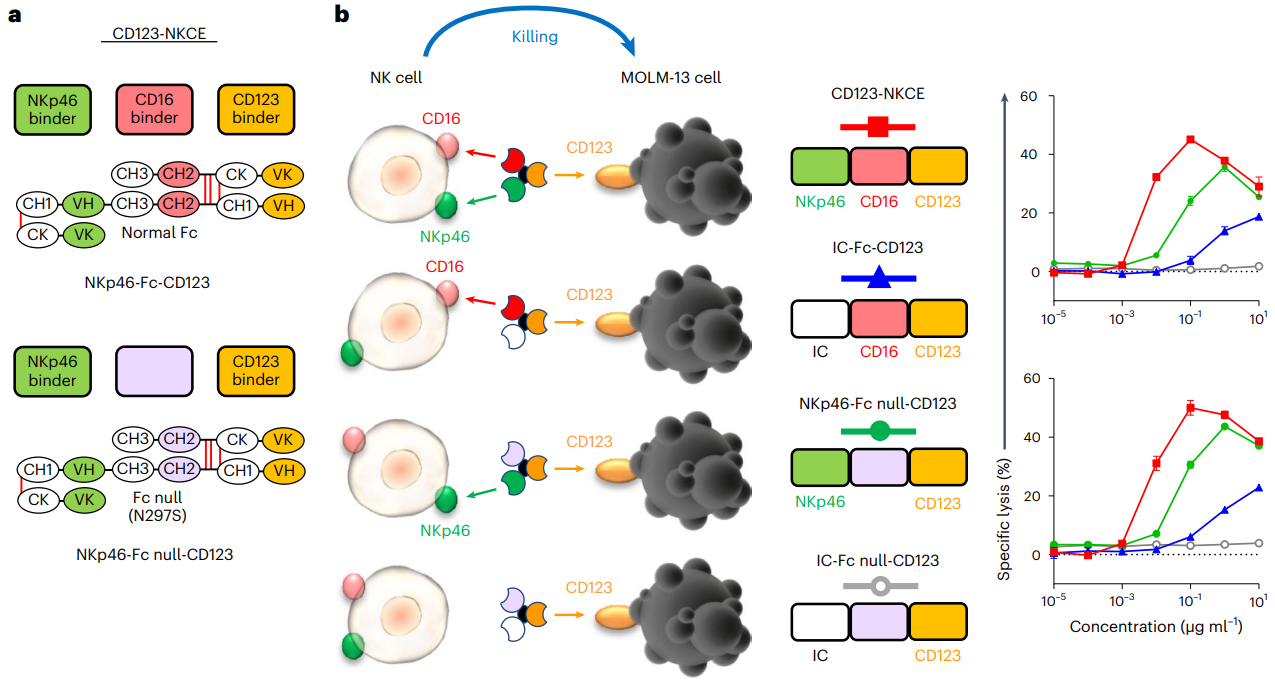
与细胞毒性抗体不同,NKCE分子参与NKp46可以以不依赖CD16a的方式促进NK细胞的细胞毒性。作者探索了NKCE分子是否仅结合NKp46或同时结合NKp46和CD16a,可以诱导NK细胞介导的杀伤表达CD64的AML靶细胞。在AML细胞上生成靶向CD123的NK细胞接合分子,接合NKp46 (NKp46- fc null-CD123),或接合NKp46和CD16a (NKp46- fc -CD123: CD123- NKCE) a, b。正如已经描述的其他靶抗原和癌症一样,靶向CD123的双功能NKp46-NKCE在体外对MOLM-13 AML细胞系具有很强的抗肿瘤作用b。随后验证了CD123-NKCE对NK细胞具有较强的活化作用,且无脱靶效应。
3. CD123-NKCE调控AML肿瘤在体内的生长

接下来,作者评估了三功能CD123-NKCE在静脉注射MOLM-13肿瘤细胞诱导的异种弥散性AML肿瘤模型中的体内疗效a。在第一天时进行肿瘤异种移植,一天后分别进行vehicle, CD123-IgG1+, CD123-NKCE处理,发现CD123-NKCE小组显著提升了小鼠存活率b。通过抗asialogm1抗体处理小鼠NK细胞(anti-asialoGM1抗体可使NK细胞耗竭),在该模型中完全消除了CD123-NKCE的功效,证实了NK细胞在体内三功能NKCE分子的抗肿瘤活性中的主要作用c, d。
4. 与CD123-TCE相比,CD123-NKCE的优势

强细胞毒性可能与患者的毒性有关。因此,作者在体外测量了CD123-NKCE诱导的人外周血单个核细胞(PBMCs)的细胞因子释放,并将结果与靶向相同抗原的CD3 T细胞接合抗体工具(CD123-TCE)的结果进行了比较。健康供者在CD123-NKCE或CD123-TCE存在下培养PBMC约20 h,然后对IL-6、IL-1β、TNF-α和IFN-γ的分泌进行定量,发现CD123-NKCE诱导的细胞因子释放水平比CD123-TCE低得多a。另CD123在循环嗜碱性细胞和浆细胞样树突状细胞(pDC)的一个亚群上表达,鉴于人PBMC中pDCs的丰度较低,将重点放在嗜碱性细胞上,并通过流式细胞术在同一实验中监测该细胞的消耗,CD123-NKCE治疗PBMC促进了CD123+嗜碱性粒细胞的剂量依赖性耗竭b。CD123-NKCE对NK细胞的激活和募集与CD123+细胞耗竭的药效学效应有关,但在高达10 μg/ml剂量(68 nM)时,没有明显的促炎细胞因子释放,这表明NKCE在治疗AML方面比TCE具有更好的效果c。
总之,作者在此报告了一种新的基于抗体的NK细胞接合技术CD123-NKCE的临床前开发,该技术将靶向于恶性细胞的CD123,并将CD16a和NKp46协同作用于NK细胞。具有不可替代的优势:
●解决了基于单抗的ADCC抑制;
●通过与NKp46结合,CD123-NKCE特异性靶向NK细胞并增强NK细胞活性;
●相较于TCE不会引起明显的促炎因子释放具有更好的安全性。
部分产品推荐:
| Antibody Name | Catalog # |
| APC-Cy7 Mouse Anti-Human CD16(3G8) | 561726 |
| Hu CD32 PE FLI8.26 100Tst | 550586 |
| Hu IL-3RALP (CD123) PE 6H6 25Tst | 566920 |
| Hu IL-3RALP (CD123) APC 6H6 25Tst | 567276 |
| Hu CD69 APC-Cy7 FN50 100Tst | 557756 |
| Hu CD45 APC HI30 500Tst | 561864 |
| Hu CD33 APC WM53 25Tst | 561817 |
| BV510 Mouse Anti-Human CD3(HIT3a) | 564713 |
| PE-Cy5 Mouse Anti-Human CD56 (NCAM-1)(B159) | 561904 |
| CD107a APC | 641581-BDIS |
| CD107b-APC-Vio770, human 30 tests | 130-103-898 |
| BUV395 Mouse Anti-Human TNF(MAb11) | 563996 |
| Anti-IgE-VioBlue, human, REA1049, 100 t | 130-117-931 |
| BV510 Mouse Anti-NHP CD45(D058-1283) | 563530 |
| CD14-FITC, human 100 tests | 130-110-518 |
| PE Mouse Anti-Human CD123(7G3) | 554529 |
| CD33-PE-Vio770, human, AC104.3E3, 100 t | 130-113-350 |
| Anti-IgE-APC, human, REA1049, 100 tests | 130-117-930 |
| Anti-TCRa/b-APC-Vio770, h, REA652, 100 t | 130-113-536 |










 危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)
危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)  营业执照(三证合一)
营业执照(三证合一)