作为国自然热点的宠儿,线粒体近几年的中标数量逐渐攀升,除了为细胞供能外,线粒体还参与细胞分化、信息传递、细胞死亡等生理过程。比如:线粒体的功能失调与神经变性、代谢性疾病、心力衰竭、缺血再灌注损伤等众多疾病息息相关;线粒体可以通过细胞凋亡、细胞焦亡、细胞坏死等多种机制控制细胞死亡……基于这些已知,科研工作者们看到了更多线粒体的未知,不断地延伸线粒体的研究方向,与其他的国自然热点(如巨噬细胞、铁死亡、自噬)相结合,真是又强又卷!小优今天给大家带来两篇高分文章的解读,让我们一起看看大佬们都是怎么玩转国自然热点的?(温馨提示:文章篇幅较长,大约需要花15分钟阅读,由于干货较多,小伙伴们也可以收藏保存)
标题:Inflammatory macrophages reprogram to immunosuppression by reducing mitochondrial translation
炎症巨噬细胞通过减少线粒体翻译,重编程为免疫抑制状态
期刊Nature communications(IF16.6)
发表时间:2023年11月17日
文章概述:
该文章探讨了炎症巨噬细胞通过降低线粒体翻译活动实现向免疫抑制状态转化的过程,并揭示了二甲双胍在此过程中的作用机理。研究发现,二甲双胍的抗炎和抗氧化作用依赖于巨噬细胞中可塑性因子ZEB1的表达。在动物模型和人体样本研究中,ZEB1在启动和解决炎症的过程中起着双重作用,它通过诱导巨噬细胞转化为免疫抑制状态来发挥这一作用。
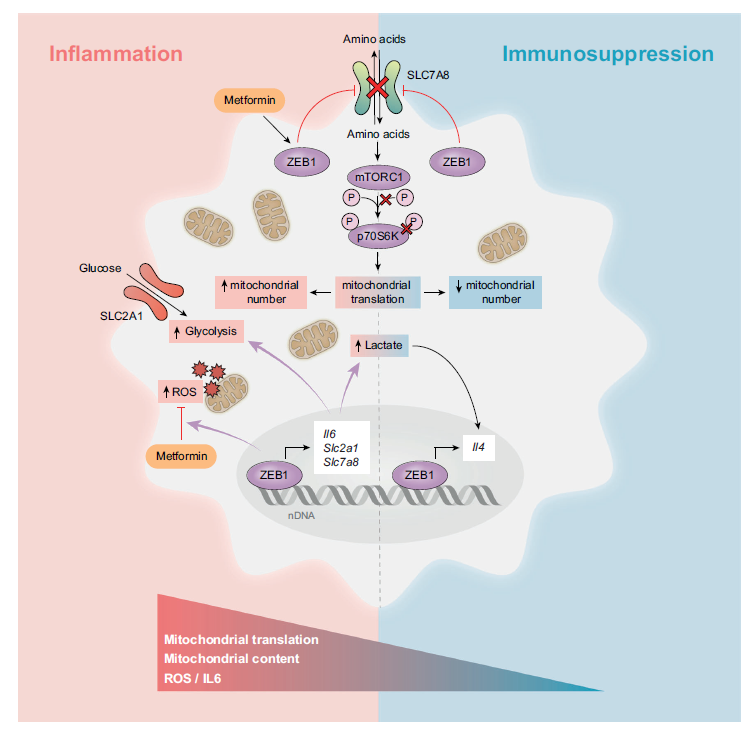
主要结果:
ZEB1在急性炎症期间增加糖酵解
转录因子ZEB1能够维持癌细胞中的细胞可塑性,增强肿瘤相关巨噬细胞的促肿瘤作用,并在病毒感染时诱导巨噬细胞出现干细胞样表型。在LPS条件(急性炎症)下,Zeb1ΔM小鼠的存活率更高,Zeb1ΔM巨噬细胞表达的炎症基因(如IL1a、IL-6、Nfkb1)水平低于Zeb1WT,抗炎和稳态基因(如IL4、Retnlg)的表达在两种基因型小鼠中类似;而在LPS+LPS条件(免疫抑制)下,Zeb1WT小鼠的存活率更高,Zeb1ΔM巨噬细胞表达的抗炎和稳态基因水平低于Zeb1WT,炎症基因则没什么差异(图1a-g)。这些发现表明ZEB1在炎症诱导和免疫抑制阶段发挥双重作用:在急性炎症期间上调炎症基因和在免疫抑制期间上调抗炎和稳态基因来调节巨噬细胞可塑性。
巨噬细胞从炎症转变为抗炎状态伴随着从糖酵解变为氧化磷酸化的代谢重编程。炎症期间,Zeb1WT巨噬细胞表达更高水平的糖酵解相关基因(如Slc2a1、Hk2、Hk3、Pdk3)(图1h-j)。然而,在免疫抑制状态下,两种基因型的小鼠与较低糖酵解相关的基因(如Gapdh、Pkm、Pgam1、Ldha)均上调(图1h)。
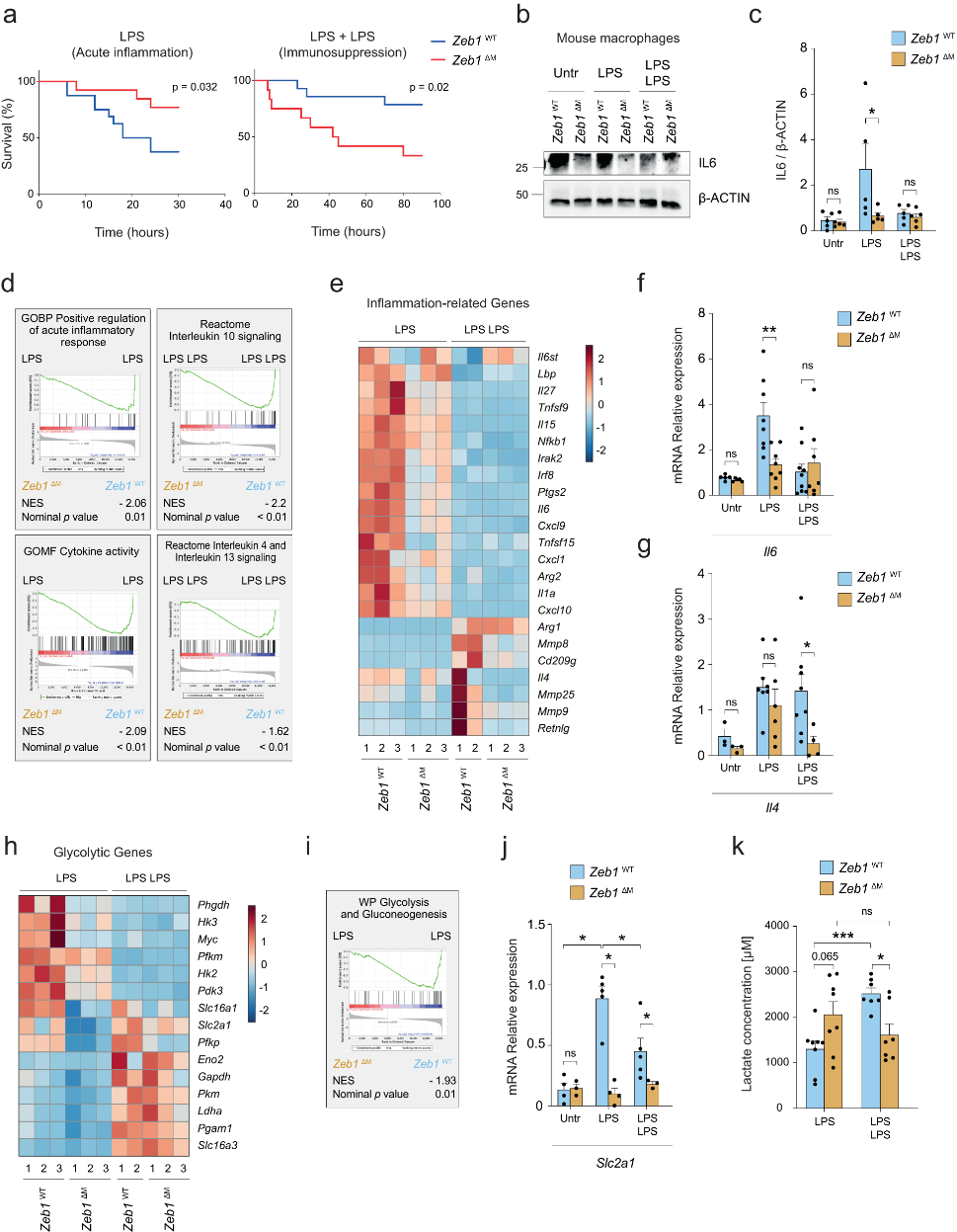 图1 ZEB1具有诱导和消退炎症的双重作用
图1 ZEB1具有诱导和消退炎症的双重作用
部分相关产品:
| 产品名称 | 货号 |
| 脂多糖 | abs42020800-10mg |
| IL-6 (D5W4V) XP ® Rabbit mAb | 12912S |
| β-actin Rabbit mAb (SDT-R015) | S0B0005-100μl |
ZEB1在免疫抑制期间减少线粒体含量,在炎症过程中激活p62并促进自噬
急性炎症时,白细胞中线粒体DNA(mtDNA)编码基因的表达与脓毒症的严重程度相关。在72h脓毒症患者免疫抑制的PBMC中也发现了线粒体含量的减少(图2b–d)。另外,免疫抑制状态下的Zeb1WT巨噬细胞线粒体含量比对照组或者炎症期间更低(图2a)。接着作者研究线粒体含量的改变是否会导致小鼠体内免疫抑制。透射电子显微镜(TEM)分析发现,与Zeb1WT小鼠的巨噬细胞相比,炎症状态下的Zeb1ΔM巨噬细胞含有更少的线粒体。然而,当处于免疫抑制状态时,Zeb1ΔM小鼠的巨噬细胞线粒体比Zeb1WT小鼠多(图2e、f)。这些结果表明ZEB1在炎症和免疫抑制中以相反方向调节巨噬细胞中线粒体含量。
线粒体自噬也是一种重要的抗炎机制,炎症过程中受损线粒体的积累会增加ROS的产生并激活炎症小体信号传导。与Zeb1WT相比,炎症条件下的Zeb1ΔM巨噬细胞表达较低水平的自噬相关基因(如Sqstm1、Tbc1d17、Rab9、Cisd2)和较高水平的抗自噬基因(如Usp30)(图2g)。p62能够结合受损的线粒体、其他受损的细胞器以及泛素化蛋白,并将它们招募到自噬体,随后自噬体与自溶酶体融合,以mTORC1依赖性方式降解。急性炎症可上调Zeb1WT巨噬细胞中的p62 mRNA和蛋白质表达,但不影响Zeb1ΔM小鼠中p62的表达(图2h、i)。并且,炎症状态下的Zeb1WT巨噬细胞表现出更多数量的自噬溶酶体(图2J),这表明,急性炎症时,ZEB1促进自噬的发生。
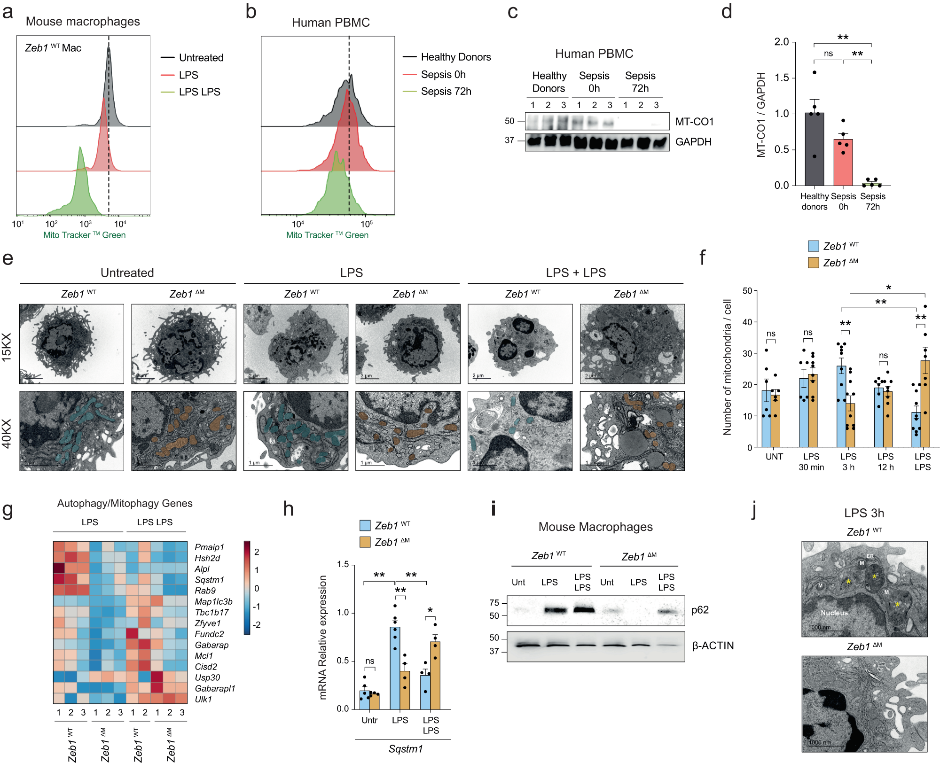 图2 ZEB1在炎症期间调节线粒体含量和自噬
图2 ZEB1在炎症期间调节线粒体含量和自噬
部分相关产品:
| 产品名称 | 货号 |
| COX1/MT-CO1 (E2I2R) Rabbit mAb | 55159S |
| GAPDH Recombinant Rabbit mAb (S-240-147) | S0B0261-100μl |
| SQSTM1/p62 (D6M5X)Rabbit mAb | 23214S |
二甲双胍的抗炎作用依赖于巨噬细胞中ZEB1的表达
神药二甲双胍以抑制线粒体功能和巨噬细胞对LPS的炎症反应而闻名。接下来,作者研究了二甲双胍对LPS炎症反应的体内外影响。与Zeb1ΔM小鼠相比,Zeb1WT小鼠对LPS的反应表现出更高水平的IL-6。二甲双胍可降低用LPS处理的巨噬细胞的耗氧率,以及Zeb1WT巨噬细胞中LPS诱导产生的炎症因子IL-6的上调,而不影响Zeb1ΔM巨噬细胞(图3a-g)。多因子检测发现,炎症条件下,Zeb1ΔM巨噬细胞表现出IL1β、IL-6、TNFα和CXCL1水平降低,二甲双胍预处理使Zeb1ΔM中这些炎症标志物的表达水平升高至和Zeb1WT差不多;相反,免疫抑制条件下,Zeb1ΔM巨噬细胞表现出较高水平的IL-6和CXCL1(图3h)。这表明二甲双胍在巨噬细胞中的抗炎作用依赖于ZEB1。RNA-seq分析发现,二甲双胍在Zeb1WT巨噬细胞中差异性地诱导“炎症反应的负调节”特征(图3i)。在Zeb1WT巨噬细胞中,二甲双胍上调下列相关基因:抗炎反应相关(如Arg1、Mrc1、Il4)、诱导耐受(如Acod1)、线粒体去极化的正向调节(如Tspo)、伤口愈合、基质金属蛋白酶活性(如Timp1、Cldn1)、活性氧代谢过程(如Sod2);而Zeb1ΔM巨噬细胞中,二甲双胍调节的基因与SSU-rRNA的成熟特征(如Wdr3)相关(图3j)。这些结果表明,二甲双胍的抗炎作用依赖于ZEB1,并且部分是由于线粒体功能的调节。
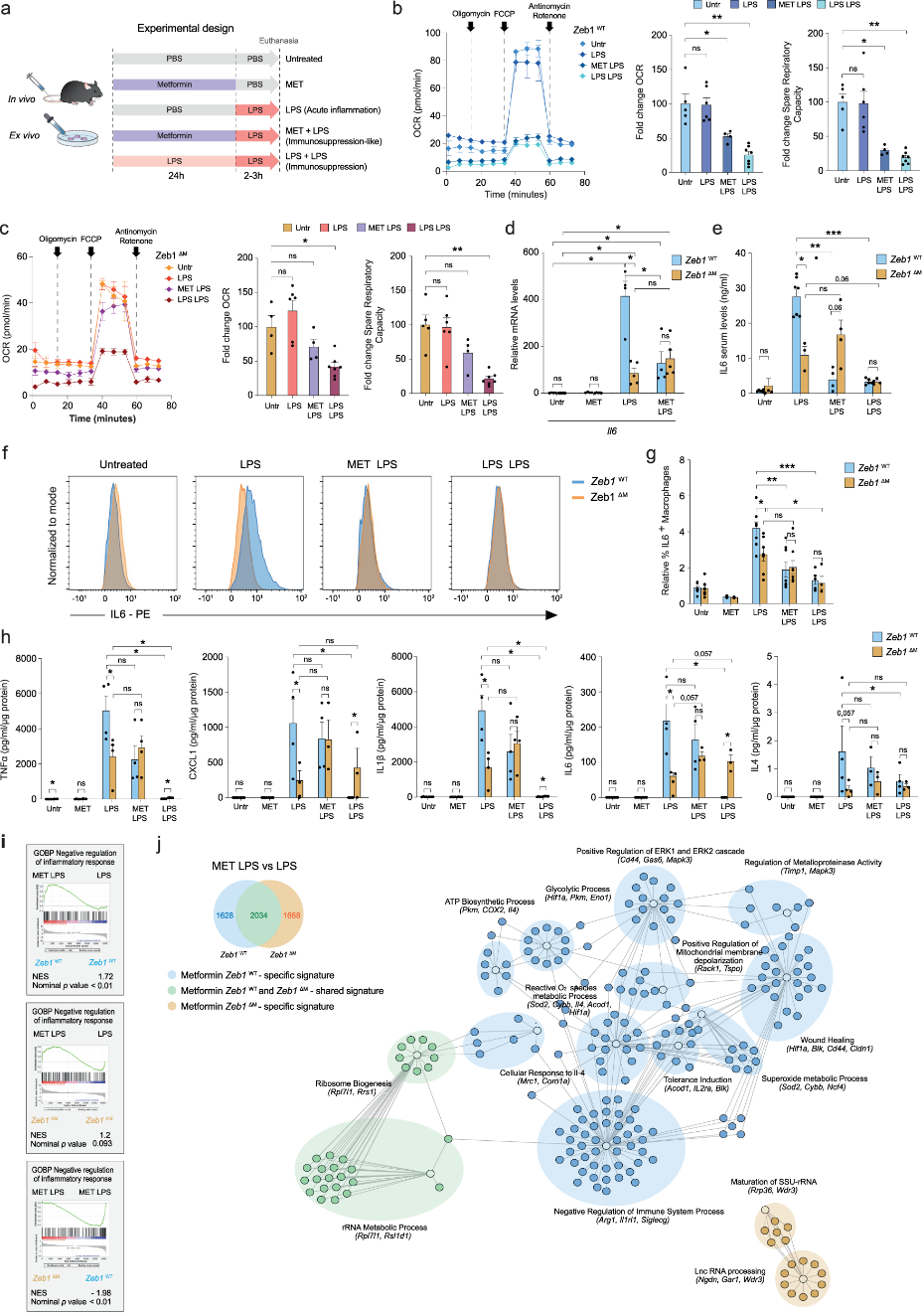 图3 二甲双胍的抗炎作用依赖于巨噬细胞中ZEB1的表达
图3 二甲双胍的抗炎作用依赖于巨噬细胞中ZEB1的表达
部分相关产品:
| 产品名称 | 货号 |
| 盐酸二甲双胍 | abs47035304-5mg |
| 小鼠炎症10因子Panel | LXRLBM10-1 |
ZEB1通过降低线粒体含量和ROS水平介导二甲双胍的免疫抑制作用
与图4a所示的转录组分析一致,在LPS中,二甲双胍或首次亚致死剂量的LPS预处理导致Zeb1WT巨噬细胞中ROS产生、线粒体含量和ΔΨm减少(图4b-d)。同样,脓毒症患者的CD14+PBMCs在72h后的MTG和TMRM线粒体染色也有所减少(图4e)。
二甲双胍预处理导致炎症状态下人巨噬细胞中磷酸化p65(p-p65)和MT-CO1蛋白表达降低至与免疫抑制状态相当的水平(图4f,g)。RNA-seq数据表明,与Zeb1WT巨噬细胞相比,急性炎症时Zeb1ΔM巨噬细胞具有更高的与“线粒体翻译正调节”相关的特征表达(图4h)。急性炎症或免疫抑制下的Zeb1ΔM巨噬细胞中线粒体蛋白质合成翻译更高(图4i)。这表明,ZEB1通过影响线粒体翻译来调节急性炎症和免疫抑制期间的巨噬细胞反应。多西环素对炎症巨噬细胞中ROS产生和IL-6表达的抑制也依赖于ZEB1表达(图4j、k)。
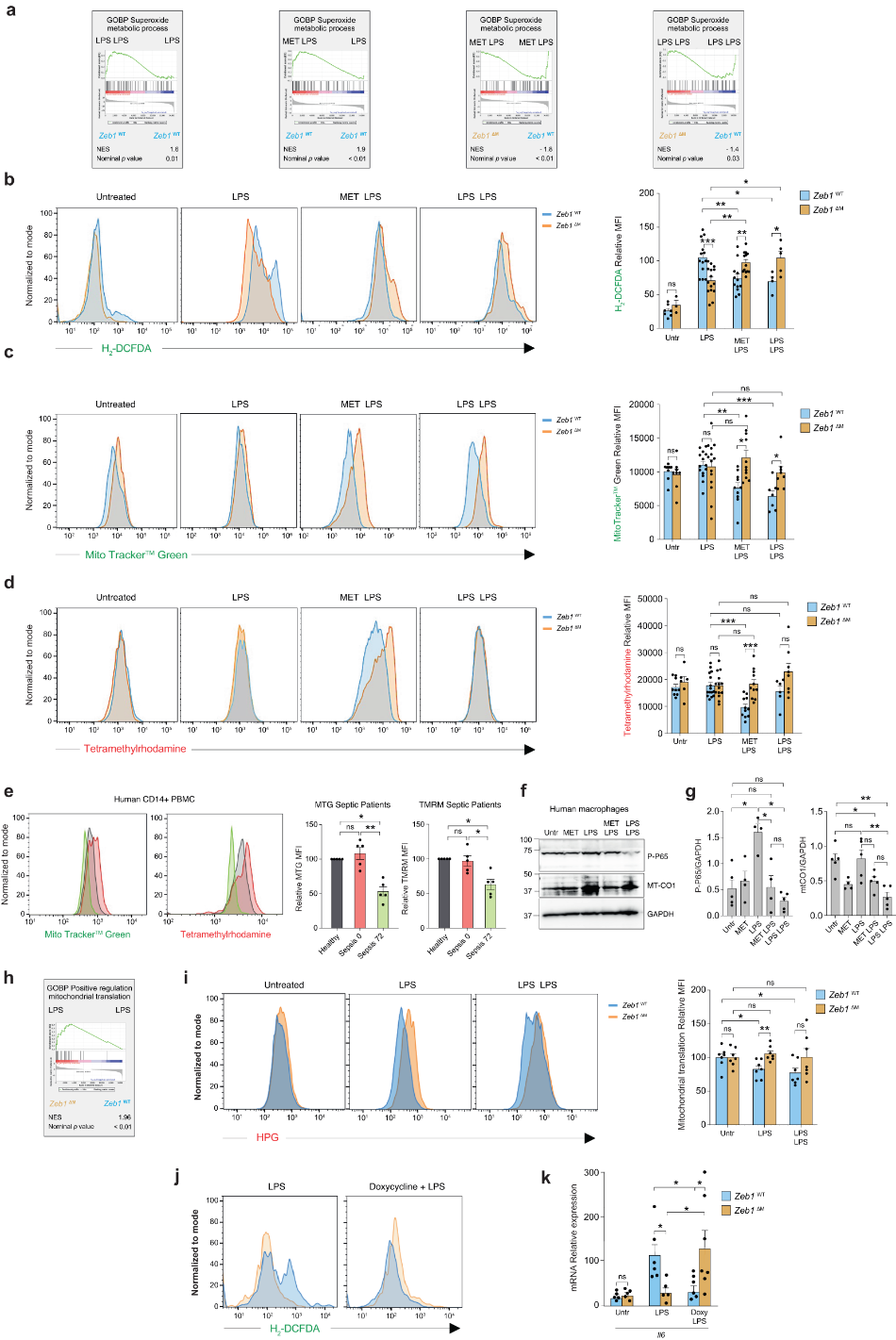 图4 ZEB1通过降低线粒体含量和ROS水平来介导二甲双胍的免疫抑制作用
图4 ZEB1通过降低线粒体含量和ROS水平来介导二甲双胍的免疫抑制作用
部分相关产品:
| 产品名称 | 货号 |
| H2-DCFDA 100mg | AS-85706 |
| Mito Flipper-TR Kit | CY-SC023 |
| Phalloidin-Tetramethylrhodamine Conjugate | abs42235798-300T |
| Phospho-NF-kappaB p65 (Ser468) Antibody | 3039S |
二甲双胍在银屑病中的抗炎作用依赖于巨噬细胞中的ZEB1表达
使用乳酸或者多西环素治疗咪喹莫特诱导的小鼠银屑病模型,Zeb1WT小鼠的耳朵和表皮增厚减少,并增加巨噬细胞产生的乳酸。并且,多西环素增加ZEB1表达,同时降低MT-CO1蛋白水平,而乳酸则具有相反的作用(图5a-e)。
接下来,作者研究了二甲双胍在银屑病中的抗炎作用是否也依赖于ZEB1。与Zeb1WT小鼠相比,Zeb1ΔM银屑病模型小鼠耳部出现更大的红斑和表皮增厚(图5f,g)。二甲双胍预处理可减少Zeb1WT小鼠的皮肤病变、组织学棘皮症和巨噬细胞浸润,而对Zeb1ΔM小鼠则没有影响(图5f-h)。这些发现进一步支持二甲双胍的抗炎作用依赖于巨噬细胞中ZEB1的表达。ZEB1存在于健康皮肤的分散细胞中,但在银屑病皮损中几乎不存在;ZEB1在银屑病关节炎(PsA)患者滑膜的CD68+巨噬细胞中也有表达,但在骨关节炎患者的滑膜中几乎没有表达(图5i)。并且,与健康供体相比,PsA患者的PBMC表现出更高的线粒体含量和ROS产生(图5j、k)。总之,巨噬细胞中的ZEB1表达是限制急性和慢性炎症以及二甲双胍在两种炎症中发挥抗炎作用所必需的。
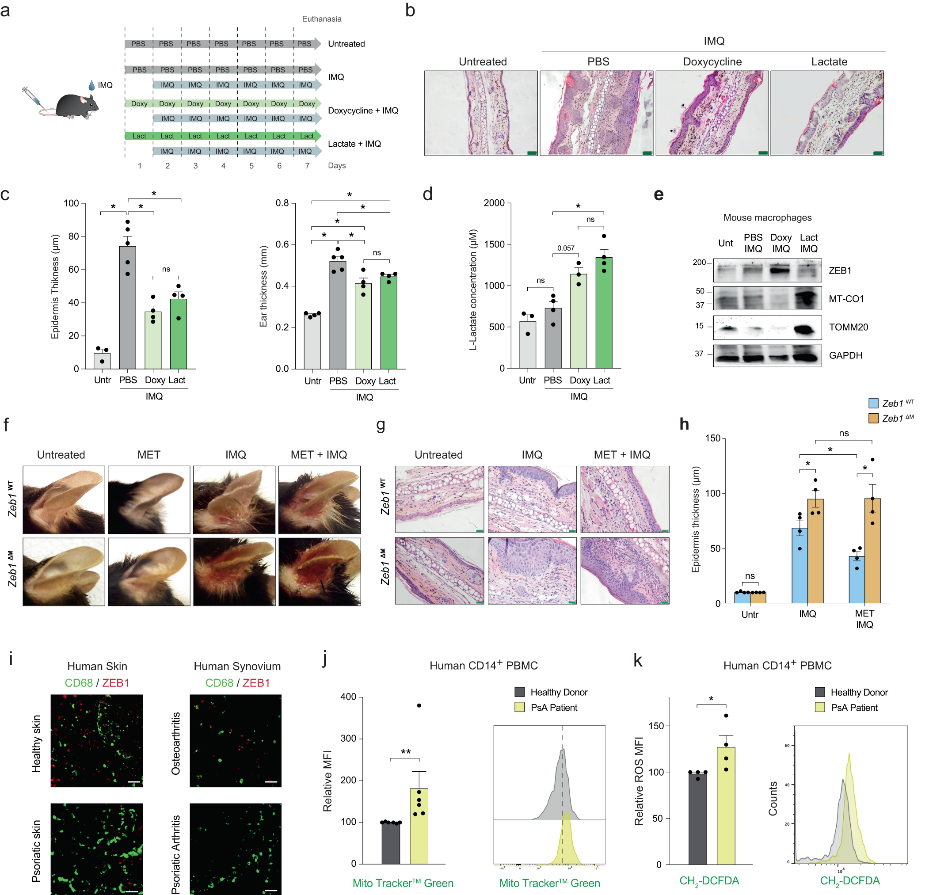 图5二甲双胍在银屑病皮损中的抗炎作用依赖于巨噬细胞中ZEB1的表达
图5二甲双胍在银屑病皮损中的抗炎作用依赖于巨噬细胞中ZEB1的表达
部分相关产品:
| 产品名称 | 货号 |
| ZEB1(E2G6Y) XP ® Rabbit mAb | 70512S |
| Rabbit anti-TOMM20 Polyclonal Antibody | abs159003-100ul |
| CD68(D4B9C)XP ® Rabbit mAb | 76437S |
脓毒症和银屑病关节炎患者炎症性PBMC中的ZEB1表达与葡萄糖和氨基酸转运蛋白的差异表达相关
细胞质和线粒体蛋白质翻译以及自噬均受到mTOR调节,而氨基酸的摄取和代谢可以激活mTOR。RNA-seq分析表明,二甲双胍预处理或者免疫抑制时,Zeb1WT巨噬细胞与氨基酸转运相关的基因集富集分析(GSEA)表达下降(图6a)。L型双向氨基酸转运蛋白SLC7A8/LAT2是摄取谷氨酰胺和支链氨基酸(BCAA)所必需的,对于mTORC1信号传导的激活至关重要。与LPS处理相比,用二甲双胍+LPS和免疫抑制下的Zeb1WT巨噬细胞导致SLC7A8的mRNA和蛋白质水平降低,而在Zeb1ΔM巨噬细胞中未观察到这种效应(图6b、c)。与炎症期间SLC7A8的上调一致,Zeb1WT巨噬细胞也表现出更高的葡萄糖和谷氨酰胺消耗以及BCAA水平升高(图6d-f)。此外,LPS处理的Zeb1ΔM巨噬细胞的细胞内谷氨酸水平有所降低,但是,Zeb1ΔM和Zeb1WT巨噬细胞之间的细胞内谷氨酰胺水平没有明显差异,这表明谷氨酰胺可能在分析的时间点已经代谢为谷氨酸(图6g)。另外,在存在谷氨酰胺的情况下,二甲双胍预处理或免疫抑制可减少Zeb1WT巨噬细胞中的线粒体DNA拷贝数(MDCN)(图6h)。二甲双胍预处理或免疫抑制导致Zeb1WT巨噬细胞中P-p70S6K水平降低,而不影响Zeb1ΔM巨噬细胞(图6i)。这表明,ZEB1调节免疫抑制和介导二甲双胍抗炎作用的机制是通过减少氨基酸摄取和代谢,进而导致mTORC1下调的。
接下来,作者检查了健康对照、脓毒症患者0h和72h以及PsA患者的PBMC中ZEB1的表达是否与的脓毒症和银屑病小鼠模型中几种标志物的表达相关。在脓毒症患者中,72h的PBMC中ZEB1的表达水平高于0h。另一方面,与健康供体相比,PsA患者的PBMC中ZEB1表达较低(图6k)。与72h来自同一患者的PBMC相比,0h表现出较高的SQSTM1表达和较低的IL4表达(图6l))。相反,与健康供体相比,PsA患者的PBMC显示出较低的SQSTM1和IL4表达,但IL-6表达较高(图6l)。并且,在脓毒症患者和PsA患者之间观察到SLC2A1和SLC7A8的表达趋势相反(图6l)。
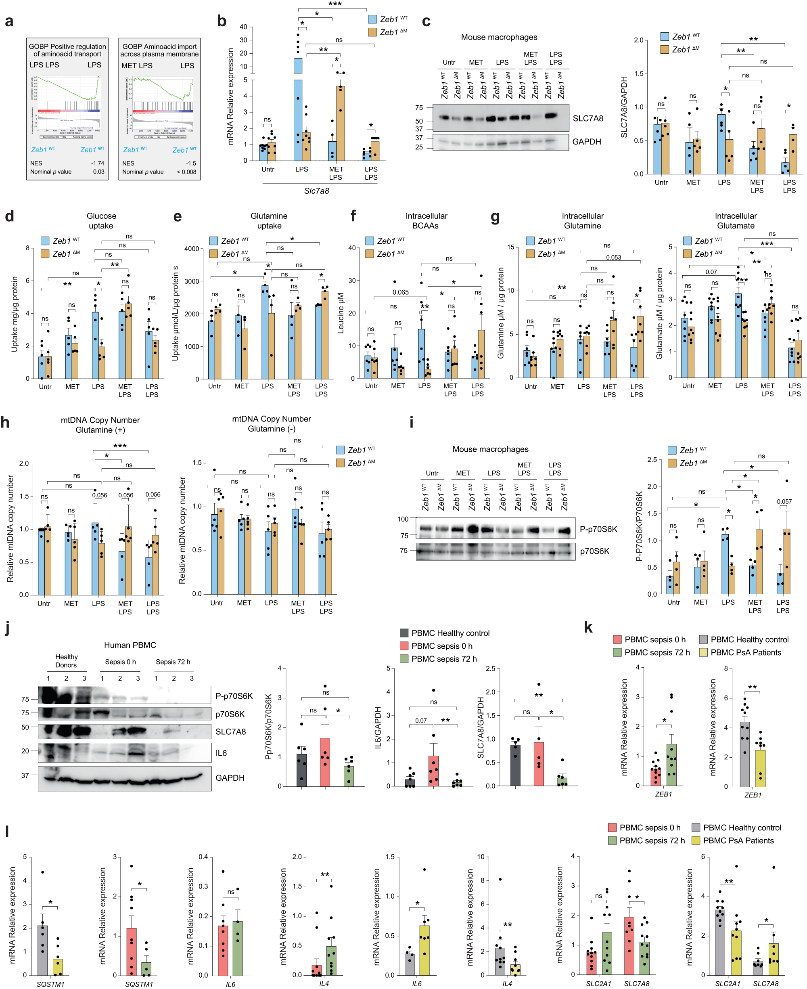 图6 ZEB1通过限制氨基酸转运来抑制线粒体蛋白质翻译
图6 ZEB1通过限制氨基酸转运来抑制线粒体蛋白质翻译
部分相关产品:
| 产品名称 | 货号 |
| Rabbit Polyclonal SLC7A8 Antibody | NBP2-49319 |
| RPS6KB1/P70S6K/S6K Antibody (clone 5G9) | LS-C759703-100 |
| Phos p70S6K MAb | MAB8965 |
标题:Mitochondria-localized cGAS suppresses ferroptosis to promote cancer progression
线粒体定位的cGAS抑制肝癌细胞铁死亡
期刊cell research(IF44.1)
发表时间:2023年3月2日
文章概述:
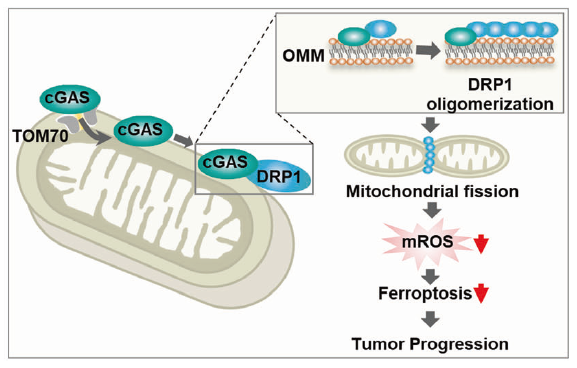
环状GMP-AMP合成酶(cGAS)锚定在线粒体外膜,与线粒体分裂调控因子DRP1(Dynamin-1-likeprotein)结合,促进其寡聚。在没有cGAS或Drp1寡聚的情况下,线粒体ROS积聚和细胞铁死亡增加,抑制肝癌的肿瘤生长。
主要结果:
cGAS定位于肿瘤细胞的线粒体
首先通过LC-MS/MS、WB以及共聚焦免疫荧光等均证明cGAS富含在Hep3B、PLC和HepG2细胞的线粒体中(图1a-b)。不仅如此,内源性cGAS同样也分布在临床肝细胞癌组织的线粒体中(图1c,d)。蛋白质序列分析及融合蛋白靶向实验证明了线粒体靶向序列(MTS)是161-190的氨基酸残基,并且是cGAS定位至线粒体必需的。为了进一步确定cGAS的线粒体亚定位,作者从Hep3B和PLC细胞中分离线粒体进行了蛋白水解酶K保护实验。结果发现线粒体cGAS对蛋白酶K消化敏感,这表明cGAS定位于线粒体外膜OMM(图1e)。TOM70是OMM上转位酶的主要前蛋白受体,co-IP证明了TOM70与cGAS存在相互作用(图1f),而抑制TOM70会导致线粒体中cGAS的富集减少(图1g),这表明TOM70参与cGAS到线粒体的移位。
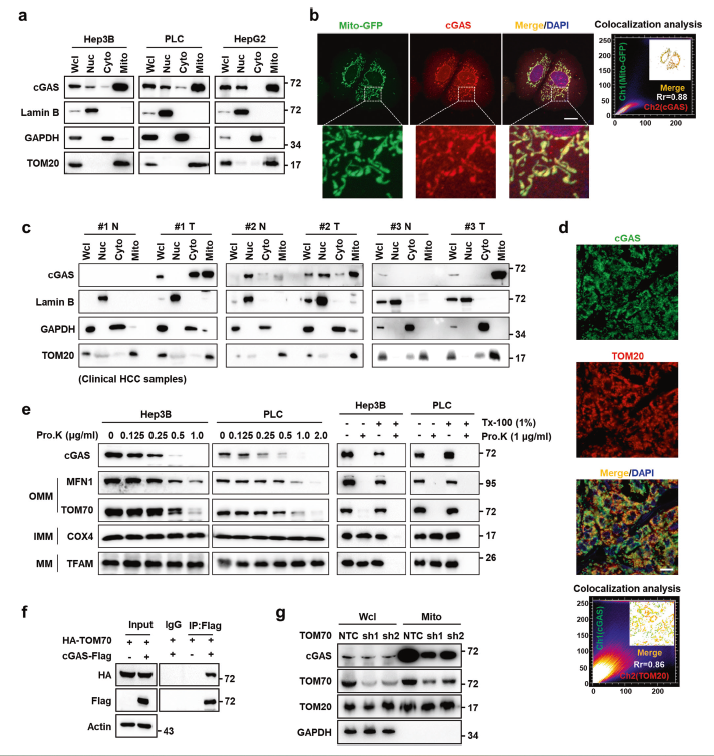 图1 cGAS定位于肿瘤细胞线粒体外膜
图1 cGAS定位于肿瘤细胞线粒体外膜
部分相关产品:
| 产品名称 | 货号 |
| TOM70 Antibody | 65675S |
| cGAS (D1D3G)Rabbit mAb | 15102S |
| Tom20 (D8T4N)Rabbit mAb | 42406S |
| DAPI染色液 | abs47047616-10ml |
线粒体cGAS抑制铁死亡
为了探索线粒体定位的cGAS在癌细胞中的可能作用,作者生成了特异性靶向cGAS的MTS-cGAS,结果表明MTS-cGAS和野生型cGAS(WT-cGAS),显著恢复了cGAS敲除导致的细胞生长受阻和死亡(图2a,b)。而铁死亡抑制剂Fer-1和Lip-1能够减轻内源性cGAS敲除和ΔMTS-cGAS导致的细胞死亡,表明cGAS抑制的是细胞的铁死亡(图2c)。此外,与铁死亡抑制剂处理结果一样,MTS-cGAS也能够减少cGAS敲除导致的细胞死亡(图2d)。MTS-cGAS和WT-cGAS也减弱了cGAS敲降导致的细胞脂质过氧化的增加(图2e,f)。并且,MTS-cGAS和WT-cGAS的表达,逆转了cGAS敲降导致的GSH/GSSG比率的下降,而不影响包括GSH和CoQ在内的铁死亡防御系统中主调节因子的蛋白质水平(图2g)。同样,MTS-cGAS也消除了用铁死亡诱导剂索拉非尼处理的细胞中由cGAS敲低引起的高水平脂质过氧化和细胞死亡(图2h,i)。总之,这些结果表明,线粒体cGAS的缺失可以通过诱导铁死亡导致HCC细胞死亡。
接下来进一步探讨线粒体cGAs预防铁死亡的机制,cGAS敲除的Hep3B细胞显示出线粒体损伤和结构紊乱,而MTS-cGAS显著恢复了cGAS敲除细胞中受损的线粒体脊结构(图2j),这表明线粒体cGAS至少部分负责维持线粒体数量。MTS-cGAS也能够减弱内源性cGAS的敲除导致Hep3B和PLC细胞中线粒体ROS的异常高积累(图2k)。同样,线粒体靶向抗氧化剂Mito-Q的治疗减弱了cGAS敲除细胞中高水平的脂质过氧化和细胞死亡(图2l)。这些结果表明,线粒体cGAS可通过抑制线粒体过量ROS的积累来抑制脂质过氧化和铁死亡。
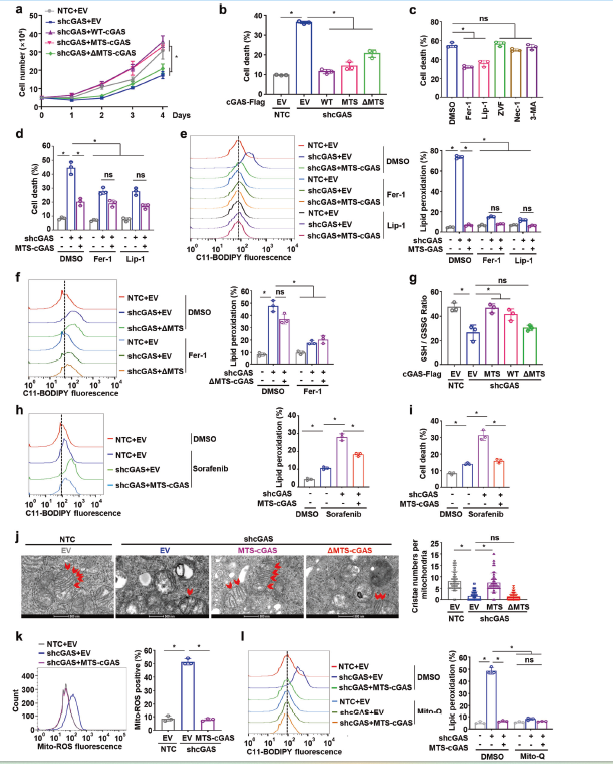 图2 线粒体定位的cGAS抑制铁死亡
图2 线粒体定位的cGAS抑制铁死亡
部分相关产品:
| 产品名称 | 货号 |
| Ferrostatin-1 | 17729-25mg |
| Liproxstatin-1 | 17730-50mg |
线粒体cGAS对铁死亡的抑制不依赖于STING的激活
接下来作者研究了cGAS-STING信号是否参与了线粒体cGAS调节的铁死亡。cGASE225A/D227A不能结合合成cGAMP所需的镁,从而激活STING依赖途径,但保持了线粒体的定位,并减弱了cGAS敲除诱导的高水平脂质过氧化(图3a,b)。同样,cGAS催化抑制剂(PF-06928215)处理不影响cGAS的线粒体定位(图3c)以及脂质过氧化水平;然而,在有或没有cGAS抑制剂的情况下,MTS-cGAS都减弱了cGAS敲除引起的脂质过氧化的增加(图3d)。这些数据表明,cGAS在线粒体中的定位和功能与其催化活性无关。
此外,作者还检测了DNA刺激条件下,HBK1的磷酸化以及cGAS-STING通路下游靶基因的mRNA水平。TBK1和IRF3的磷酸化以及下游靶基因IFNB、ISG15和IFIT1的mRNA水平都被边缘检测到(图3e,f),这表明cGAS的线粒体功能和DNA传感器功能之间存在明显的程序差异。
与单核细胞系THP-1的比较表明,STING在肝癌细胞系和正常肝细胞中的表达水平都低得多(图3g)。此外,去除肝癌细胞中的STING并不影响线粒体cGAS抑制铁死亡的功能,MTS-cGAS仍然可以消除被敲除细胞中的脂质过氧化和细胞死亡的增加,并恢复GAS敲降导致的GSH/GSSG比值的下降(图3h-k)。这些结果表明,线粒体cGAS不依赖典型的cGAS-STING途径,就可以抑制脂质过氧化和铁死亡。
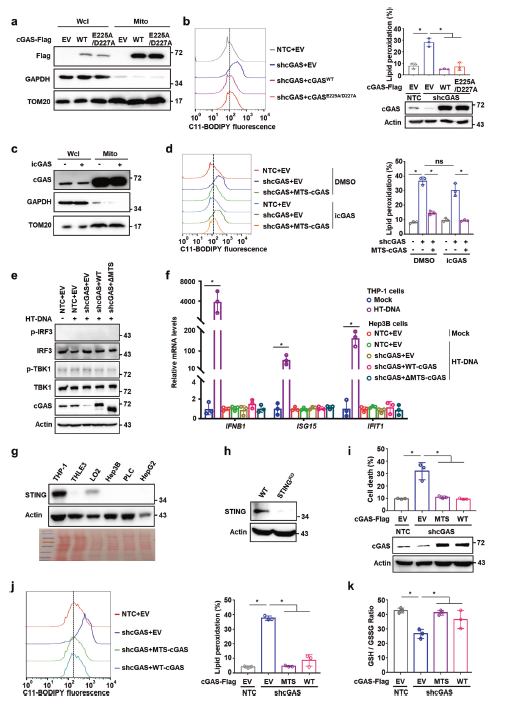 图3 线粒体定位的cGAS抑制铁死亡
图3 线粒体定位的cGAS抑制铁死亡
部分相关产品:
| 产品名称 | 货号 |
| STING (D1V5L)Rabbit mAb | 50494S |
| PF-06928215 | 32515-5mg |
线粒体cGAS与DRP1结合并促进其寡聚化
为了探索线粒体cGAS抑制铁死亡反应和ROS过度积累的可能机制,作者通过MS数据筛选了可能与线粒体中的cGAS相互作用的蛋白质。在这些候选蛋白中,重点关注了ACSL4、OPA1和DRP1这些参与铁死亡或线粒体氧化还原调控的蛋白质。Co-IP、荧光显微镜共聚焦实验以及pull-down实验均证明cGAS与DRP1有相互作用,但与ACSL4或OPA1没有相互作用(图4a-d)。并且,cGAS的NTase结构域是cGAS与DRP1相互作用所必需的(图4e)。
不仅如此,敲除cGAS会抑制DRP1的寡聚化,导致Hep3B和PLC细胞中DRP1中间寡聚化和高度寡聚化的水平降低。然而,MTS-cGAS可显著恢复DRP1的寡聚水平(图4f),这表明线粒体cGAS是DRP1寡聚化所必需的。
DRP1的活性是线粒体呼吸调节和线粒体质量监控所必需的。通过特异性抑制剂Mdivi-1抑制DRP1可消除MTS-cGAS对cGAS敲除导致的线粒体ROS积累的缓解作用。同样,在Mdivi-1存在的情况下,MTS-cGAS不能减轻cGAS敲降导致的脂质过氧化和细胞死亡水平的升高(图4g,h),这表明DRP1与线粒体cGAS在抑制铁死亡反应和线粒体ROS积累方面共同发挥作用。在过表达MTS-cGAS的Hep3B细胞中,沉默DRP1会导致线粒体ROS的积累以及脂质过氧化和细胞死亡的增加,而野生型DRP1能够消除这种情况,但是线粒体靶向或GTPase活性方面存在缺陷的DRP1A395D、DRP1K38A突变体没有这种作用(图4i,j)。综上所述,这些数据表明,线粒体cGAS抑制脂质过氧化和铁死亡反应需要与DRP1相互作用以促进其在OMM上的寡聚化。
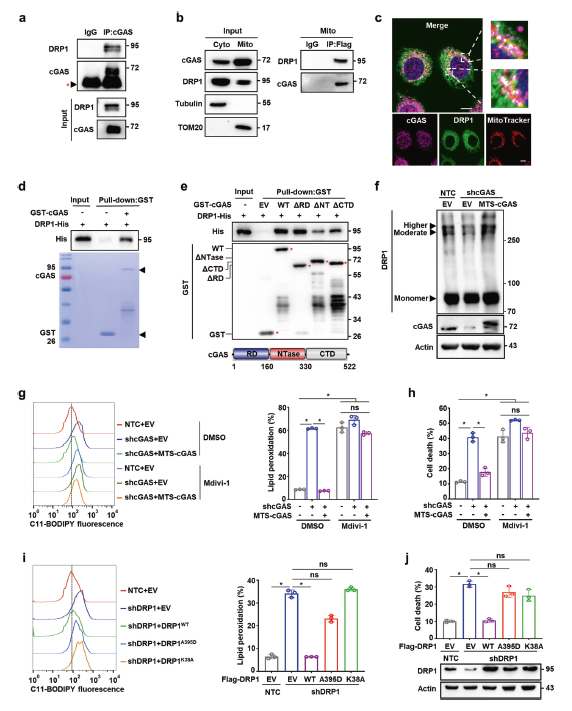 图4 线粒体cGAS与DRP1结合并促进其寡聚化
图4 线粒体cGAS与DRP1结合并促进其寡聚化
部分相关产品:
| 产品名称 | 货号 |
| DRP1 (4E11B11) Mouse mAb | 14647S |
| b-III Tubulin MAb | MAB1195 |
线粒体cGAS通过抑制体内铁死亡促进肿瘤进展
接下来,作者研究了抑制线粒体cGAS作为HCC体内进展干预措施的效果。在小鼠异种移植模型中,cGAS敲除可显著抑制Hep3B细胞的肿瘤生长,而WT-cGAS的恢复表达可缓解肿瘤生长,但ΔMTS-cGAS却不能(图5a,b)。此外,MTS-cGAS明显恢复了cGAS敲降所抑制的肿瘤生长,这表明线粒体定位的cGAS在HCC肿瘤发生中扮演重要角色(图5c,d)。用铁死亡抑制剂Lip-1处理异种移植小鼠后,cGAS敲降所抑制的肿瘤生长有所恢复,这表明铁死亡确实参与了cGAS介导的肿瘤生长(图5c,d)。此外,MTS-cGAS过表达和Lip-1处理均可显著降低肿瘤组织中的脂质过氧化,而不影响细胞增殖(图5e)。总之,这些结果表明线粒体cGAS是通过抑制体内铁死亡促进HCC肿瘤生长的主要因素。MTS-cGAS过表达同样也恢复了内源性cGAS敲除所抑制的移植肿瘤的生长,而DRP1抑制剂Mdivi-1的处理则可消除这种作用(图5f),也能够消除MTS-cGAS对异种移植肿瘤组织脂质过氧化的抑制作用(图5g)。因此,线粒体定位的cGAS通过抑制DRP1依赖性的铁死亡反应促进肿瘤发生(图5h)。
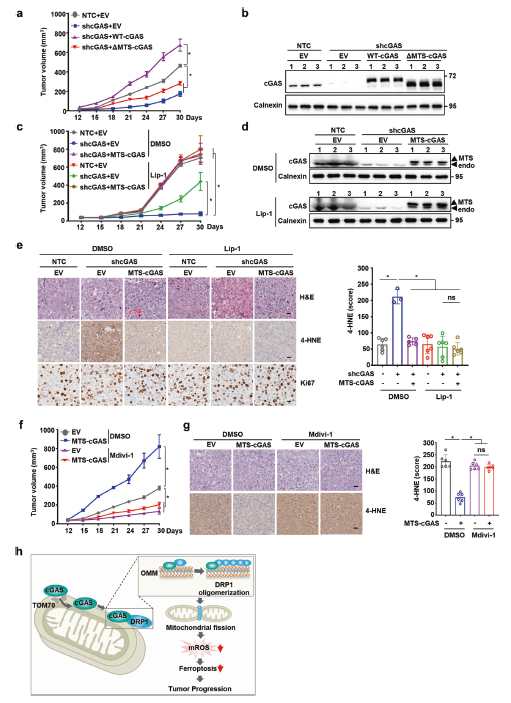 图5线粒体cGAS通过抑制体内铁死亡促进肿瘤进展
图5线粒体cGAS通过抑制体内铁死亡促进肿瘤进展
部分相关产品:
| 产品名称 | 货号 |
| Calnexin Antibody | 2433S |
| Mdivi-1 | abs810487-100mg |










 危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)
危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)  营业执照(三证合一)
营业执照(三证合一)