蛋白纯化是生物实验中的基础实验之一,随着商业蛋白产品的价格越来越高以及实验可能用到的蛋白量越来越大,或者课题想要的蛋白没有商品化的蛋白可以购买,自己纯化蛋白往往是一个高效而经济的选择。
如果你对于纯化实验还没有真正接触过,没关系,你可以按照以下的步骤开始你的实验。
PART1:对你的蛋白做一个基本的了解
在纯化实验开始之前,首先你需要对你的蛋白和纯化的目标做一个初步的了解。
例如:
1、你的蛋白纯化后准备用来做什么?
这个问题常常会被忽略,蛋白的用途决定了你的纯化目标,进而决定你的纯化路线设计。如果你对纯度要求不高,往往一步纯化就可以解决问题;如果你对纯度要求非常高,那么往往就要用到2步和3步的纯化。那我都用3步纯化行不行?当然不行!纯化次数越多你需要的时间和经济成本就越高,而且随着纯化步骤的增多,蛋白量也会有一定的损耗,所以应该选择真正适合的纯化路线,可以参考下图:

2、确定目标蛋白的性质
在纯化之前,你应该会你的目标蛋白的性质有一定的了解,例如蛋白的分子量,稳定性,可溶性,等电点等等。蛋白是不是容易降解,蛋白在缓冲液里是否可以溶解,这些问题往往会影响到你整个实验流程,所以需要多加关注。另外凝胶过滤层析需要参考蛋白的分子量;离子交换层析需要参考蛋白的等电点;疏水层析需要参考蛋白的疏水性质等。
3、确定蛋白的表达位置
并不是所有的蛋白都表达后仍停留在细胞内,在纯化蛋白时要充分考虑到蛋白的位置,才能选择到合适的样品。如果你的蛋白是胞内蛋白,那么只要把细胞裂解掉之后就可以进行纯化;如果你的蛋白是分泌蛋白,我们则需要用培养基去上样;如果你的蛋白是膜蛋白,那么你需要使用去垢剂把蛋白从细胞膜上面溶解下来。
PART2:选择一个合适的表达体系(重组蛋白)
如果你是想要短时间内拿到大量的蛋白,而不是仅仅想从植物体或者动物体中分离出某些天然蛋白进行研究,那么你应该选择先构建质粒然后在模式细胞中表达蛋白,随着模式细胞的大量快速繁殖,你可以在短时间内拿到大量的样品,例如下图是使用原核表达体系重组蛋白纯化的步骤(具体方法会在之后的软文中介绍):
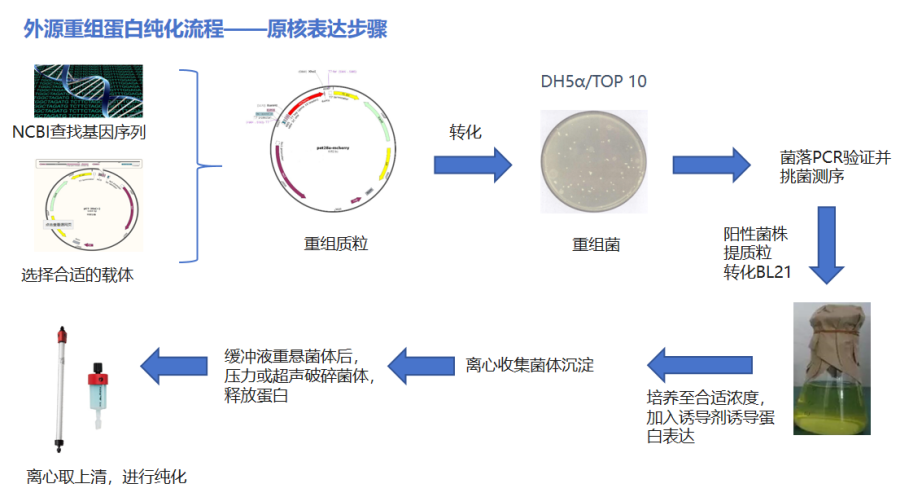
在纯化开始前,选择一个合适的表达体系非常的重要,大家可以根据自己的蛋白特点以及实验室的条件选择,如果之前没有做过纯化可以先考虑先从原核表达起步,或者查看文献看看其他前辈都用什么表达体系成功表达过,不同表达体系的特点如下表:
| 表达体系 | 优点 | 缺点 |
| 原核表达体系(大肠杆菌等) | 周期短,培养条件简单,成本低,生长速度快 | 没有翻译后修饰,可能形成包涵体 |
| 酵母表达体系 | 表达量高,部分翻译后修饰 | 错误的糖基化修饰 |
| 昆虫细胞表达体系 | 糖基和磷酸修饰 | 构建复杂,周期长 |
| 哺乳动物细胞表达体系 | 翻译后修饰完善 | 培养条件严苛,成本高 |
PART3:选择合适的标签(重组蛋白)
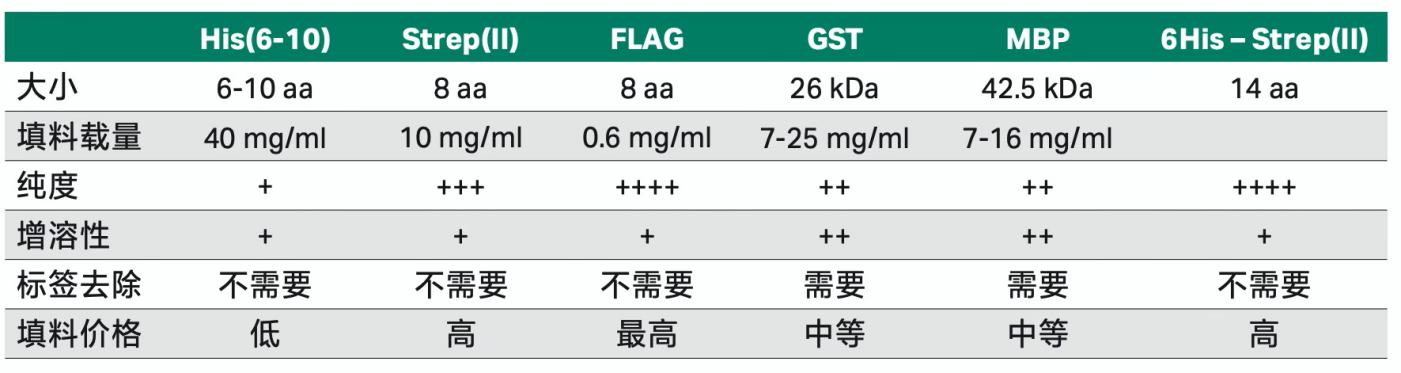
作为新手如果想要做重组蛋白纯化,一定要在构建的载体上加上一个合适的标签,然后再使用亲和层析作为第一步纯化往往可以帮你省去大量的时间和精力。标签的选择主要是根据蛋白的特点以及对纯度的要求,新手建议可以从His标签开始做起。
1、His标签:标签小,纯化步骤简便,纯化条件温和,能纯化可溶性/包涵体蛋白,一般不会影响蛋白的功能结构,且可以产出大量的目标蛋白,纯度和其他标签相比略低,如果对纯度不是要求特别高的情况下首选;
2、GST标签:洗脱条件温和,有助于保持蛋白功能活性,适合pull-down 检测,具有很好的线性动态范围,但分子量较大,需要在纯化后去除标签,且不适宜变性环境;
3、MBP标签:可以减少目标蛋白的降解,增加蛋白的表达量和稳定性,提高表达产物的水溶性,但标签较大,对蛋白的结构和功能可能会有一定影响;
4、Strep标签:能纯化出高纯度的目标蛋白,纯化条件温和,能进行变性条件下的纯化。纯化柱和填料的价格和其他标签相比略高;
不同标签的特点如下表:
PART4:选择合适的纯化方法和层析路线
前期做了诸多准备之后,我们就可以开始选择纯化方法了。常见的纯化方法包括亲和层析,
凝胶过滤层析,离子交换层析,疏水层析,多模式层析等等。不同的纯化方法可以通过目标蛋白和杂质的不同的性质进行分离和纯化,有时候目标蛋白和杂质在某一个特性方面比较接近,可以考虑使用其他的特性去除杂蛋白,所以如果一种纯化方法不能达到理想的纯度,可以考虑使用多种方法联用。不同的纯化方法的介绍如下:
1、亲和层析:利用目标蛋白上面的标签特性对蛋白进行纯化。根据蛋白所带的标签选择对应标签的预装柱和填料即可(例如蛋白带有His标签,则选择His标签预装柱和填料)。亲和层析具有载量高,快速分离的特点,是重组蛋白纯化第一步的不二之选。
2、凝胶过滤层析:利用目标蛋白和杂蛋白的分子量大小的差异进行纯化。一般目标蛋白和杂蛋白的分子量相差一倍以上,可以达到比较好的纯化效果。因为凝胶过滤层析的特性,它也常常被用来分离蛋白多聚体,也是在结构生物学纯化中对亲和层析的很好的补充。
3、离子交换层析:利用目标蛋白和杂蛋白的带电性质的差异进行纯化。在同样PH的缓冲液中,由于目标蛋白和杂蛋白的等电点有差异,带有的电荷正负性和带电量都会有所不同。离子交换层析具有高分辨率的特点,可以用来很好的补充并提高样品的纯度。另外,如果样品没有标签,可以选择离子交换层析作为第一步纯化。
4、疏水层析:利用目标蛋白和杂蛋白的疏水性质的差异进行纯化。如果以上的方法还是无法去除杂蛋白,可以尝试使用疏水层析。
5、多模式层析:结合了多种层析模式的特点。可以作为以上方法很好的补充。
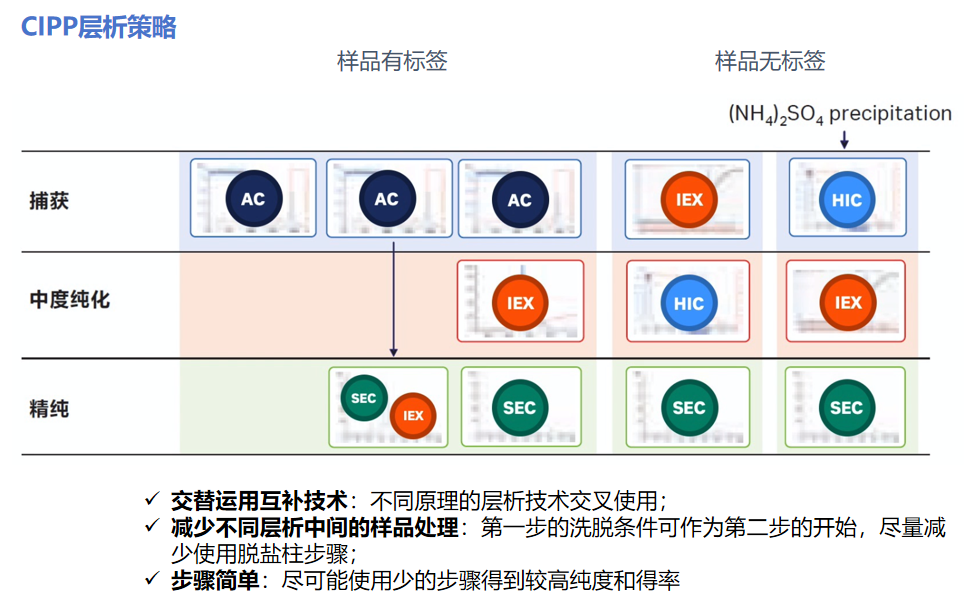
如何搭配层析方法?
在搭配层析方法时,使用CIPP策略。尽量不要将两种方法连续使用,尽量避免不同方法之间的样品处理,也要在样品纯度和得率之间找到平衡。CIPP原则的纯化策略如下图:
PART 5 如何对纯化后的蛋白进行检测?
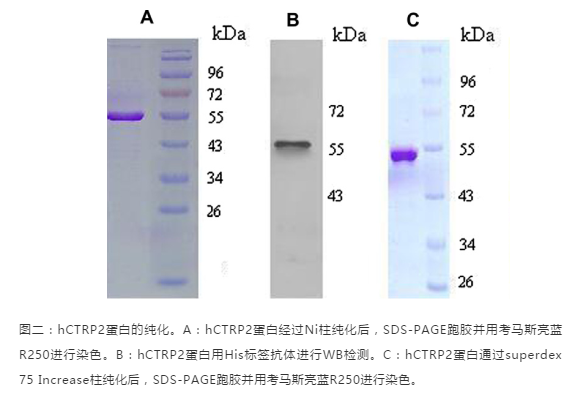
蛋白纯化完之后,我们需要对纯化出来的蛋白进行检测看是否达到纯化的要求。
1、检测蛋白特异性:可以使用WB和质谱的方法;
2、检测蛋白纯度:跑SDS-PAGE胶,然后用考马斯亮蓝染色后观察;
3、检测蛋白量:用紫外吸光光度法,BCA法或者考马斯亮蓝法检测蛋白浓度;
4、检测均一性:凝胶过滤层析检测是否有多聚体;
5、检测活性:使用活性检测试剂盒;
检测示例:
部分热卖产品
| 货号 | 名称 | 类别 |
| abs60023 | 质粒提取试剂盒 | 质粒构建 |
| abs9331 | RNA提取试剂盒 | 质粒构建 |
| abs60322 | Lipofect5000 质粒转染试剂 | 质粒构建 |
| 114-01 | jetPRIME转染试剂 | 质粒构建 |
| abs60055 | 2×Pfu Master Mix(Quick Load) | 质粒构建 |
| abs60036 | 2×Taq PCR Mix | 质粒构建 |
| SH30809.01 | RPMI 1640培养基 | 蛋白表达 |
| SH30022.01 | DMEM高糖培养基 | 蛋白表达 |
| SH30023.01 | DMEM/F12培养基 | 蛋白表达 |
| SH30042.01 | 胰酶 | 蛋白表达 |
| SH30406.05 | 血清 | 蛋白表达 |
| 17524802 | HISTRAP HP 5 X 5 ML | 蛋白纯化 |
| 17531801 | NI SEPHAROSE 6FF, 25 ML | 蛋白纯化 |
| 17528201 | GSTRAP HP 1 X 5 ML | 蛋白纯化 |
| 17115401 | HITRAP Q HP 5X5 ML | 蛋白纯化 |
| 17515401 | HITRAP DEAE FF 5 X 5 ML | 蛋白纯化 |
| 28990944 | Superdex 200 Increase 10/300 GL | 蛋白纯化 |
| 29148721 | Superdex 75 Increase 10/300 GL | 蛋白纯化 |
| 28989333 | HiLoad 16/600 Superdex 75 pg | 蛋白纯化 |
| 28989335 | HiLoad 16/600 Superdex 200 pg | 蛋白纯化 |
| 27084301 | PreScission剪切酶 | 标签剪切:剪切酶 |
| 27084601 | Thrombin剪切酶 | 标签剪切:剪切酶 |
| UA070001-250IU | Enterokinase, Bovine | 标签剪切:剪切酶 |
| UA070003-1kU | Recombinant Tobacco Etch Virus Protease (rTEV) | 标签剪切:剪切酶 |
| UA070044-100U | HRV 3C Protease | 标签剪切:剪切酶 |
| UA070004-1kU | Recombinant SUMO Protease, Yeast | 标签剪切:剪切酶 |
| S0B0006-25μl | His-tag Recombinant Rabbit mAb (SDT-R007) | 蛋白检测:标签抗体 |
| S0B0271-25μl | GST Tag Recombinant Rabbit mAb (S-372-19) | 蛋白检测:标签抗体 |










 危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)
危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)  营业执照(三证合一)
营业执照(三证合一)