T细胞是淋巴细胞的主要组分,它在许多疾病的防御中都起着至关重要的作用,包括对感染的清除、肿瘤的抑制以及在自身免疫性疾病中维持免疫耐受。因此,研究T细胞对于理解免疫调节和开发新的治疗策略具有重要意义。
近年来,出现了一系列基于T细胞的免疫疗法,其中研究最热门的就是过继性T细胞疗法(ACT),它包括两种主要形式:TIL疗法(Tumor Infiltrating Lymphocyte Therapy),从患者肿瘤中分离出肿瘤浸润性淋巴细胞(TILs),在体外扩增后再输回患者体内,增强对肿瘤的免疫反应;TCR-T和CAR-T疗法,通过基因工程技术改造T细胞,使其表达特定的T细胞受体(TCR)或嵌合抗原受体(CAR),从而能够识别并攻击特定的肿瘤抗原。最近,Nature更是发布了在TCR-T和CAR-T疗法取得的突破性研究进展,包括通过改造T细胞让TCR-T和CAR-T细胞抗癌能力提高百倍、CD61与CD103配对能够促进TCR信号抑制耗竭从而增强CD8+ T细胞抗肿瘤免疫!接下来,小优就带大家具体来看看这些最新进展以及它们的研究思路吧~
1
标题:Naturally occurring T cell mutations enhance engineered T cell therapies
发表时间:2024.2.7
期刊:Nature(IF:64.8)
原文链接:https://doi.org/10.1038/s41586-024-07018-7

文章概述
T细胞疗法在血液癌症的治疗中已经取得了突破性进展,但由于T细胞耗竭、在体内持久性差、免疫抑制微环境等因素,可能会阻碍治疗效果。在人类T细胞癌中,T细胞会发生突变,从而增强自身对肿瘤免疫微环境的适应性,因此,作者将研究方向转移到T细胞的突变上。通过筛选来自T细胞肿瘤的71个突变对T细胞信号、细胞因子产生和肿瘤体内持久性影响,作者发现了一种融合基因——CARD11-PIK3R3,它可以显著增加AP-1和NF-κB信号、IL-2的产生以及增强对体内外的肿瘤杀伤力。
文章主要内容
1. 体内外突变筛选
在体外突变筛选实验中,本研究构建了一个包含71个突变和45个野生型对照的文库。通过体外共培养实验(图1a),综合流式细胞仪、Elisa等检测方法,发现了许多突变对TCR依赖的信号和T细胞表型产生了各种显著影响,例如AP-1报告基因的表达可以下调60%或增加近三倍, IL-2在BRAF突变中增加了15到396倍,在CARD11突变中增加了114到359倍(图1b-e)。
在体内突变筛选实验中,作者在异种移植模型中系统地筛选了原代人类CAR T细胞的突变,将原代人类T细胞与CD19-BBz-CAR和突变构建体共转导,然后注射到免疫缺陷小鼠体内,使小鼠皮下携带CD19-K562肿瘤。经过鉴定,显著富含肿瘤浸润性T细胞的构建体包括MYCN、CARD11与PIK3R3融合体、CCND3、野生型MYCN,STAT3与RLTPR(图1f)。
 图1:在体外和体内筛查确定了重编程CAR信号和功能输出的T细胞突变
图1:在体外和体内筛查确定了重编程CAR信号和功能输出的T细胞突变
相关产品推荐:
| 货号 | 品名 | 用途 |
| 560994 | FITC Mouse Anti-Human CD19(HIB19) | FCM |
| 555190 | Human IL-2 ELISA Set | ELISA |
2. CARD11-PIK3R3增强了CBM 信号转导
在正常T细胞中,TCR信号激活PKCθ,进而促进CARD11-BCL10-MALT1(CBM)信号体的组装,该复合体是正常T细胞对抗原产生反应和激活所必需的(图2a)。CBM信号体有3种主要的输出形式:NF-κB和AP-1的转录活性及MALT1蛋白水解性。CARD11-PIK3R3融合基因最早是在CD4+皮肤T细胞淋巴瘤患者中被发现的,作者通过对其结构域的研究进一步发现,它能够显著增强NF-κB和AP-1信号以及IL-2的产生,并且该过程需要PIK3R3羧基末端的SH2结构域的参与(图2b-c)。MALT1底物CYLD和HOIL1(也称为RBCK1)的WB实验结果表明,CARD11-PIK3R3招募了CBM复合体,并诱导了MALT1的活性(图2d)。
进一步研究表明,CARD11-PIK3R3的功能发挥依赖于BCL10来转导TCR从而激活NF-κB,而不依赖于CARD11来进行CAR信号传递(图2e)。当CARD11- BCL10相互作用被取消时,NF-κB信号传递减少(图2f),同样,PIK3R3 SH2结构域结合的磷酸化酪氨酸残基的突变也会导致NF-κB信号传递显著减少(图2g)。综上所述, CARD11-PIK3R3以一种依赖于BCL10和PIK3R3 SH2结合的磷酸化酪氨酸残基方式来增强CBM复合体信号的转导。
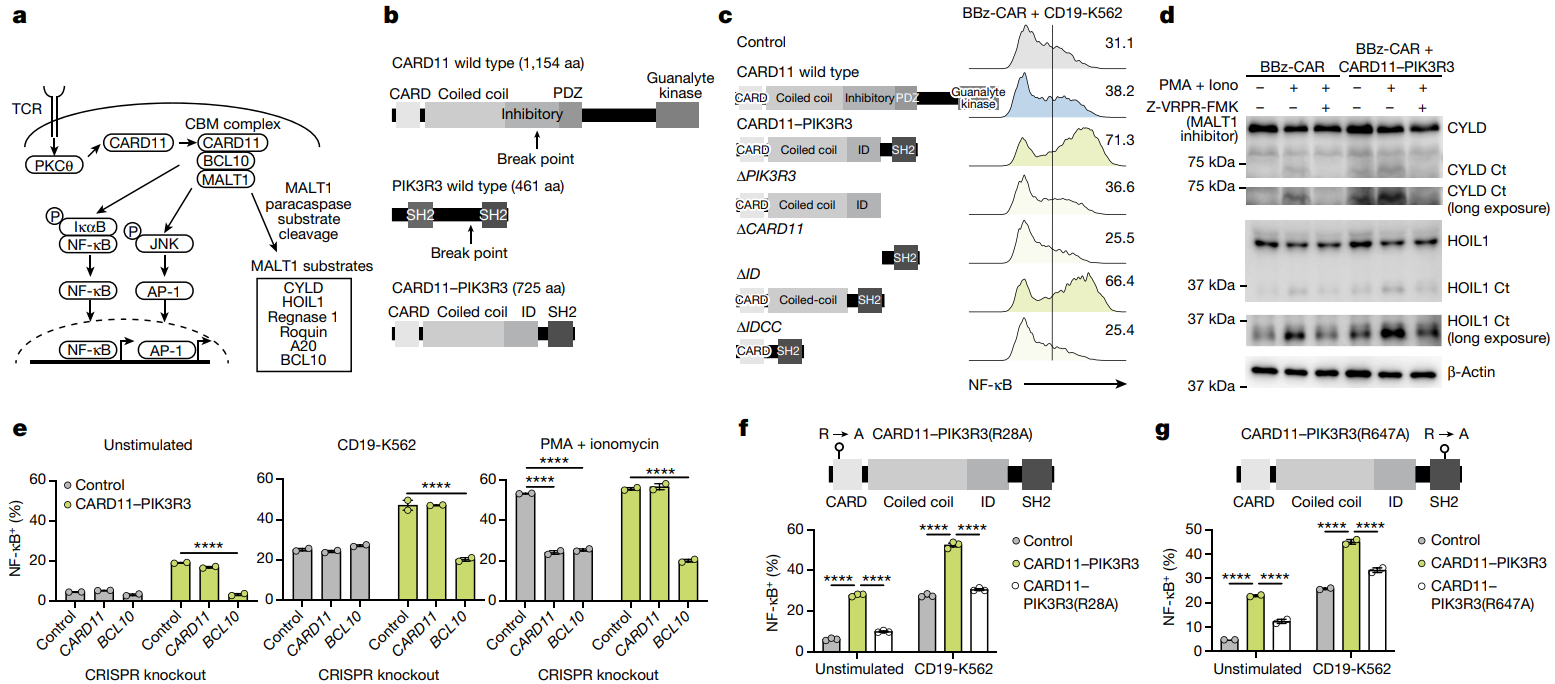 图2:CARD11-PIK3R3增强了CBM 信号转导
图2:CARD11-PIK3R3增强了CBM 信号转导
相关产品推荐:
| 货号 | 品名 | 用途 |
| 4440S | CARD11 Antibody | 信号通路抗体 |
| sc-74435 | cylindromatosis 1 (E-10) | WB |
3. CARD11-PIK3R3增强了CAR T细胞的功能
作者对有无抗原的人类CD4+和CD8+ T细胞进行了RNA测序,经过CAR刺激后,共找到了43个表达显著上调基因(图3a)。其中,表达CARD11-PIK3R3的CD4+ T细胞富含与细胞周期相关的基因,而CD8+ T细胞则富含与RNA代谢、细胞因子信号转导和转录翻译有关的基因,该结果与生化分析一致,在CD8+ T细胞发现了大量NF-κB、AP-1和MALT1信号(图3B)。进一步研究表明,CARD11-PIK3R3不足以引起抗原依赖的T细胞增殖。尽管CARD11-PIK3R3最初在CD4+ T细胞癌中被发现的,但是CD8+ CAR T细胞的相关细胞因子分泌要显著高于CD4+ CAR T细胞,值得注意的是,细胞因子的分泌是抗原依赖的(图3c-d)。
肿瘤微环境通常缺乏细胞毒性T细胞所需的促生存细胞因子,如IL-2,然而表达CARD11-PIK3R3的CAR T细胞在缺乏IL-2的情况下,也能有效清除肿瘤靶细胞。这些结果表明,CARD11-PIK3R3能够增强T细胞的细胞毒性(图3e)。
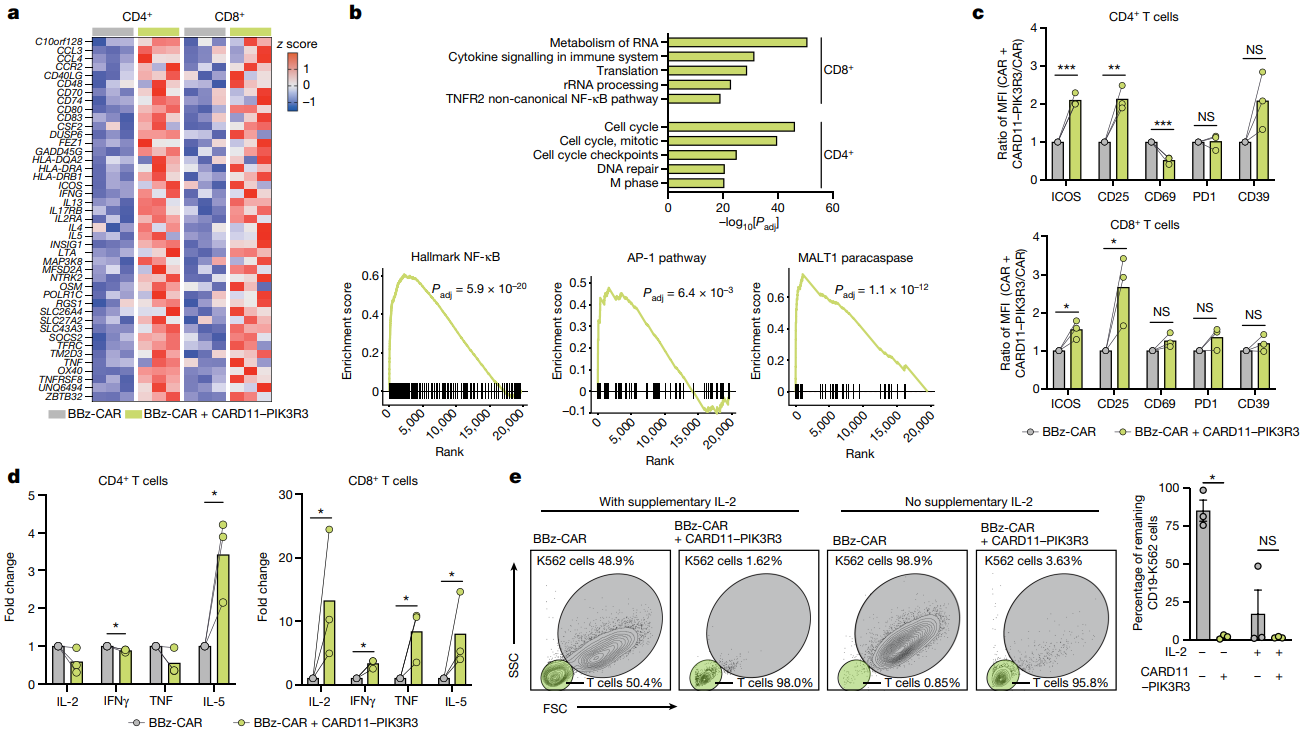 图3:CARD11-PIK3R3的表达增强了原代人类CD8+T细胞的信号、转录以及功能
图3:CARD11-PIK3R3的表达增强了原代人类CD8+T细胞的信号、转录以及功能
接下来,作者研究了在CD19+ Nalm6异种移植白血病模型中,CARD11-PIK3R3能否促进CD19-BBz-CAR T细胞的治疗效果。当TCR基因被敲除后, CARD11-PIK3R3 CAR T细胞清除了Nalm6白血病,小鼠33d存活率为100%,而对照CAR T细胞未能抑制Nalm6白血病(图4a)。即使在7×106 CAR+ T细胞的较高剂量下,结果也是一样,但要注意的是缺失CD19-CAR的CARD11-PIK3R3 T细胞没有抗肿瘤作用,表明肿瘤清除需要抗原(图4b)。这些数据表明,CARD11-PIK3R3在保持安全性的同时提高了治疗效果,即使在高剂量T细胞下也是如此。将4×105 CD19-CD28z-CAR T细胞或CARD11-PIK3R3 CD19-CD28z-CAR T细胞注射到Nalm6肿瘤小鼠模型中进行研究,后者依旧清除了Nalm6白血病(图4c-d)。因此,CARD11-PIK3R3的抗肿瘤效果改善了28z和BBz CARs在体内的功能。
为了进一步评估CARD11-PIK3R3的功能作用,作者还研究了间皮瘤皮下模型(M28),靶向肿瘤相关抗原MCAM。结果表明,CARD11-PIK3R3 MCAM-CD28z-CAR T细胞处理的动物在大约70天的过程中对M28肿瘤有显著抑制作用,并且没有表现出毒性或体重下降的迹象(图4e)。因此,CARD11-PIK3R3还可以安全地提高体内实体瘤环境中人CAR T细胞的长期治疗效果。在B16-F10黑色素瘤小鼠模型中的研究表明,CARD11-PIK3R3 CD19-BBz-CAR细胞在体内有更多的扩增和和功能持久性(图4f),此外,与未转导或CD19-BBz CAR T细胞相比,CARD11-PIK3R3 CAR T细胞显示出更强的肿瘤控能力,进而提高了小鼠的存活率(图4g)。
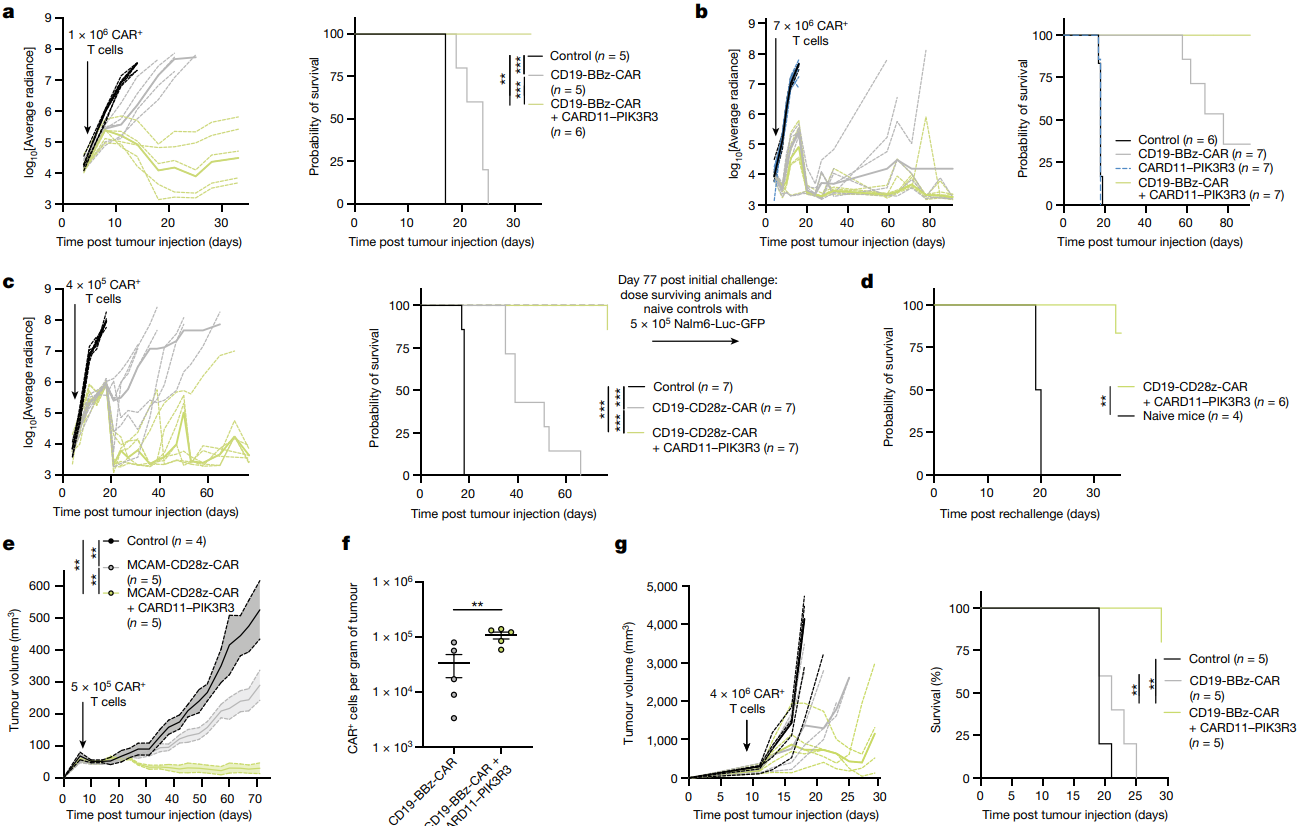 图4:CARD11-PIK3R3提高人和小鼠CAR T细胞体内治疗效果的研究
图4:CARD11-PIK3R3提高人和小鼠CAR T细胞体内治疗效果的研究
相关产品推荐:
| 货号 | 品名 | 用途 |
| 130-096-495 | CD8+ T Cell Isolation Kit, human | 细胞分选 |
| 130-091-441 | T Cell Activation/Expansion kit, human | T细胞活化扩增 |
4. CARD11-PIK3R3增强了TCR T细胞的功能
为了评估CARD11-PIK3R3 T细胞在TCR转基因肿瘤模型中的有效性,作者使用了B16-F10黑色素瘤模型,其中黑色素瘤细胞表达鸡卵蛋白(OVA)(图5a)。研究发现,在转移7天后,肿瘤浸润性淋巴细胞(TILs)中表达CARD11-PIK3R3细胞的数量比对照细胞增加了145倍(图5b)。在移植1×106 CARD11-PIK3R3 OT-1细胞7天后,CARD11-PIK3R3 OT-1在肿瘤、脾脏和肿瘤引流淋巴结中均显著富集,CARD11-PIK3R3增加了TILs相关转录因子TCF1的表达(图5c)。此外,CARD11-PIK3R3也增加TNF、IFNγ和IL-2的产生以及表达(图5d)。总之,这些结果表明,CARD11-PIK3R3的表达促进了高功能干细胞在肿瘤内的积累。
进一步细胞剂量反应实验发现,与未经治疗的幼鼠相比,低剂量的CARD11-PIK3R3 OT-1 T细胞足以提供显著防止肿瘤发展的保护功能(图5e)。接下来,作者还在人类TCR模型中评估了CARD11-PIK3R3的疗效,结果发现CARD11-PIK3R3的表达显著增强了TCR T细胞对肿瘤清除能力(图5f)。因此,CARD11-PIK3R3的表达增强了人和小鼠治疗性TCR细胞的功能。
综上所述,表达CARD1-PIK3R3的T细胞在几种免疫治疗的难治性肿瘤模型中均表现出了非常高效的体内治疗功能,包括基于CAR和TCR转基因的模型。
 图5:CARD11-PIK3R3增强小鼠和人TCR转基因T细胞的体内治疗效果
图5:CARD11-PIK3R3增强小鼠和人TCR转基因T细胞的体内治疗效果
相关产品推荐:
| 货号 | 品名 | 应用 |
| 130-095-362 | Human IL-7, premium gr. (25 µg) | 细胞因子 |
| 130-095-765 | Human IL-15, premium gr. (100 µg) | 细胞因子 |
| LXR-MultiDTM-23 | 小鼠细胞因子组合-23因子 | Luminex |
实验技术及研究思路解析
1. 流式细胞术:分析和分选细胞,确定细胞表面标志物的表达,以及进行细胞群体的定量分析;
2. 基因敲除:CRISPR技术进行基因编辑,以敲除特定的基因,例如在T细胞中敲除TCR基因;
3. 逆转录定量PCR:从少量RNA中构建cDNA库,并进行高通量测序,以分析基因表达;
4. 免疫印迹分析:用于检测特定蛋白质的表达和定量;
5. 荧光共振能量转移 (FRET):研究蛋白质间的相互作用和构象变化;
6. 基因融合技术:创建新的基因融合产物,例如CARD11-PIK3R3,以增强T细胞的治疗效果;
7. 病毒介导的细胞转染法:将外源基因或突变引入T细胞;
8. 细胞培养:扩增和维持T细胞和其它癌细胞系;
9. 小动物模型:评估T细胞疗法在活体内的疗效和安全性;
10. 基因组测序:分析T细胞肿瘤的基因组,以识别有益的突变;
11. 生物信息学分析:处理和解释高通量测序数据,以及进行基因和蛋白质的功能性分析;
12. 酶联免疫吸附试验 (ELISA):定量检测细胞培养上清中的细胞因子水平;
13. 细胞活性和增殖测试:评估T细胞的活性和增殖能力;
14. 组织病理学分析:检查组织切片,评估治疗效果和潜在的毒性。
2
标题:Unconventional human CD61 pairing with CD103 promotes TCR signaling and antigen-specific T cell cytotoxicity
发表时间:2024.4.1
期刊:Nature Immunology(IF:30.5)
原文链接:https://doi.org/10.1038/s41590-024-01802-3

文章概述
整合素是一种大的异源二聚体跨膜糖蛋白,可促进细胞间以及细胞与细胞外基质的黏附,它们需要α和β亚基之间的配对,才能离开内质网到达细胞表面,进而激活其功能作用。整合素CD61能够与小鼠T细胞上的CD41或CD51配对,但CD61在包括癌症在内的人类疾病中对抗原特异性T细胞免疫的表达和功能意义仍不清楚。本研究发现,CD61能够与CD103在T细胞的突触中配对;CD61与T细胞抗原受体共定位进一步调节下游T细胞抗原受体信号,提高抗肿瘤细胞毒性作用,抑制肿瘤生长。综上所述,CD61在人类免疫细胞上瞬时表达并与CD103配对,为免疫细胞疗法提供了新靶点。
文章主要内容
1. CD61在CD103+ CD8+ T细胞克隆和TRM TIL上的表达
CD103+ TIL的存在和富集被认为是临床预后的良好指标,为了研究这些T细胞如何促进保护性免疫,作者克隆了来自胃癌患者和黑色素瘤患者中的CD103+和CD103− CD8+ T细胞。
首先,通过比较蛋白质组学特征,发现了一些与免疫活动有关的蛋白质亚群,包括免疫效应因子/细胞因子、整合素、代谢相关蛋白、TGF-β1相关蛋白和表观遗传相关蛋白(图1a)。此外, CD61在CD103+克隆细胞富集(图1b)。接下来,作者对一组非小细胞肺癌(NSCLC)患者的样本进行了IHC和流式细胞仪分析,发现CD103+ TILs中存在CD61+ T细胞(图1c),并且CD61+ TIL亚群在这些患者的肺部肿瘤组织中显著富集(图1d-e)。
进一步研究发现,来自7个不同癌症患者的CD103+ T细胞株与其配对的CD103− T细胞株相比,CD61表达呈阳性(图1f)。综上所述,这些发现表明CD61在人类抗原特异性CD8+ T淋巴细胞上是非常规存在和表达的,尤其是针对癌症患者。
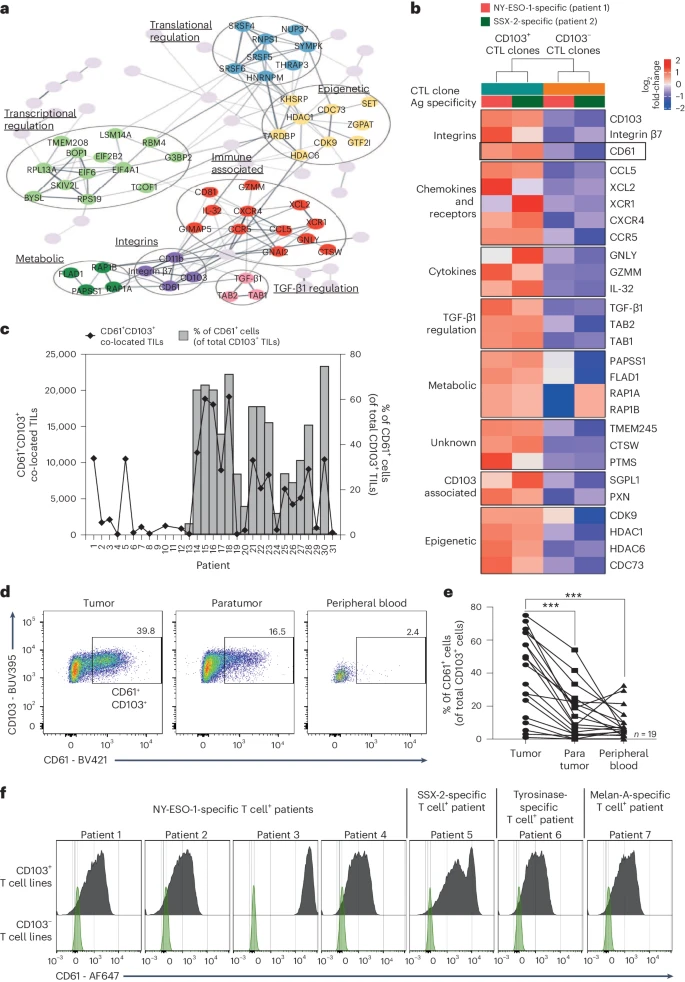 图1:CD61在 CD103+CD8+T细胞中的表达
图1:CD61在 CD103+CD8+T细胞中的表达
相关产品推荐:
| 货号 | 品名 | 应用 |
| 744381 | Hu CD61 BV421 VI-PL2 50ug | FCM |
| 564346 | BUV395 Mouse Anti-Human CD103(Ber-ACT8) | FCM |
| 612889 | BUV805 Mouse Anti-Human CD8(SK1) | FCM |
2. CD61 与 CD103 在突触上短暂共聚焦
通过研究不同激活方案CD61在人类T细胞上的动力学表达,发现CD103+ T细胞系在被αCD3/αCD28 抗体激活或与抗原性癌细胞共培养后,CD61的表面表达呈阳性,而在静息 T细胞中则检测不到CD61的表达(图2a)。
作者使用全内反射荧光显微镜(TIRFM)观察到在T细胞膜和双层接触点的中央超分子激活簇(CSMAC)区域内,CD61和CD103的共定位表达随时间而增加(图 2b、c)。然而,CD103的已知典型整合素β7位于最外层的突触区,也称为远端超分子活化簇(dSMAC),表明它在突触处呈负相关,这可能是由于CD49d与β7的早期配对和定位,导致β7与 CD103分离(图2b、d、e)。进一步研究表明,CD61和CD103在人T细胞上会发生相互作用(图2f-h)。
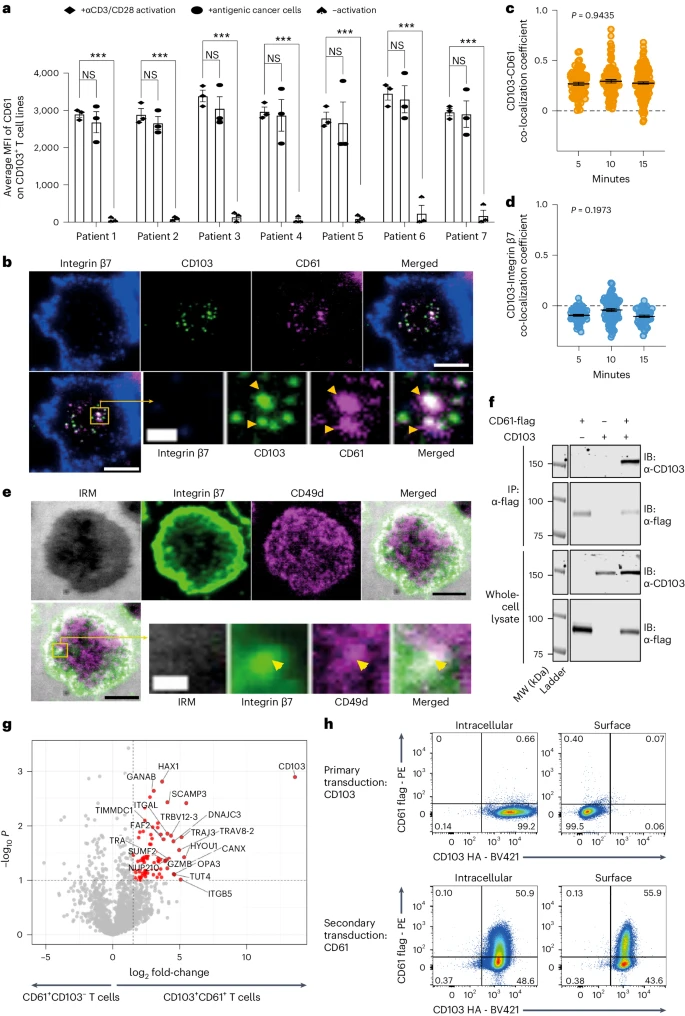 图2:CD61与CD103的短暂共聚焦
图2:CD61与CD103的短暂共聚焦
相关产品推荐:
| 货号 | 品名 | 应用 |
| 563851 | BV650 Mouse Anti-Human CD3(UCHT1 ) | FCM |
| 741168 | Hu CD28 BUV496 CD28.2 50ug | FCM |
| 755215 | Hu Itgrn Alp1 (CD49a) BUV496 TS2/7 50ug | 细胞染色 |
| 564283 | BV421 Rat Anti-Integrin β7(FIB504) | 细胞染色 |
3. CD61增强了TCR信号转导
在CD61和CD103在 cSMAC 共定位的同时,作者也观察到CD61与TCRαβ之间以及CD103与TCRαβ之间的共定位,这表明CD61可能会调控TCR信号活动(图3a)。
在CD61KO T细胞中,Zap70和PLCγ1两种蛋白的磷酸化水平逐渐降低(图3c)。进一步研究发现CD61在调节ZAP70的磷酸化中发挥着重要的作用,当使用αCD61中和抗体处理后,磷酸化的 Zap70 水平明显下降(图3d)。
已有研究表明蛋白激酶Lck 可维持Zap70在TCR复合物胞质结构域的磷酸化,作者通过更深入的研究,证明了CD61是Lck依赖性Zap70磷酸化的调节因子。综上,这些观察结果表明CD61可增强TCR近端信号转导,包括以Lck依赖性方式增强Zap70的磷酸化水平(图 3e-f)。
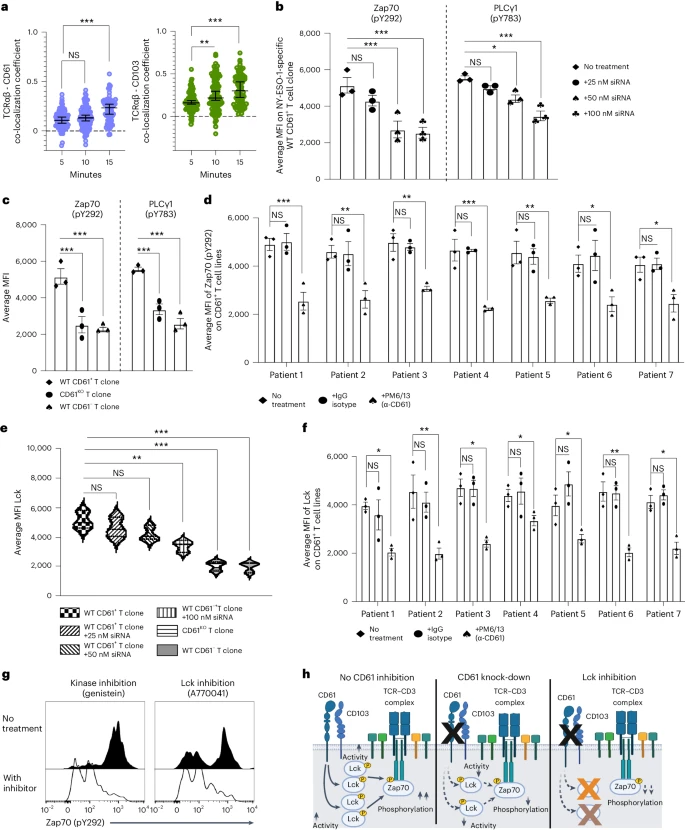 图3:CD61增强TCR信号转导
图3:CD61增强TCR信号转导
相关产品推荐:
| 货号 | 品名 | 应用 |
| 743712 | Hu CD324 BV421 67A4 50ug | T细胞功能检测抗体 |
| 557883 | PLC Gma1 (pY783) Alexa 647 27/PLC 50Tst | T细胞功能检测抗体 |
| 558552 | PE Mouse Anti-Human Lck (pY505)(4/LCK-Y505) | T细胞功能检测抗体 |
4. CD61提高了T细胞的细胞毒性和肿瘤控制能力
为了确定CD61对T细胞抗肿瘤免疫的重要性,作者进行了体外T细胞脱颗粒和细胞毒性分析。结果发现,与CD61 siRNA、CD61 KO和WT CD61- T 胞相比,癌症特异性WT CD61+ T细胞的细胞脱颗粒标记物CD107a表达明显升高(图4a);此外,用阻断抗体中和CD61也会限制CD61+ T 细胞的脱颗粒能力(图4b)。与脱颗粒活性增加的结果一致, CD61 siRNA 处理和CD61KO T细胞表现出细胞毒性受损(图 4c),进一步研究也证实了抗CD61中和抗体持续限制了这些T细胞系的细胞毒性反应(图 4d)。
对异种移植抗原肿瘤的小鼠模型的研究发现,与CD61- T细胞相比,注射CD61+ T细胞的小鼠肿瘤生长明显减缓(图 4e)。此外,肿瘤大小的差异在第二次T细胞过继转移后很容易观察到,第三次T细胞注射后的差异更大(图4f-g)。
通过临床数据分析发现,与CD61loCD103+CD8+CD3+患者相比,CD61hiCD103+CD8+CD3+患者的总生存概率(OS)在临床预后表现更好(图 4h)。进一步研究发现,与 CD61loCD103+CD8+CD3+患者相比,CD61hiCD103+CD8+CD3+患者的OS在临床预后也有所改善(图 4h)。
综上所述,体外、体内和临床研究结果表明,CD61在促进T细胞细胞毒性、缓解肿瘤生长和改善患者OS方面发挥着独特的作用。
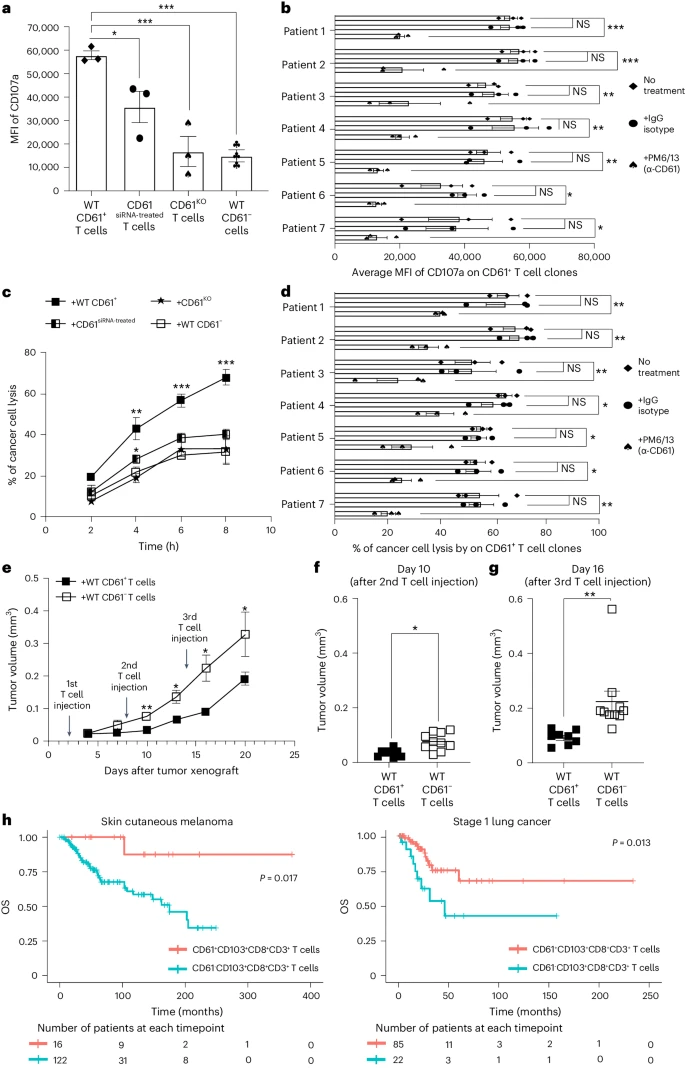 图4:CD61增强细胞毒性和肿瘤控制
图4:CD61增强细胞毒性和肿瘤控制
相关产品推荐:
| 货号 | 品名 | 应用 |
| 566996 | Alexa Fluor 647 Mouse Anti-Human Granzyme M(4B2G4) | FCM |
| 560212 | Alexa Fluor 647 Mouse anti-Human Granzyme B(GB11) | FCM |
| 741155 | Hu CD62L BUV496 DREG-56 50ug | FCM |
5. CD61+ TIL具有增强的效应表型
对19例非小细胞肺癌患者的肿瘤进行了多色流式细胞术分析,结果表明:与CD61- TIL相比,CD61+ TIL上关键的抗肿瘤效应细胞因子、趋化因子和细胞溶解分子的表达显著上调(图5a-b)。此外,作者还证实了CD61+ TIL上粒细胞素和粒酶M的表达尤其依赖于CD61的活性,因为使用抗CD61阻断抗体处理后,这两种细胞因子的表达都会受损(图5c)。
与CD61- TIL相比,CD61+ TIL具有显著的组合免疫效应物特征(图5d)。使用IHC 方法证实, CD61+ TIL在肿瘤小体内出现的频率明显更高(图5e)。在对NSCLC 患者队列进行分析时发现, CD61+ TIL上的组合标记物显著富集,因此表明TIL亚群很可能在肿瘤微环境中具有免疫反应性(图5f)。
 图5:CD61+ TIL在非小细胞肺癌中具有增强的抗肿瘤效应表型
图5:CD61+ TIL在非小细胞肺癌中具有增强的抗肿瘤效应表型
6. CD61+ TIL 未表现出耗竭的特征
众所周知,肿瘤微环境是免疫抑制的,这是公认的导致慢性T细胞耗竭的原因。与CD61- TIL相比,CD61+TIL中PD-1高表达,但TIM-3和TIGIT的表达减少(图6a)。并且,CD61+ TIL的PD-1+Tim-3+TIGIT+组合表达频率有限(图6b),证实了这一观察结果。相反,CD61+ TIL高度富集了PD-1+Tim-3-TIGIT-群体(图6c)。
作者发现, CD61+ TIL并不处于分化的终末阶段(T细胞耗竭的标志之一),这与其更活跃、反应更快的特性相一致;与之相反,它们富含早期分化细胞(CD27+ CD28+)(图6d)。进一步研究证实, CD61+ TIL能够进行更多的细胞分裂,增强细胞增殖能力(图6e-f)。
综上所述,这些发现突出表明 CD61+ TIL是主动的、对肿瘤有反应的T细胞,表现出更强的抗肿瘤效应和细胞毒性免疫反应,但缺乏多种免疫检查点受体的表达(TIL耗竭的一个关键标志),因此,这些特性可能有助于提高T细胞抑制肿瘤生长的能力。
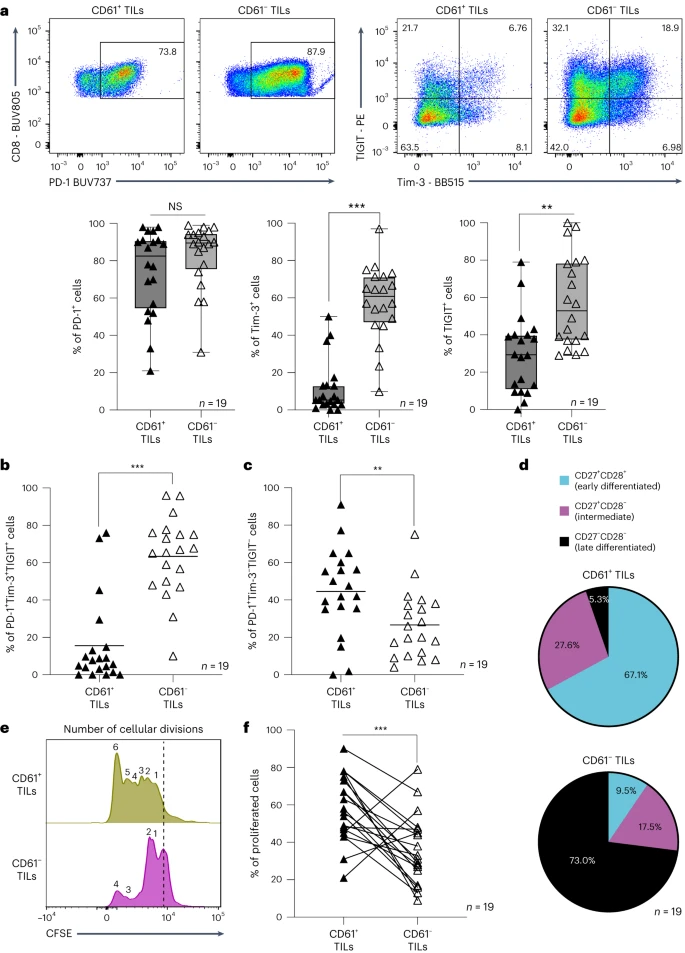 图6:CD61+ TIL 未表现出耗竭的特征
图6:CD61+ TIL 未表现出耗竭的特征
相关产品推荐:
| 货号 | 品名 | 应用 |
| 612791 | BUV737 Mouse Anti-Human CD279 (PD-1)(EH12.1) | FCM |
| 565568 | BB515 Mouse Anti-Human TIM-3 (CD366)(7D3) | FCM |
| 565562 | BV421 Mouse Anti-Human TIM-3 (CD366)(7D3) | FCM |
| 568672 | Hu TIGIT PE TGMAB-2 | FCM |
实验技术及研究思路解析
1. 流式细胞术:分析和定量细胞表面标志物,如CD61、CD103等,以及细胞分子,如Zap70和PLCγ1的磷酸化状态;
2. 免疫组化(IHC):在组织切片上定位和定量特定蛋白质的表达,例如在肿瘤组织中检测CD61、CD103的共定位;
3. 质谱分析(MS):蛋白质组学研究,通过比较CD103+和CD103− T细胞的蛋白质表达谱,以识别与CD103+ T细胞相关的蛋白质;
4. 共免疫沉淀(CoIP):检测两种或多种蛋白质之间的相互作用,如CD61与CD103的结合;
5. 细胞增殖实验:通常使用CFSE标记法来追踪和分析T细胞的增殖情况;
6. 体外T细胞功能实验:包括细胞毒性实验、CD107a表面标记实验Phosflow分析,用于评估T细胞的效应功能;
7. 全内反射荧光显微镜(TIRFM):观察和分析细胞与细胞之间的接触点,如T细胞与抗原呈递细胞之间的免疫突触;
8. CRISPR-Cas9基因编辑技术:敲除特定基因,如本研究中敲除CD61基因以研究其功能;
9. 蛋白质印迹:检测特定蛋白质的表达和修饰状态;
10. RNA和临床数据分析:使用公共数据库(如TCGA)进行生存分析和相关性研究;
11. 小鼠异种移植模型:评估T细胞对肿瘤生长的影响。
相关辅助产品推荐:
| 货号 | 品名 | 用途 |
| 10600023 | Amersham Hybond P 0.45UM PVDF 300MMx4M 1/PK | WB |
| 10600002 | PT 0.45UM 300MMx4M 1/PK | WB |
| abs9598-1盒 | Plastic gel 预制胶 Tris-Gly 10%, 15wells, 1.0mm | WB |
| 4967S | beta-Actin Antibody | WB |
| 17144002 | FICOLL PAQUE PLUS 6X100 ML | 人淋巴细胞分离液 |
| SV30208.02 | Australian FBS | 细胞培养 |
| SH30406.05 | New Zealand Characterized Foetal Bovine Serum | 细胞培养 |
| abs973-500ml | 胎牛血清(优级,辐照) | 细胞培养 |
| abs50003-500T | CCK-8试剂盒 | 测定细胞增殖或毒性 |
| abs9342 | Tris-EDTA抗原修复液(10x,pH9.0) | IHC |
| abs933 | 山羊血清 | IHC |
| abs929 | 免疫组化笔 | IHC |
| abs50012-20T | 四色多重荧光免疫组化染色试剂盒(鼠兔通用二抗) | IHC |
| abs955 | 免疫(共)沉淀(IP/CoIP)试剂盒 | CoIP |
| 101000017 | PEIpro® 1.5 mL | 病毒转染 |
| V4XC-2024 | sF Cell Line 4D X Kit L (24 RCT) | 电转 |
| sc-400164 | NFATc1 CRISPR/Cas9 KO Plasmid (h) | CRISPR/Cas9 |
| sc-405695 | AP-1μ1 CRISPR/Cas9 KO Plasmid (h) | CRISPR/Cas9 |










 危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)
危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)  营业执照(三证合一)
营业执照(三证合一)