翻译后修饰(PTM)提供对刺激的快速响应,微调新陈代谢和基因表达,并维持体内平衡。由于蛋白质合成是一个耗能和缓慢的过程,通过翻译后修饰来改变蛋白质功能提供了恢复体内平衡的快速和动态的反应。PTM极大地扩展了功能蛋白质组的数量,据估计,大约2万个基因可以产生大于100万种蛋白质形式。到目前为止,已经发现了450多种独特的蛋白质修饰,包括磷酸化、乙酰化、泛素化和sumo化等,这些修饰可以改变靶蛋白的活性、细胞内分布、蛋白质相互作用和蛋白质寿命。每种PTM靶标氨基酸、化学成分和代谢来源也各不相同,下图展示了我们已知的PTM类型以及其作用方式【1】。
 人类蛋白质组中PTM总览
人类蛋白质组中PTM总览
PTM种类众多,虽然许多PTM已经被详细研究(如磷酸化、乙酰化),但对于绝大多数PTM仍然缺乏其调控和影响细胞命运的明确机制,并且仍然有许多新的PTM形式被发现。因此关于PTM的研究仍然是一块宝藏之地。2024年4月和5月,国内3个课题组分别在Nature和Cell顶刊上接连发表了3篇关于翻译后修饰研究的文章,分别来自浙江大学朱永群课题组关于单磷酸腺苷酸化修饰,苏州大学医学院周芳芳课题组关于乳酰化修饰和北京大学医学部基础医学院姜长涛教授团队关于3-酰基化修饰的研究,具体研究内容我们快来先睹为快。
第一篇:Legionella effector LnaB is a phosphoryl-AMPylase that impairs phosphosignalling
2024年5月 22日,浙江大学朱永群课题组、周艳课题组和北京大学刘小云课题组联合在Nature上在线发表了题为“Legionella effector LnaB is a phosphoryl-AMPylase that impairs phosphosignalling”的文章,发现了一类广泛存在于病原菌中新型的以LnaB为代表的腺苷酸化酶效应蛋白家族,并揭示了全新的单磷酸腺苷酸化修饰和调节磷酸化信号转导的方式。
文章链接:https://www.nature.com/articles/s41586-024-07573-z

文章主要内容:
单磷酸腺苷酸化修饰(AMPylation)是一种广泛存在于原核和真核生物中的蛋白质翻译后修饰,在腺苷酸化酶的催化下,使用单磷酸腺苷基团(AMP)修饰蛋白质的氨基酸侧链。本文报道了使用三磷酸腺苷(ATP)作为配体和宿主肌动蛋白作为激活剂,嗜肺军团杆菌的效应蛋白LnaB对PR-Ub上的磷酸核糖基的磷酰基进行AMPylation,从而生成ADPR-Ub。ADPR-Ub进一步被ADP-核糖基水解酶MavL水解为Ub,从而防止PR-Ub和ADPR-Ub的积累,并保护宿主细胞中经典的泛素化途径。LnaB代表了一个新型的腺苷酸化酶(AMPylase)的大家族,这个家族在20多种的细菌病原体拥有一个共同的结构折叠,并和已知的AMPylase不同。此外,LnaB 对磷酸化残基也表现出很强的磷酸化AMPylase活性,并在蛋白中产生独特的ADPylation修饰。在感染过程中,LnaB AMPylate Src家族激酶的激活环中保守的磷酸化酪氨酸残基,从而抑制宿主下游的磷酸化信号。结构研究揭示了AMPylase的LnaB家族具有的肌动蛋白依赖的激活和催化机制。本研究提出了细菌致病和蛋白磷酸化的中从未发现的调控和分子机制。
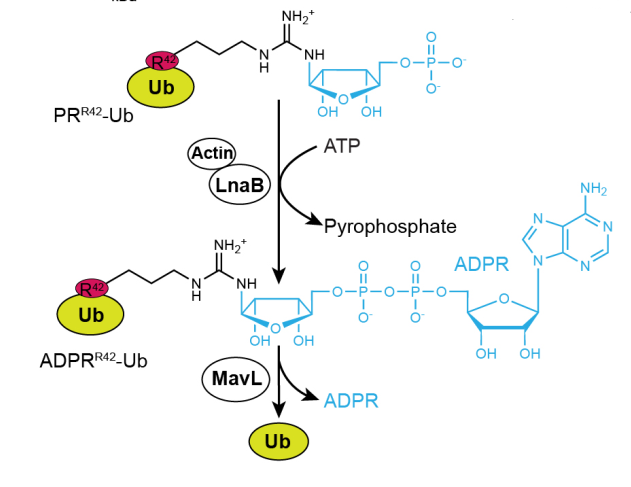
文章研究思路:
1、AMPylase LnaB的发现
体外实验发现嗜肺军团杆菌的裂解液可以水解ADPR-Ub和产生野生型的Ub,表明嗜肺军团菌中有一种未知的效应分子具有ADP-核糖水解酶(ARH)活性。进一步使用免疫共沉淀发现MavL具有很强的ARH活性来水解ADPR-Ub。结构分析和质谱表明,MavL是一个ADPR-Ub特异性的ARH。
MavL敲除会造成ADPR-Ub的积累,而进一步敲除sidEs基因会完全消除ADPR-Ub,表明MavL介导的ADPR-Ub是通过非典型性降解途径产生的。由于PR-Ub在宿主细胞中很少观察到,表明嗜肺军团杆菌中有一个未知的效应蛋白会通过修饰PR-Ub生成ADPR-Ub,然后进一步被MavL水解。为了鉴定这个新的效应蛋白,作者将嗜肺军团杆菌中186个未知功能的效应蛋白构建出来,并在293T细胞中过表达。通过检测,作者发现过表达LnaB的细胞裂解液产生了大量的ADPR-Ub。而敲除LnaB基因会破坏宿主细胞中ADPR-Ub的生成,表明LnaB是修饰PR-Ub并生成ADPR-Ub的效应蛋白。
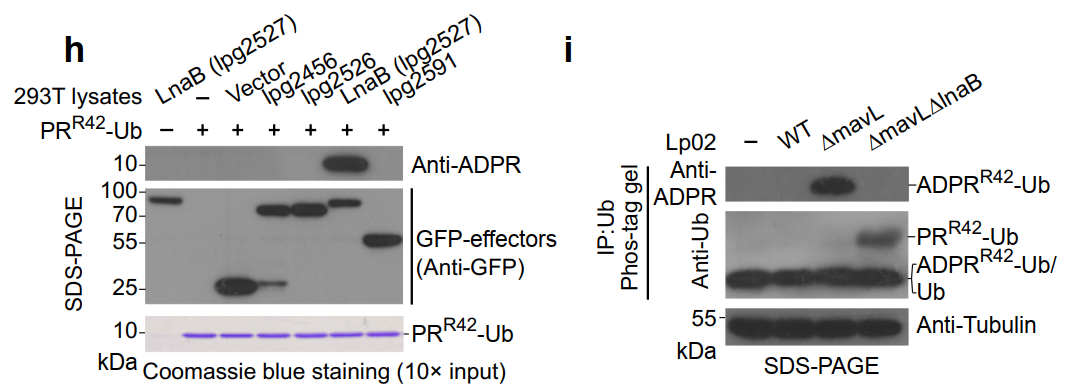 h:过表达GFP-LnaB后,细胞产生大量ADPR-Ub。
h:过表达GFP-LnaB后,细胞产生大量ADPR-Ub。
i:LnaB敲除后,ADPR-Ub减少。
| 货号 | 名称 | 规格 |
| sc-8017 | Ubiquitin (P4D1) | 200ug/ml |
| abs955 | 免疫(共)沉淀(IP/CoIP)试剂盒 | 50T |
| 5562S | PTMScan® Ubiquitin Remnant Motif (K-ε-GG) Kit | Kit |
2、LnaB是一个AMPylase
对LnaB的氨基酸进行突变,发现H305和E309是LnaB的具有催化功能的位点。利用高分辨率电子转移裂解(ETD)质谱分析LnaB的产物,发现有一个AMP基团被直接添加到PR-Ub的磷酰基上,表明LnaB是一个AMPylase。感染MavL和LnaB敲除的嗜肺军团菌会延迟UPS对蛋白的降解,表明MavL和LnaB蛋白会阻止ADPR-Ub和PR-Ub的积累,并保护宿主细胞的经典的泛素化降解过程。
为了进一步研究LnaB家族,作者使用电镜对LnaB结构进行分析。结果表明LnaB的结构包括N端结构域,催化结构域和C端延展的α螺旋。ATP/AMP结合在β1-β2发卡和α螺旋中间的催化口袋中。LnaB家族具有独特的AMPylation机制。
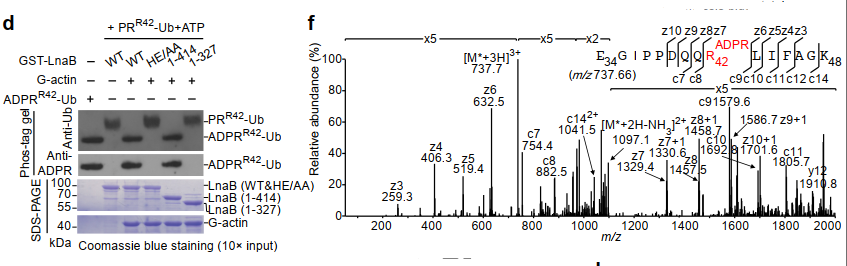 d:H305和E309突变为A后,LnaB功能丢失。HE/AA指H305和E309位点突变为A。
d:H305和E309突变为A后,LnaB功能丢失。HE/AA指H305和E309位点突变为A。
f:ETD质谱分析AMPylation位点。
| 货号 | 名称 | 规格 |
| 17528201 | GSTRAP HP 1 X 5 ML | 1×5ml |
| 27084301 | PRESCISSION PROTEASE | 500U |
| 28990944 | Superdex 200 Increase 10/300 GL | EA |
3、LnaB对磷酸化蛋白AMPylation并阻碍宿主激酶信号
LnaB过表达抑制了酵母的生长,表明LnaB对酵母有毒性,作者猜测LnaB可能在细胞中有其他的作用底物。由于LnaB具有磷酸化的AMPylase活性,作者继续研究LnaB家族对磷酸化蛋白是否具有AMPylase活性。使用NPM-ALK诱导细胞酪氨酸磷酸化之后,过表达LnaB蛋白可以引起大规模的AMPylation水平增加。利用质谱技术,发现LnaB能够对含有磷酸化丝氨酸,苏氨酸,酪氨酸残基的蛋白进行特殊的ADPylation修饰。
为了验证LnaB诱导的磷酸化蛋白AMPylation在细胞致病过程中的作用,宿主细胞的磷酸化介导的信号通路被大量检测。LnaB特异性的AMPylate Src家族激酶,这个家族激酶在免疫防御反应中起到重要的信号调控的作用。质谱分析表明,Src家族蛋白的磷酸化的Y412残基具有关键的酶活性,是LnaB AMPylation的作用位点。Y412磷酸化在宿主细胞中减少表明LnaB磷酸化会降低感染过程中Src家族的活性。AMPylation的Src家族激酶失去活性,抑制了下游磷酸化信号转导,从而抑制了其介导免疫信号通路。
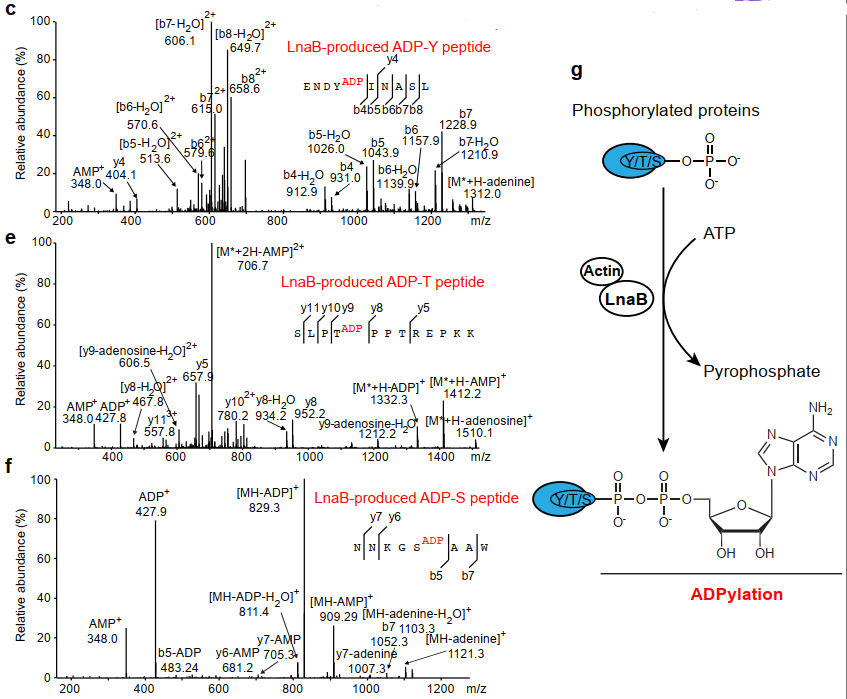 c-g:LnaB对磷酸化多肽催化并产生ADPylation修饰。
c-g:LnaB对磷酸化多肽催化并产生ADPylation修饰。
| 货号 | 名称 | 规格 |
| sc-166079 | c-Fgr (B-8) | 200ug/ml |
| 48984S | Phospho-Fgr (Tyr412) Antibody | 100ul |
| 2110S | Src (L4A1) Mouse mAb | 100ul |
| 70926S | Phospho-LYN (Tyr397)/LCK (Tyr394)/HCK (Tyr411)/BLK (Tyr389) (E5L3D) Rabbit mAb | 100ul |
| 38572S | PTMScan® HS Phospho-Tyrosine (P-Tyr-1000) Kit | Kit |
第二篇:Alanyl-tRNA synthetase, AARS1, is a lactate sensor and lactyltransferase that lactylates p53 and contributes to tumorigenesis
2024年4月22日,来自苏州大学医学院的周芳芳研究团队在Cell杂志上发表了题为Alanyl-tRNA synthetase, AARS1, is a lactate sensor and lactyltransferase that lactylates p53 and contributes to tumorigenesis的研究文章,揭示AARS1通过介导抑癌蛋白p53的乳酰化修饰来抑制p53的抗肿瘤活性。
文章链接:https://doi.org/10.1016/j.cell.2024.04.002

文章主要内容:
赖氨酸乳酰化是一种翻译后修饰,将细胞代谢与蛋白质功能联系起来。本文中,作者发现AARS1作为一种乳酸传感器,在肿瘤细胞中介导整体的乳酰化修饰。AARS1与乳酸结合,催化乳酸-AMP的形成,然后将乳酸转移到赖氨酸残基。蛋白质组学研究揭示了大量的AARS1靶点,包括p53蛋白的DNA结合域中的120位点赖氨酸和139位点赖氨酸被乳酰化。P53乳酰化后阻碍了其DNA结合和转录激活。在癌症患者中,AARS1的表达和P53的乳酰化与不良预后相关。在动物模型中,β-丙氨酸破坏乳酸与AARS1的结合,减少P53的乳酰化,并减轻肿瘤的发生。本研究提出了乳酰化和P53修饰调节的新机制。
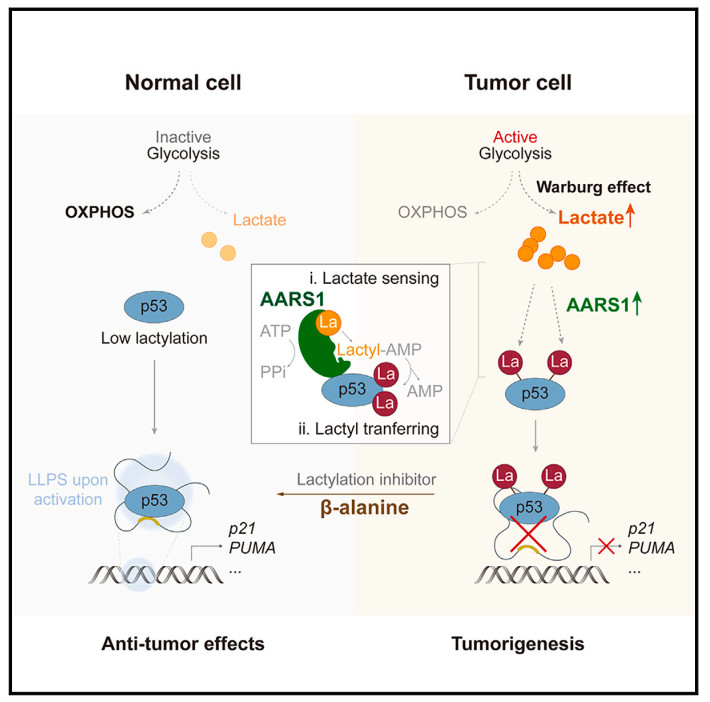
文章研究思路:
1、AARS1介导P53的乳酰化
在分析TCGA数据库乳腺癌数据时,作者发现在携带野生型p53的患者中,乳酸水平与p53通路的激活程度呈现相反的趋势,提示乳酸可能会抑制P53的功能。对小鼠进行乳酸钠注射会显著增大肿瘤体积,并且肿瘤中p53活性显著受到抑制。在用乳酸或乳酸钠预处理的细胞中,P53乳酰化水平增加并显示出显著的活性降低。
为了引起P53乳酰化的蛋白质,作者进行了全基因组CRISPR筛查。结果显示,Alanyl-tRNA synthttase 1(AARS1)是差异最为显著的基因。进一步实验表明,AARS1缺失提高了P53的表达,并对乳酸诱导的抑制的反应变得不敏感。此外,缺失AARS1的肿瘤细胞增殖、集落形成和移植瘤生长显著减少。接下来,作者使用蛋白质组学方法分析了细胞整体的乳酰化蛋白组,发现AARS1敲低后,乳酸诱导的蛋白乳酰化被抑制。
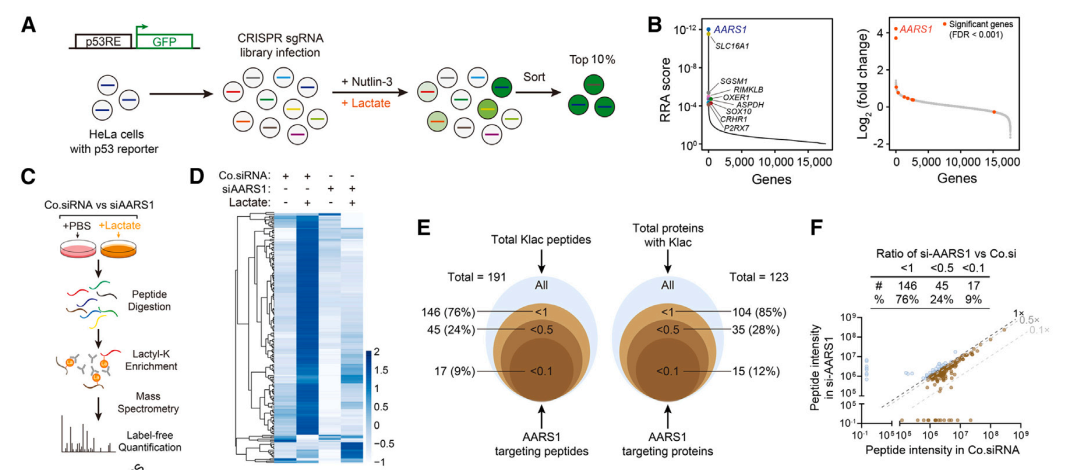 A,B:全基因组Crispr筛查发现AARS1
A,B:全基因组Crispr筛查发现AARS1
C-F:AARS1敲除降低蛋白组乳酰化水平
| 货号 | 名称 | 规格 |
| 9286S | Phospho-p53 (Ser15) (16G8) Mouse mAb | 100ul |
| 2524S | p53 (1C12) Mouse mAb | 100ul |
| abs60174 | Cas9 mRNA | 100ug |
2、AARS1促进乳酰化是ATP依赖行为
为了确定AARS1和乳酸的结合位点,作者首先dock乳酸分子到AARS的晶体结构中,发现 AARS1中的几个保守残基(M46, R77, N216和D239)与乳酸形成直接接触。为了验证AARS1是否直接催化乳酰化,作者用细胞裂解液孵育纯化的AARS,发现只有在反应中同时存在乳酸和ATP后,AARS1才能增强细胞裂解物中整体乳酰化。
在转染AARS1并经乳酸钠刺激的细胞中,通过分析细胞的乳酰化蛋白组,作者发现p53在赖氨酸120 (K120)和赖氨酸139(K139)位点发生乳酰化。使用抗体识别K120-或K139 -乳酰化p53,作者证实了内源性p53中在这些氨基酸上发生了乳酰化。结合这些结果和结构分析,作者推断出AARS1的作用机制:AARS1是一种进化上保守的酶,以ATP依赖的方式将lactate转化成lactate-AMP,AARS1会将乳酰基共价转移到目标蛋白的赖氨酸残基上形成乳酰化修饰。
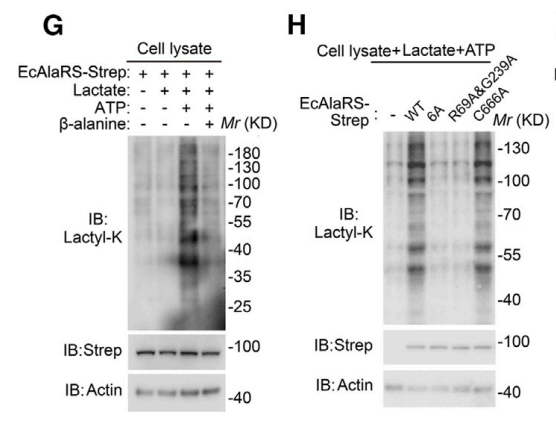 G,H:AARS1在乳酸和ATP同时存在的情况下,催化蛋白的乳酰化修饰
G,H:AARS1在乳酸和ATP同时存在的情况下,催化蛋白的乳酰化修饰
| 货号 | 名称 | 规格 |
| 29401317 | StrepTrap XT 1 x 1mL | 1×1ml |
| 28990944 | Superdex 200 Increase 10/300 GL | EA |
| A303-473A-T | Rabbit anti-AARS Antibody, Affinity Purified | 2ug |
| LS-G74382-20 | Human AARS Protein | 20ug |
3、P53乳酰化降低了P53的肿瘤抑制作用
作者接着研究,K120和K139乳酰化修饰如何抑制P53的活性。为了产生位点特异性的乳酰化蛋白,作者开发了一种遗传密码扩展策略。结果表明,p53乳酰化修饰降低了其结合DNA的能力和转录活性,以及阻止p53液液相分离(LLPS),从而影响了p53功能。体外实验也表明,Flag-p53Lac蛋白不能结合p53RE-DNA,在驱动p53应答报告基因和靶基因的表达方面效率低下。动物实验也表明,乳酰化后的p53更具有致瘤性。
接下来,作者研究AARS1是否与肿瘤发展和预后相关。结果表明,AARS1表达在许多肿瘤类型中表达升高,并与患者的低生存率相关。AARS1的增加,抑制了p53在体外和细胞内的活性。AARS1敲低的小鼠比野生型小鼠更晚发生肿瘤,并表现出原发性肿瘤负担减轻。此外,使用病人的肿瘤组织进行免疫组化实验也表明,AARS1以及蛋白质组(lactyl-K)和p53的乳酸化(lactyl-p53 K120)在恶性肿瘤中均显著上调。β-丙氨酸可以抑制p53的乳酰化依赖性失活,提示其治疗潜力。
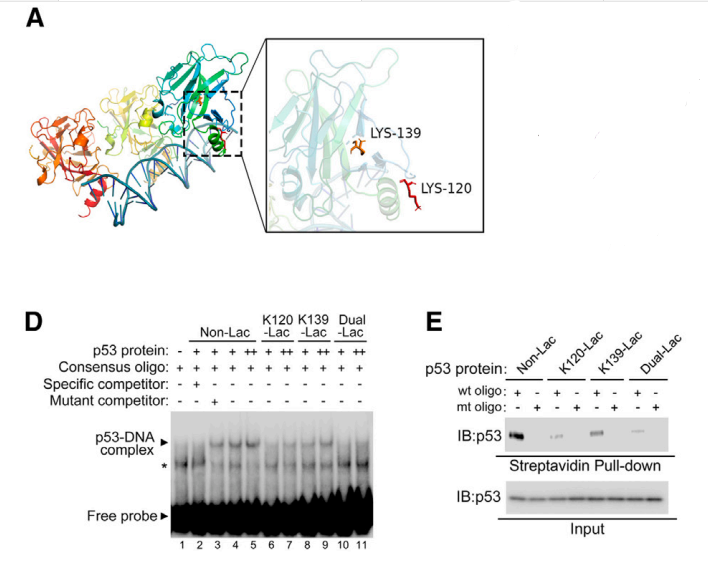 A. P53发生乳酰化修饰位点
A. P53发生乳酰化修饰位点
D,E:P53乳酰化后与DNA结合降低
| 货号 | 名称 | 规格 |
| abs812182 | Nutlin-3 | 5mg |
| 37543S | p21 Waf1/Cip1 (E2R7A) Rabbit mAb | 100ul |
| 4976S | Puma Antibody | 100ul |
| 86934S | MDM2 (D1V2Z) Rabbit mAb | 100ul |
| abs44102884 | β-丙氨酸 | 100mg |
第三篇:Gut symbionts alleviate MASH through a secondary bile acid biosynthetic pathway
2024年4月22日,北京大学医学部基础医学院/北京大学第三医院医学创新研究院姜长涛教授团队、北京大学第三医院乔杰院士团队、北京大学第三医院庞艳莉团队、温州医科大学附属第一医院郑明华团队以及北京大学医学部药学院贾彦兴团队合作,在Cell杂志在线发表了题为Gut symbionts alleviate MASH through a secondary bile acid biosynthetic pathway的研究文章,发现肠道菌群对胆汁酸的全新修饰类型—3-酰基化修饰,挖掘出3-sucCA的合成酶“BAS-suc”并深入解析了3-sucCA对MASH进程的改善作用与分子机制。
文章链接:https://doi.org/10.1016/j.cell.2024.03.034
文章主要内容:肠道微生物群已被发现在代谢功能障碍相关脂肪性肝炎(MASH)的进展中发挥重要作用,但其机制尚未确定。在本篇文章中,作者通过开发一种基于点击化学的富集策略,确定了几种微生物衍生的胆汁酸,包括以前未被表征的3-琥珀酰化胆酸(3-sucCA),它与肝组织活检证实的代谢功能障碍相关脂肪肝患者的肝损伤(MAFLD)呈负相关。通过筛选人类细菌分离株,作者鉴定出单形拟杆菌是3-sucCA的有效生产者。通过基于活性的蛋白纯化和鉴定,作者鉴定出了一种在单形拟杆菌被注释为β-内酰胺酶的蛋白负责3-sucCA的生物合成,将其命名为BAS-suc。此外作者发现3- sucCA可以通过促进嗜粘蛋白阿克曼氏菌的生长来缓解MASH。本研究为肠道微生物-肝脏轴提供了新的见解,并为MASH的缓解提供新方案。
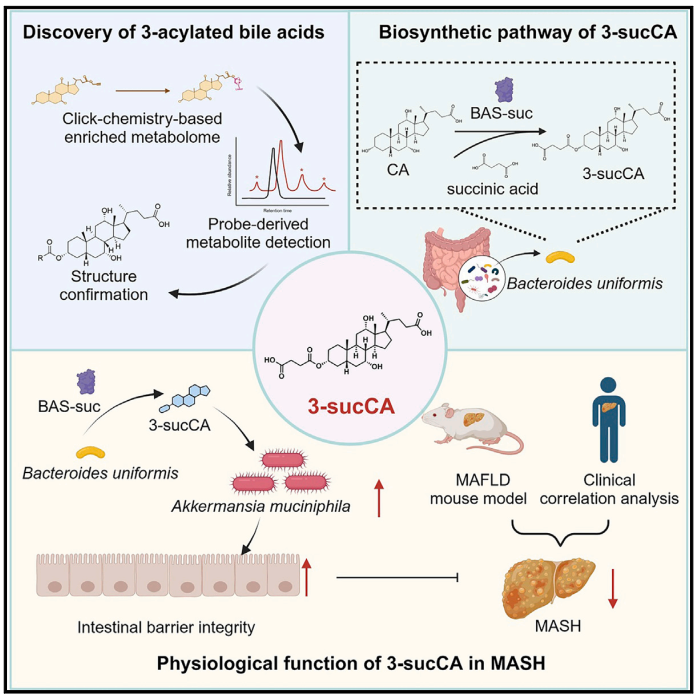
文章研究思路:
1、3-酰基化胆汁酸(3-sucCA)的发现
首先,作者使用基于点击化学的富集策略(click-chemistrybased enrichment strategy)来研究胆汁酸的微生物代谢。通过一维和二维核磁共振(NMR)测定,作者得到了5个酰化的胆汁酸,通过化学合成比对,发现这些胆汁酸的酰化反应都发生在3-羟基上。作者用x射线单晶衍射验证了3-sucCA的立体结构。随后,作者在菌群、小鼠、人群三个维度系统地检测了新型胆汁酸的丰度及流行率,发现这些酰基化胆汁酸广泛存在。
接下来,作者验证3-sucCA和代谢功能障碍相关的脂肪肝疾病(MAFLD)之间的关系。作者找到了55例MAFLD患者,采集其粪便和血清样品并测定3-sucCA水平和生化指标。与对照组比较,MAFLD患者的3-sucCA水平较低。
为了确定3- sucCA主要的肠道菌来源,作者收集了23名志愿者中3- sucCA水平最高的3名健康志愿者的新鲜粪便样本进行分析,作者挑出了315种菌株并通过16S rRNA基因测序。其中有42株在孵育48 h后,将CA转化为3-sucCA,其中所有的单形拟杆菌(Bacteroides uniformis,BU)都显示出了很高的3-sucCA产生活性。
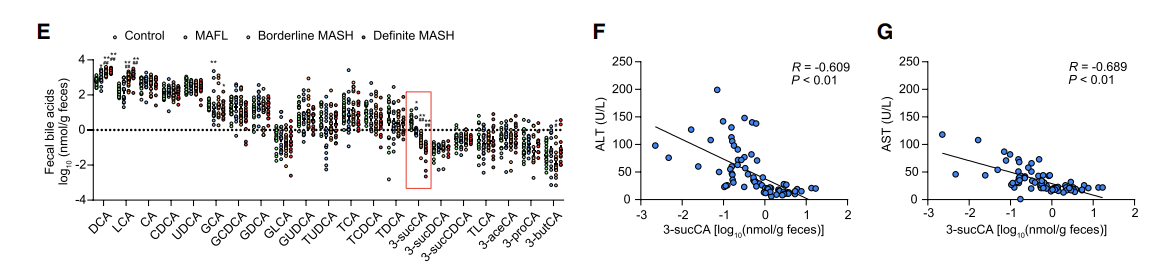 E-G:3-sucCA水平与MAFLD严重程度呈负相关
E-G:3-sucCA水平与MAFLD严重程度呈负相关
2、3-sucCA的合成酶BAS-suc的鉴定
接下来,作者继续寻找3- sucCA的生物合成途径。结构分析表明,3-sucCA可能通过酰基转移酶合成。作者通过基于活性的蛋白纯化来鉴定潜在的3-sucCA合成酶。然后通过质谱分析找到了118个蛋白。通过对这些蛋白过表达,最后找到了一种β-内酰胺酶的蛋白可以使大肠杆菌获得产生3- sucCA的能力,并命名为BAS-suc。利用CRISPR-Cas技术也证实了该酶负责3- sucCA的生物合成。
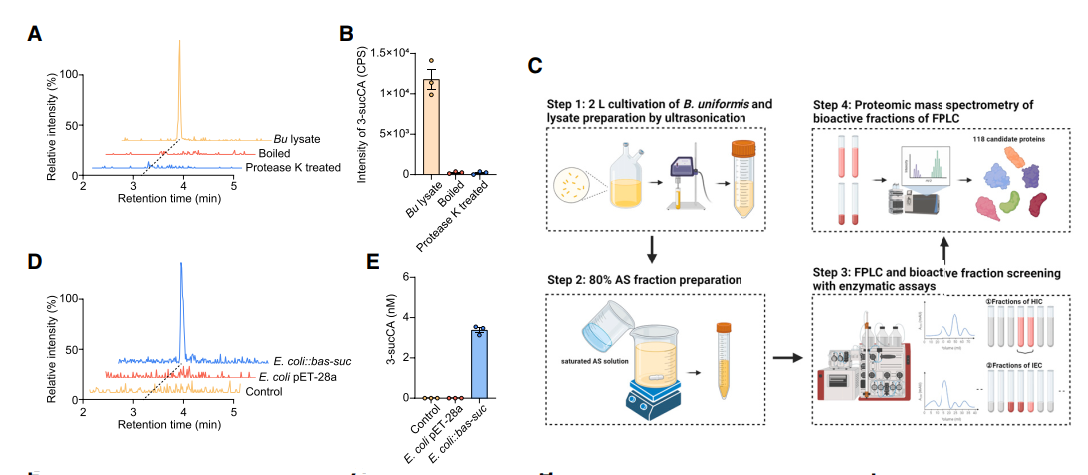 A,B:单形拟杆菌通过酶促反应生成3- sucCA
A,B:单形拟杆菌通过酶促反应生成3- sucCA
C-E:通过基于活性的蛋白纯化发现BAS-suc
| 货号 | 名称 | 规格 |
| 29051325 | HITRAP Q HP, 1 X 1 ML | 1 X 1 ML |
| 29219757 | Superdex 30 Increase 10/300 GL | EA |
| abs60174 | Cas9 mRNA | 100ug |
| sc-400014 | CRISPR/Cas9 KO Plasmid (h) | 20ug |
3、3-sucCA和BU对MASH具有改善作用
在发现负责3-sucCA的酶后,作者下一步探索3-sucCA是否可以缓解小鼠模型中的MAFL - MASH进程。CDAA-HFD诱导的MASH动物模型实验表明,3-sucCA治疗缓解了MASH的进程,并且改善肝脂肪变性、炎症和纤维化。
为了探索3-sucCA生成在MAFL-MASH进展中的有益作用,作者在CDAA - HFD喂养的小鼠中进行了B. uniformis (BU)治疗。结果表明,BU可以以一种BAS-suc依赖的方式来缓解MAFL - MASH进程。并且,MAFLD患者样本中BU含量较低,并且随着疾病严重程度的增加,BU逐渐消失,提示BU具有3-sucCA合成活性,可以作为预防MASH的潜在益生菌。
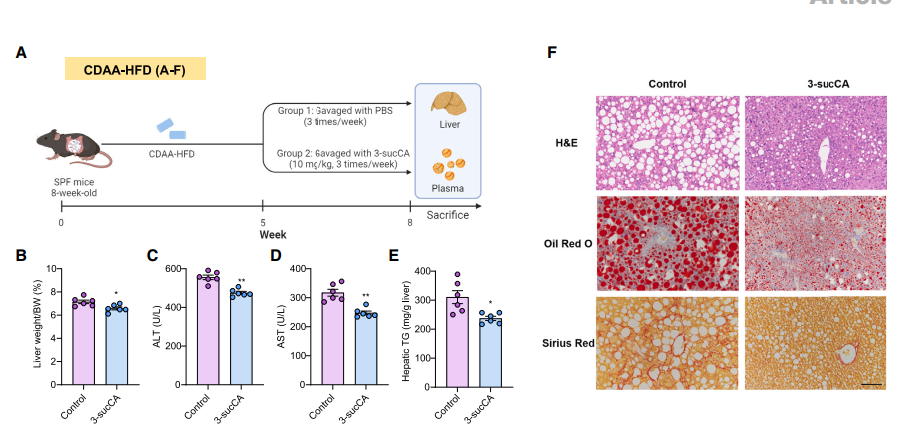 A-F:3-sucCA缓解MAFL - MASH进程
A-F:3-sucCA缓解MAFL - MASH进程
| 货号 | 名称 | 规格 |
| abs580002 | Alanine Transaminase(ALT) Microplate Assay Kit | 96T |
| abs580004 | Aspartate Transaminase(AST) Microplate Assay Kit | 96T |
| abs580085 | Triglyceride(TG) Microplate Assay Kit | 96T |
| abs42024259 | 油红 | 25g |
PTMScan®技术——助力翻译后修饰研究
PTMScan®技术为Cell Signaling Technology (CST)的专利技术,基于质谱分析的蛋白质组学,利用基序抗体对已修饰的肽段进行富集。这一专利蛋白质组实验方法可在进行液相色谱串联质谱(LC-MS/MS)分析之前,使用由CST开发且经验证的PTM抗体和基序特异性抗体来富集含PTM的肽段。使用PTMScan技术可识别并量化成百上千个即使丰度很低的PTM位点,然后可将这些位点精选至最相关的可行性靶标上。相较于固相金属亲和层析(IMAC)等其他策略,PTMScan技术使用了更集中式的PTM肽段富集法,更灵敏、特异和便捷。使用新款的PTMScan HS试剂盒可以用于高效率的进行泛素化,磷酸化,甲基化,酰化,SUMO化等翻译后修饰研究和分析。
PTMScan® HS试剂盒的优势有:
① 所需样品更少:与传统试剂盒相比,消化高效,免疫捕获灵敏度高,使降低对样本量的要求成为可能;
② PTM肽更纯净:经优化的捕获和洗涤方法确保仅洗脱高度富集的PTM肽,而不存在抗体污染;
③ 适合自动化:使用磁珠富集样品,适用于主流的自动化平台,使PTMScan HS试剂盒成为PTM样品自动化制备的理想选择;
④ 方法学可靠:数以百计的文献充分说明PTMScan免疫富集技术的实用性和稳定性。
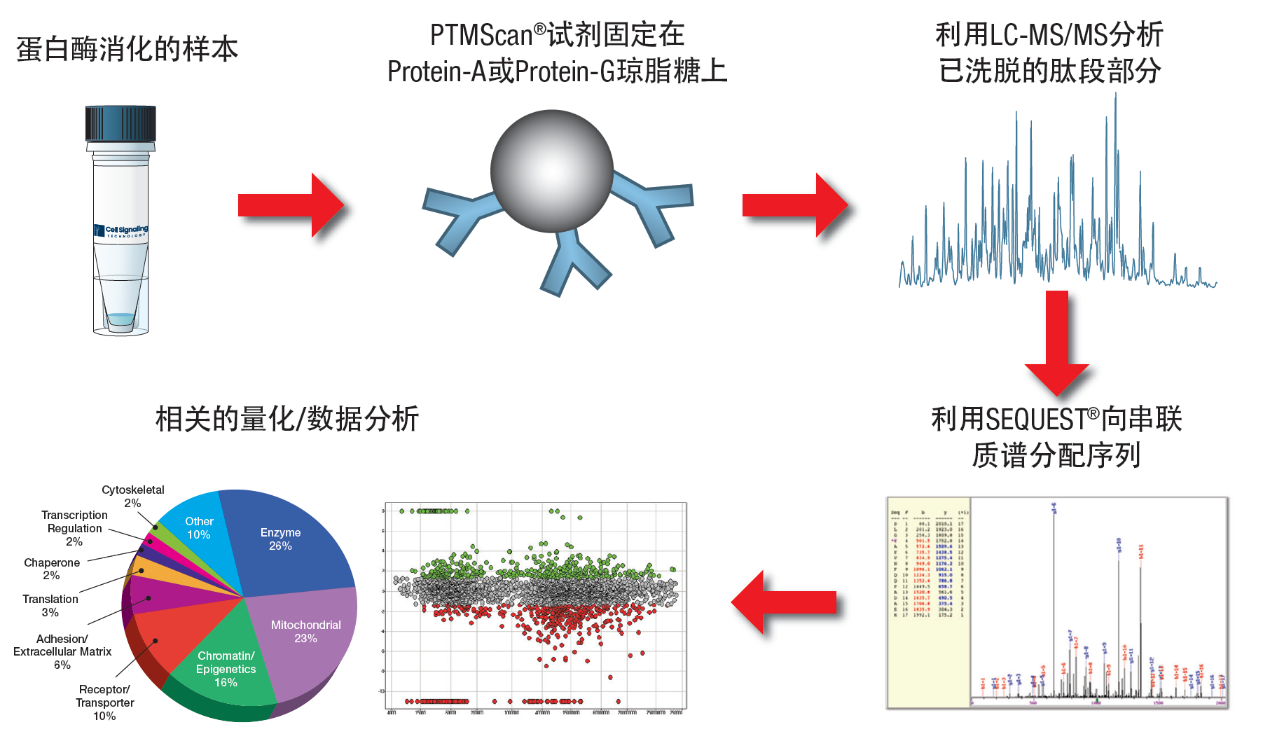 PTMScan工作流程(来源于CST手册)
PTMScan工作流程(来源于CST手册)
部分热卖产品
| 货号 | 品名 | 应用 |
| 38572 | PTMScan ® HS Phospho-Tyrosine (P-Tyr-1000) Kit | 磷酸化检测试剂盒 |
| 59322 | PTMScan ® HS Ubiquitin/SUMO Remnant Motif (K-epsilon-GG) Kit | 泛素化、SUMO化检测试剂盒 |
| 46784 | PTMScan ® HS Acetyl-Lysine Motif (Ac-K) Kit | 乙酰化检测试剂盒 |
| 28411 | PTMScan ® HS Pan-Methyl Lysine Kit | 甲基化检测试剂盒 |
| 60724 | PTMScan ® HS Succinyl-Lysine Motif (Succ-K) Kit | 琥珀酰化检测试剂盒 |










 危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)
危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)  营业执照(三证合一)
营业执照(三证合一)