体内药物递送一直都是医药研发无法避开的话题,药物递送不仅仅是将药物送到作用部位这么简单,其承载着四大核心功能:药物靶向、药物控释、促进药物吸收、增强药物属性。药物递送是否恰当往往也决定了药物研发是否成功。
如今,靶向药物递送的载体也层出不穷(图1),脂质纳米颗粒、金属纳米颗粒、二氧化硅纳米颗粒、外泌体……今天小优就和大家好好聊聊体内药物递送的那些事。
 图1靶向药物递送载体[1]
图1靶向药物递送载体[1]
一、脂质纳米颗粒
脂质纳米颗粒(Lipid nanoparticles , LNPs)是由一个或多个磷脂双层组成的球形囊泡,其应用前景十分广泛:疫苗、蛋白质替代疗法、肿瘤免疫疗法、CRISPR-Cas基因编辑。2020年时,美国食品药品监督管理局 (FDA) 全面批准了两种由LNPs支持的针对COVID-19的mRNA疫苗(BNT162b2和mRNA-1273)[2]。LNPs具有很多优势,比如核酸包封率高并且能够有效转染细胞,组织穿透性强,细胞毒性和免疫原性低,更有利于递送药物等。LNPs用于药物递送的流程可分为LNP制备-有效载荷传递-免疫原性和毒性监测-药物递送效率优化-临床前和临床研究。
01 LNP制备
材料选择:选择合适的脂质材料以形成稳定的纳米粒子。
LNP由可电离阳离子脂质、辅助脂质、甾醇脂质和PEG化脂质的脂质混合物组成。可电离阳离子脂质是核酸有效载荷封装和LNP效能的主要驱动力,但它们也与LNP的耐受性、免疫原性和细胞毒性交织在一起,中性辅助磷脂一般为饱和磷脂,可提高阳离子脂质体的相变温度,支持层状脂质双层结构的形成并稳定其结构排列;胆固醇有较强的膜融合性,促进mRNA胞内摄入和胞质进入;PEG化磷脂位于脂质纳米粒表面,改善其亲水性,避免被免疫系统快速清除,防止颗粒聚集,增加稳定性[3]。
 图2 FDA批准的LNPs药物中的脂质摩尔比(*Ionizable cationic lipid : neutral phospholipid : cholesterol : PEGylated lipid)
图2 FDA批准的LNPs药物中的脂质摩尔比(*Ionizable cationic lipid : neutral phospholipid : cholesterol : PEGylated lipid)
配制:将脂质材料溶解在有机溶剂中,与药物混合,然后通过纳米沉淀、薄膜再水化或高压均质化等方法制备LNP。
LNPs的制备可利用一整套独立包装的试剂将mRNA或siRNA包装到LNPs中,无需专用设备。
 图2 LNP-102 Exploration Kit(35425)制备LNP示意图
图2 LNP-102 Exploration Kit(35425)制备LNP示意图
表征:对制备的LNP进行粒径、表面电荷、包封效率和稳定性等特性的表征。
文中部分相关产品:
| 类别 | 产品名称 | 货号 |
| 阳离子脂质 | DLin-MC3-DMA | 34364 |
| D-Lin-MC3-DMA | abs820381 | |
| SM-102 | 33474 | |
| SM-102 | abs819850 | |
| 聚乙二醇脂类 | DMG-PEG (2000) | 33945 |
| ALC-0159 | 34336 | |
| 中性磷脂 | 1,2-DMPC | 15097 |
| 1,2-DSPC | 15100 | |
| 胆固醇 | Cholesterol | 9003100 |
| Cholesterol | abs816876 | |
| 2,3-Oxidosqualene | 36187 | |
| 成品工具mRNA | EGFP mRNA | abs60176 |
| mcherry mRNA | abs60180 | |
| Fluc mRNA | abs60178 | |
| EZ Cap™ mCherry mRNA (5mCTP, ψUTP) | 39799 | |
| EZ Cap™ EGFP mRNA (mo5U) | 39800 | |
| LipidLaunch™ SM-102 LNP (Luciferase) | 39318 | |
| LNP探索试剂盒 | LNP-102 Exploration Kit | 35425 |
| LNP-0315 Exploration Kit | 35426 | |
| LNP-MC3 Exploration Kit | 36970 |
02有效载荷传递
细胞摄取:LNP通过内吞作用等机制被细胞摄取。将LNPs添加到细胞中,基于甾醇的荧光示踪剂可观察LNP的摄取情况。
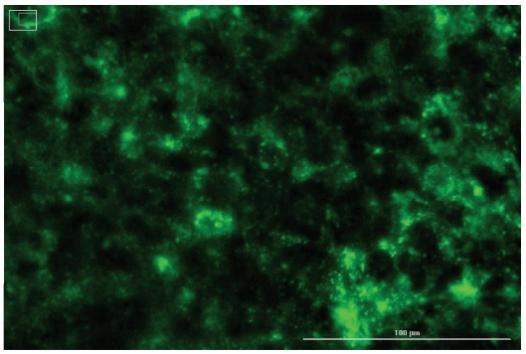 图4 肝细胞对LNP-102的摄取(LNPs中的BODIpY-胆固醇会发出绿色荧光)
图4 肝细胞对LNP-102的摄取(LNPs中的BODIpY-胆固醇会发出绿色荧光)
内体逃逸:内化后的mRNA-LNPs沿内体途径行进:其内部PH值逐渐降低,阳离子脂质发生质子化,并与内体膜相互作用,从而导致LNPs的破裂,在被溶酶体降解之前,有效载荷mRNA被释放出来,这一过程被称为内体逃逸。可使用标记LNP和内体/溶酶体特定标志物的染料或者荧光探针来监测内体逃逸。
药物释放:有效载荷在细胞质中释放,如siRNA或mRNA,进而发挥其基因沉默或蛋白表达的功能。
文中部分相关产品:
| 类别 | 产品名称 | 货号 |
| LNP摄取试剂盒 | LNP-102 Uptake Kit (Green Fluorescence) | 38218 |
| LNP-0315 Uptake Kit (Green Fluorescence) | 38219 | |
| 内体逃逸监测 | Calcein | 16221 |
| Calcein blue, AM | abs45153764 | |
| Cy5 (triethylamine salt) | 30752 | |
| Cy5 Azide | abs47038468 | |
| LysoBrite™ Blue | 25152 | |
| 溶酶体绿色荧光探针(FluoLyso Green) | abs47038870 |
03免疫原性和毒性监测:
体外评估:在细胞模型中评估LNP的免疫原性和毒性,包括细胞活力测试、炎症因子释放等。
体内评估:在动物模型中监测LNP的免疫反应,如通过观察注射部位的炎症反应、全身性免疫激活等。
安全性研究:进行长期毒性研究和免疫原性评价,以确保LNP递药系统的安全性。
文中部分相关产品:
| 类别 | 产品名称 | 货号 |
| 免疫原性监测 | Interleukin-1α (human) ELISA Kit | 583301 |
| Interleukin-1β (human) ELISA Kit | 583311 | |
| Interleukin-6 (human) ELISA Kit | 501030 | |
| Interleukin-6 (mouse) ELISA Kit | 583371 | |
| Mouse IgG ELISA Kit | 501240 | |
| Human IL-1α ELISA Kit | abs551001 | |
| Human IL-1β ELISA Kit | abs510002 | |
| Human IL-6 ELISA Kit | abs510003 | |
| Mouse IL-6 ELISA Kit | abs520004 | |
| Mouse IgG ELISA Kit | abs551115 | |
| 毒性监测 | LDH Cytotoxicity Assay Kit | 601170 |
| Aspartate Aminotransferase Colorimetric Activity Assay Kit | 701640 | |
| Alanine Transaminase Colorimetric Activity Assay Kit | 700260 | |
| 乳酸脱氢酶(LDH)活性检测试剂盒(微量法) | abs580236 | |
| Aspartate Transaminase Microplate Assay Kit | abs580004 | |
| Alanine Transaminase Microplate Assay Kit | abs580002 |
04药物递送效率优化:
靶向性:通过表面修饰或使用靶向配体提高LNP的靶向性,以增强药物在特定组织或细胞中的积累。
循环稳定性:优化LNP的配方和表面特性,提高其在血液循环中的稳定性,延长循环时间。
05临床前和临床研究:
药效学研究:在动物模型中评估LNP药物递送系统的有效性。
剂量优化:确定最佳的给药剂量和频率。
临床试验:在临床试验中进一步验证LNP药物递送系统的安全性和有效性。
二、金属纳米颗粒
金属纳米颗粒Gold nanoparticles (AuNPs) 由于其高比表面积、稳定性、相对无害性,作为药物载体也备受关注,可用来输送各种治疗剂(抗体、核酸、化疗药物、肽等)[4]。AuNP的现有形式可分为纯金属、氧化物和硫族化合物,并且可以通过静脉(主动或被动靶向)递送到肿瘤区域。例如,AuNP可以通过金-硫醇化学负载siRNA,将以siRNA为治疗剂的AuNPs和精氨酸甘氨酰天冬氨酸(RGD)肽功能化,可以靶向治疗肺癌[5]。此外,负载靶向表皮生长因子受体(EGFR)的单链可变片段转铁蛋白和靶向前列腺特异性膜的适配子的AuNPs,也具备靶向癌细胞的能力[6-8]。同为纳米颗粒药物递送体系,AuNP用于药物递送的流程与LNP的流程类似,这里不再赘述。
文中部分相关产品:
| 产品名称 | 货号 |
| 10nm球形金纳米颗粒 | AUCN10 |
| 200nm磁性金纳米壳 | MSXR200 |
三、介孔二氧化硅纳米颗粒
介孔二氧化硅纳米颗粒Mesoporous silica nanoparticles (MSNs) 具有介孔均匀、易功能化、生物相容性、高比表面积、大孔容和生物降解性,同时独特的光、电、磁性质赋予其成像显影、靶向输送的潜力,因此在无机纳米载体中也是十分常用的载体,用于输送化学药物、蛋白质、DNA等 [9-10]。介孔二氧化硅的硅醇基可与药物分子形成氢键,提高药物粉末的润湿性和分散性,使其从晶态转变为非晶态,与晶态相比,非晶态具有更高的自由能和更大的分子迁移率,且介孔内的空间位阻可以减缓或阻止非晶态药物的再结晶,从而改善药物的溶解度和提高药物的溶出速率[11-12]。同为纳米颗粒药物递送体系,MSN用于药物递送的流程与LNP的流程类似,这里不再赘述。
文中部分相关产品
| 产品名称 | 货号 |
| 20nm球形二氧化硅纳米颗粒 | SISN20 |
| 100nm球形介孔二氧化硅纳米颗粒 | SHSN100 |
四、外泌体
外泌体(Exosome)是一种由细胞分泌的小型脂质囊泡,直径通常在40-100nm之间,它们包含复杂的RNA和蛋白质,可以在细胞间进行交流。它们已被用作诊断生物标志物和潜在的药物递送载体。
天然外泌体用于药物递送的流程可简单分为外泌体纯化-药物装载-体外体内靶向效率验证。不仅如此,还可以通过各种工程策略构建工程外泌体来弥补天然外泌体的不足,以提高药物递送效率、增强对组织和器官的靶向性、延长循环半衰期外泌体。
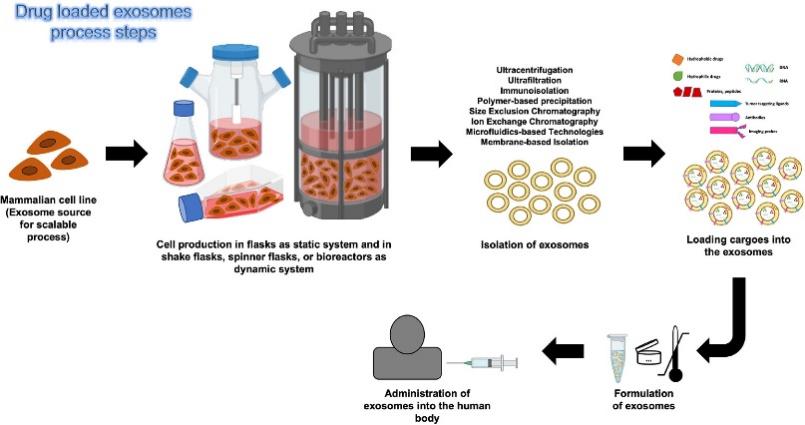 图5 外泌体装载药物流程[13]
图5 外泌体装载药物流程[13]
01外泌体纯化
外泌体的纯化方法非常多,小优也给大家总结了外泌体各种纯化方法原理、优点和不足(图6)。
| 外泌体纯化方法 | 原理 | 优点 | 缺点 |
| 聚合物沉淀法 | 聚合物竞争性结合游离水分子,使外泌体析出,再通过低速离心进行分离 | 对分离的外泌体影响小,pH中性,操作便捷,回收率高 | 纯度低,杂蛋白较多 |
| 尺寸排阻色谱法 | 基于半径的大小进行分离 | 分离到的外泌体大小均一 | 可能会损坏外泌体的膜;耗时,不适合大量样品 |
| 超滤膜法 | 根据微粒的相对分子量进行滤膜的分离 | 步骤简单、快速 | 回收率低;过滤的压力和切力可能使外泌体变形受损 |
| 免疫分离法 | 通过抗体特异性结合外泌体表面蛋白标记物来进行分离 | 高纯度、高特异性;不影响外泌体形态完整 | 不适于大量样品;回收率低 |
| 蔗糖密度梯度离心法/差速离心法 | 根据微粒大小、密度的差异进行分离 | 对外泌体的损伤小 | 需超速离心机;对离心条件敏感;回收率低 |
| 亲和膜结合法 | 利用材料与外泌体膜亲和结合的方法进行分类 | 反应快速,纯度较高,杂蛋白少 | 不适用于大量样本,成本较高 |
图6 外泌体纯化方法汇总
文中部分相关产品:
| 类别 | 产品名称 | 货号 |
| 聚合物沉淀法 | ExoQuick-TC | EXOTC50A-1 |
| 尺寸排阻色谱法 | SmartSEC Single EV Isolation System | SSEC200A-1 |
| 膜亲和柱法 | exoEasy Maxi Kit | 76064 |
| 磁珠捕获法 | 外泌体提取试剂盒 | abs9775 |
02药物装载
内源性装载:将货物与亲本细胞共同孵育,货物进入亲本细胞,亲本细胞在产生外泌体的过程中将细胞内的货物装载到细胞内的多囊泡中,外泌体沿着管腔囊泡向下移动到细胞外囊泡[14]。
外源性装载:将货物封装到分离纯化的外泌体中,可分为被动封装和主动封装。被动封装方法之一是在合适的温度和pH下将药物与外泌体共孵育,使药物可以被动地通过膜扩散到外泌体中,该方法快速、简单,且不影响外泌体的完整性。主动封装利用机械技术暂时可逆地打开外泌体膜,使货物进入外泌体,常用方法如超声处理、电穿孔、冻融循环、共挤出和表面活性剂[14]。
装载药物的外泌体也可以进行追踪,标记外泌体膜、蛋白和RNA,实现外泌体递送系统的可视化。
文中部分相关产品:
| 类别 | 产品名称 | 货号 |
| 外泌体转染 | Exo-Fect Exosome Transfection Kit | EXFT10A-1 |
| Xpack CMV-XP-MCS-EF1α-Puro Cloning Lentivector | XPAK510PA-1 | |
| 细胞培养 | 外泌体专用无血清培养基 | abs9430-500mL |
| 活体DNA&si/miRNA转染试剂 | in vivo-jetPEI | 101000040 |
| 活体mRNA转染试剂 | in vivo-jetRNA+transfection reagent | 101000122 |
| 外泌体靶向 | XStamp cloning and expression lentivector | XSTP710PA-1 |
| 标记外泌体膜 | ExoGlow-Membrane EV Labling Kit | EXOGM600A-1 |
| 活体标记 | ExoGlow-Vivo EV Labling Kit (Near IR) | EXOGV900A-1 |
| 细胞示踪 | pCT-CD63-GFP | CYTO120-PA-1 |
| 外泌体检测 | ExoMS Total Protein Capture Kit | EXOMS120A-8 |
| 外泌体定量检测试剂盒 | abs50054-96T |
03体外体内靶向效率验证
体外验证:在细胞模型中评估外泌体药物递送系统的靶向效率,可标记外泌体膜、蛋白和RNA以实现可视化。
体内验证:在动物模型中监测外泌体的可视化,在靶细胞/器官的特异性富集情况。
参考文献:
[1] Smart drug delivery systems: Concepts and clinical applications
[2] Safety and Efficacy of the BNT162b2 mRNA Covid-19 Vaccine
[3] The role of lipid components in lipid nanoparticles for vaccines and gene therapy
[4] Review on metal nanoparticles as nanocarriers: current challenges and perspectives in drug delivery systems
[5] Design of multifunctional gold nanoparticles for in vitro and in vivo gene silencing
[6] In vivo tumor targeting and spectroscopic detection with surface-enhanced Raman nanoparticle tags
[7] Mechanism of active targeting in solid tumors with transferrin-containing gold nanoparticles
[8] A drug-loaded aptamer-gold nanoparticle bioconjugate for combined CT imaging and therapy of prostate cancer
[9] Functionalized mesoporous silica particles for application in drug delivery system
[10] Synthesis of mesoporous silica nanoparticles
[11] Incorporation of indomethacin nanoparticles into 3-D ordered macroporous silica for enhanced dissolution and reduced gastric irritancy
[12] Melting/freezing behavior of a fluid confined in porous glasses and MCM-41:dielectric spectroscopy and molecular simulation
[13] Exosomes: Large-scale production, isolation, drug loading efficiency, and biodistribution and uptake
[14] Research Advances of Engineered Exosomes as Drug Delivery Carrier










 危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)
危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)  营业执照(三证合一)
营业执照(三证合一)