抗体药物偶联物(ADC)是一种结合了单克隆抗体的靶向性和细胞毒性药物杀伤性的新型抗肿瘤药物。近年来,随着研究的深入,ADC在多个肿瘤治疗领域展现出了巨大的潜力和应用前景。2024年,ADC领域的热门靶点包括但不限于HER2、TROP-2、c-MET、Claudin18.2、Nectin-4等。
除了在肺癌治疗中的应用,ADC药物在乳腺癌、胃癌、尿路上皮癌等其他肿瘤类型中也显示出了治疗潜力。Nectin-4也是一个备受关注的新兴靶点,它们在尿路上皮癌、宫颈癌、食管癌等多种实体瘤中显示出了良好的疗效和安全性。
总体来看,ADC药物在多个肿瘤治疗领域展现出了广泛的应用前景,未来有望成为改变肿瘤治疗格局的重要药物类型。随着更多临床研究的开展和新靶点的发现,ADC药物的研发和应用将继续扩展,为患者提供更多的治疗选择。
ADC药物的作用机制主要包括以下几个步骤:
1、靶向性结合:ADC药物通过其抗体部分特异性地结合到肿瘤细胞表面的抗原分子。
2、内吞作用:抗体与抗原结合后,通过受体介导的内吞作用,ADC药物被吞入肿瘤细胞内。
3、药物释放:进入细胞内部后,ADC药物的细胞毒性药物在溶酶体中被释放。
4、细胞毒性作用:释放的细胞毒素通过抑制微管蛋白聚合或DNA拓扑异构酶等,干扰肿瘤细胞的分裂和增殖,最终导致肿瘤细胞的凋亡。
5、旁观者效应:部分ADC药物设计使其能在杀死靶细胞后,还能影响周围未被抗体直接结合的肿瘤细胞,扩大了治疗效果。
一、ADC热门靶点介绍:
1、HER3
HER3(人表皮生长因子受体3)是EGFR家族中的一员,它在肿瘤的发生发展中扮演着重要角色,尤其是在肿瘤的进展和耐药性发展中。HER3本身缺乏内在的酪氨酸激酶活性,但它可以通过与其他HER家族成员形成异源二聚体来激活下游信号通路,促进肿瘤细胞的增殖和存活。
在抗体药物偶联物(ADC)领域,HER3已成为一个重要的靶点。HER3-DXd(Patritumab Deruxtecan,U3-1402)是一种新型的HER3靶向ADC,由HER3单克隆抗体Patritumab和强活性载荷DXd偶联而成。它在HER3表达阳性的转移性乳腺癌中显示出了不错的抗肿瘤活性,客观缓解率(ORR)分别为43%、30%和23%。此外,HER3-DXd在早期乳腺癌的初步研究探索中也显示出了潜在的治疗价值,尤其是在HER2低表达乳腺癌中,HER3转录表达情况可能成为治疗的潜在标志物。
HER3-DXd的研究进展包括在乳腺癌、非小细胞肺癌(NSCLC)和其他实体瘤中的临床试验。例如,在HERTHENA-Lung02临床3期试验中,HER3-DXd用于治疗带有EGFR突变的局部晚期或转移性非小细胞肺癌(NSCLC)患者,这些患者曾接受过EGFR酪氨酸激酶抑制剂(TKI)治疗,试验达到了主要终点,显示出无进展生存期(PFS)的显著改善。
2、TROP-2
TROP-2(滋养层细胞表面抗原2)是一种在多种肿瘤组织中高表达的跨膜糖蛋白,其在肿瘤的发生、发展及转移中发挥重要作用,因此成为抗体药物偶联物(ADC)开发的热门靶点。TROP-2 ADC药物通过特异性结合肿瘤细胞表面的TROP-2抗原,将细胞毒性药物直接传递至肿瘤细胞内,实现精准杀伤。
目前,已有多种TROP-2 ADC药物在临床研究中显示出显著的抗肿瘤效果。例如,戈沙妥珠单抗(Sacituzumab Govitecan,SG)是一种已经获得美国FDA批准用于治疗三阴性乳腺癌(TNBC)的TROP-2 ADC药物。它由人源化抗TROP-2抗体hRS7与拓扑异构酶抑制剂SN-38结合而成,通过pH敏感的连接子在肿瘤细胞内释放SN-38,产生旁观者效应,杀伤周围癌细胞。在IMMU-132-01研究和ASCENT研究中,SG显示出对多线治疗失败的mTNBC患者良好的疗效与安全性,客观缓解率(ORR)和中位无进展生存期(PFS)均有显著提升。
3、Claudin18.2
Claudin18.2是一种紧密连接蛋白家族成员,在多种肿瘤中表达,尤其在胃癌、胰腺癌、食管癌等消化系统肿瘤中高表达,成为这些肿瘤治疗的重要靶点。针对Claudin18.2的抗体药物偶联物(ADC)在临床研究中显示出了积极的治疗效果。
在2024年欧洲肿瘤内科学会(ESMO)大会上,恒瑞医药的SHR-A1904作为Claudin18.2 ADC药物,其治疗胃/胃食管结合部癌(GC/GEJC)的I期研究被接收为口头报告。SHR-A1904的初步数据显示,该药物具有可控的安全性和良好的抗肿瘤活性,客观缓解率(ORR)和疾病控制率(DCR)分别达到55.6%和88.9%。
4、Nectin-4
Nectin-4(Poliovirus Receptor-Like 4, PVRL4)是一种在多种实体瘤中高度表达的细胞粘附分子,尤其在尿路上皮癌、乳腺癌、卵巢癌、胰腺癌、非小细胞肺癌、胃癌、肝细胞癌和膀胱癌中表达水平较高。Nectin-4的过表达与多种癌症的不良预后相关,因此成为抗体药物偶联物(ADC)开发的有吸引力的靶点。
目前,上市的Nectin-4 ADC药物是Padcev(Enfortumab Vedotin),由Seagen和安斯泰来联合开发。Padcev由靶向Nectin-4的单抗enfortumab与微管破坏剂MMAE通过可切割的二肽连接子连接而成。它在治疗尿路上皮癌方面显示出显著效果,但在其他类型的实体瘤中效果一般,且存在眼毒性、肺毒性及血液毒性等问题。
5、FRα
叶酸受体α(FRα)是一种在多种实体瘤中过表达的细胞表面糖蛋白,包括卵巢癌、肺癌和乳腺癌等。FRα在肿瘤中的异常表达以及介导大分子复合物内化的能力,使其成为抗体药物偶联物(ADC)开发的有吸引力的靶点。靶向FRα的ADC药物通过特异性结合肿瘤细胞表面的FRα,经过内化作用被转运至癌细胞体内,连接子裂解后释放出毒素小分子,造成癌细胞死亡。
目前,全球首款且唯一获批的FRα的ADC药物是ImmunoGen公司开发的Elahere(Mirvetuximab Soravtansine),它由抗FRα的人源化单克隆抗体与细胞毒性药物分子DM4通过二硫键偶联,属于靶向FRα的First-in-class ADC。Elahere的作用机制是与肿瘤细胞表面的FRα结合,并通过内吞效应进入到肿瘤细胞中,然后连接键断裂,释放抗微管药物DM4,继而杀伤肿瘤细胞。
6、EGFR
EGFR(表皮生长因子受体)是一种在多种肿瘤中过表达的靶点,尤其是在非小细胞肺癌(NSCLC)中。针对EGFR的ADC药物正在研发中,旨在提高治疗效果并减少对正常细胞的损害。
7、c-Met
c-Met(肝细胞生长因子受体)是一种在多种肿瘤中表达的受体酪氨酸激酶,其异常激活与肿瘤的发生、发展和预后密切相关。c-Met的激活可以通过多种机制,包括基因突变、扩增、蛋白过表达以及配体HGF(肝细胞生长因子)的过表达。在非小细胞肺癌(NSCLC)中,c-Met的异常激活尤为重要,它不仅是一个独立的肺癌驱动因子,也是EGFR靶向治疗耐药性的副驱动因子。
针对c-Met的ADC药物开发是当前研究的热点之一。ADC药物通过单克隆抗体将细胞毒性药物直接传递到肿瘤细胞,实现精准杀伤。艾伯维(AbbVie)的telisotuzumab vedotin(Teliso-V)是一种针对c-Met的ADC药物,它在治疗c-Met蛋白过表达、EGFR野生型的晚期/转移性非鳞状非小细胞肺癌(NSCLC)患者的2期LUMINOSITY试验中显示出积极的数据。这些数据支持了Teliso-V作为潜在的首创c-Met ADC新药在治疗NSCLC中的潜力。
二、ADC内化检测:
抗体药物偶联物(ADC)的内化检测是评估ADC药物有效性的重要步骤,因为它直接关系到药物能否成功将细胞毒性载荷传递到肿瘤细胞内部。内化过程涉及抗体与肿瘤细胞表面抗原结合后,通过受体介导的内吞作用进入细胞,形成内体,进而释放细胞毒性有效载荷。
内化检测常用方法包括:
1、基于毒素偶联的杀伤检测:通过将抗体与重组免疫毒素(如DT3C)偶联,利用抗体的内化能力将毒素带入细胞,通过检测细胞杀伤来评估抗体的内化效果。
DT3C作为一种重组蛋白,可以与抗体的Fc端高度亲和,当mAb-DT3C偶联物与细胞表面的抗原结合后,它们通过内吞作用被细胞内化。在细胞内,DT3C被弗林蛋白酶(furin protease)切割释放出具有毒性的白喉毒素催化结构域。这个催化结构域进入细胞质后,会导致延伸因子(EF)-2的ADP-核糖基化,抑制蛋白质翻译,最终导致细胞死亡。用于体外检测癌细胞对mAb的内化效率,是一种有效的工具。最终通过化学发光信号测定细胞内ATP含量,从而检测细胞活力或定量检测活细胞数目。
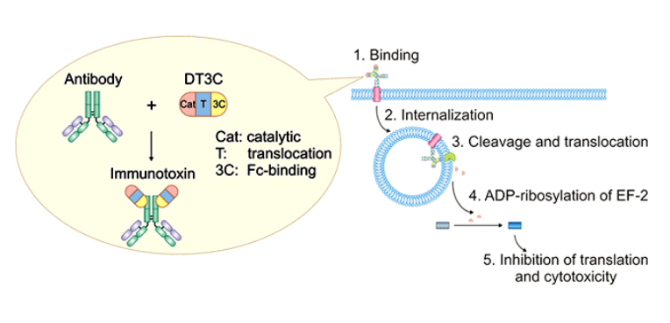 图:DT3C工作原理(图片来源于网络)
图:DT3C工作原理(图片来源于网络)
2、基于pH探针的内化检测:利用pH敏感的荧光探针标记抗体,当抗体被细胞内吞并进入酸性的内体或溶酶体时,荧光信号增强,从而可以评估内化效率。
这是一种新型荧光染料,当其周围环境pH值酸性增强时,它会显著增强荧光亮度。pH-sensitive lgG labeling reagents染料偶联物在细胞外不发出荧光,但在内化后在酸性pH环境下细胞中会发出明亮的绿色荧光。在中性和碱性pH值时,pH-sensitive lgG labeling染料发射荧光信号强度最低;随着酸化,pH-sensitive lgG labeling染料的发射荧光信号强度增加多达8倍(pH值为4时)。
3、基于活细胞成像的内化检测:基于活细胞成像的内化检测则提供了实时、动态的监测能力,有助于更全面地理解ADC的内化动力学。
4、基于细胞表面二抗追踪的内化检测:通过在不同温度下孵育待测抗体,使用二抗标记法追踪抗体内化水平,这种方法简便,但通常为终点式检测。
5、共聚焦显微镜细胞内定位:通过共聚焦显微镜定性追踪ADC内吞后在细胞内的定位,可以直观地观察ADC转运过程。
6、流式细胞术定量测定ADC内吞效率:通过比较37℃和4℃条件下细胞表面ADC的减少量,间接测定其内吞效率。
7、偶联细胞毒药物间接研究细胞内吞:通过将抗体与小分子细胞毒药物相连,评估抗体的内化能力和药物的释放效率。
三、药代动力学
抗体药物偶联物(ADC)是一种通过连接子将细胞毒性药物(Payload)连接到单克隆抗体上的靶向生物制剂,能够高效地将药物直接运输至目标肿瘤细胞中。在ADC中,Payload是关键组成部分之一,它决定了ADC的细胞毒性效果。
Payload的选择对于ADC的疗效和安全性至关重要。理想的Payload应具备高细胞毒性、低免疫原性、高稳定性和可修饰的功能基团。目前,ADC中的常用Payload主要包括微管蛋白抑制剂和DNA抑制剂,其中微管蛋白抑制剂如美登素类(MMAE、DM1、DM4)和PBD类,以及DNA抑制剂如喜树碱衍生物、卡奇霉素、多米卡星和吡咯并苯二氮卓类(PBDs)等。
在针对特定靶点如EGFR的ADC药物中,Payload的选择尤为关键。例如,针对EGFR的ADC药物可能会采用能够穿透细胞膜并在细胞内发挥毒性作用的Payload,以确保对肿瘤细胞的有效杀伤。
在临床研究和药物开发中,对Payload的抗药性(抗Payload)的研究也非常重要。抗Payload抗体可以用于ADC药物的药代动力学(PK)分析,帮助评估药物在体内的分布、代谢和排泄情况。例如,抗MMAE单克隆抗体可以用于检测MMAE Payload的PK特性,这对于理解ADC药物在体内的行为和优化治疗方案具有重要意义。
总的来说,ADC药物的研发涉及到对抗体、连接子、Payload以及其在体内的动态过程的深入理解。通过不断优化这些组成部分,可以提高ADC药物的疗效和安全性,为癌症治疗提供更多的治疗选择。
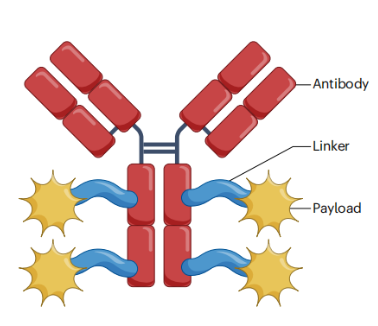 图:ADC结构示意图(图片来自于网络)
图:ADC结构示意图(图片来自于网络)
相关产品推荐:
| 靶点蛋白 | ||
| 品名 | 种属 | 品牌 |
| HER2 | Human/Mouse/Cynomolgus | STARTER |
| TROP2 | Human/Mouse/Cynomolgus | STARTER |
| HER3 | Human/Mouse/Rhesus macaque | STARTER |
| Nectin-4 | Human/Mouse/Rat | STARTER |
| DLL3 | Human | STARTER |
| ROR1 | Human/Mouse/Rat/Canine | STARTER |
| CD79B | Human | STARTER |
| B7-H3/CD276 | Human/Mouse/Cynomolgus | STARTER |
| EGFR | Human | STARTER |
| Met | Human | STARTER |
| FOLR1 | Human/Mouse | STARTER |
更多ADC靶点,请点击链接查看
| 跨膜蛋白定制服务 | |
| 技术平台 | Detergent/Nanodisc |
| 膜蛋白表达系统 | Pichia pastoris/Insect cells (sf9/High5)/Mammalian Cell(CHO.HEK293) |
| 常见跨膜蛋白 | G 蛋白偶联受体(GPCR)/水通道蛋白(AOP)/ATP 结合转运盒蛋白(ABC 转运蛋白)/HLA(人类白细胞抗原)等。 |
| ADC内化检测 | ||
| 品名 | 货号 | 品牌 |
| DT3C | UA070063 | STARTER |
| pH-sensitive IgG labeling reagents plus | UA070080 | STARTER |
| 细胞活力检测 | ||
| 品名 | 货号 | 品牌 |
| 2D Luminescent Cell Viability Assay | abs50065 | Absin |
| 抗Payload抗体 | ||
| 品名 | 货号 | 品牌 |
| Anti-DXD&Exatecan Antibody | S0B0710 | STARTER |
| Anti-DM-1&DM-4 Antibody | S0E0004 | STARTER |
| Anti-MMAE&MMAF Antibody | S0E0007 | STARTER |
| Anti-Eribulin Antibody | S0E0006 | STARTER |
| Anti-SN38 antibody | S0E0008 | STARTER |
『优宁维药物研发』自创立以来,一直秉持初心提供全面、专业的技术与产品信息。为大/小分子药物研发,细胞基因治疗,疫苗等领域提供早期研发、小试、中试,生产等相关试剂、耗材、服务。
国内外品牌众多:优爱蛋白,Bioauxilium,ThermoFisher,BioGenes,Astrea,AusGeneX,Carna,Genovis等。










 危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)
危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)  营业执照(三证合一)
营业执照(三证合一)