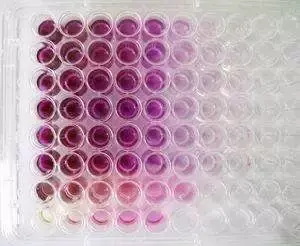

1.细胞准备阶段
首先,要将细胞培养至对数生长期。这个时期的细胞生长状态最为活跃,其生理特性稳定,对于后续实验结果的准确性至关重要。接着,使用胰蛋白酶对细胞进行消化处理,然后进行计数。之后,把细胞浓度调整到合适的范围,这个范围一般是每毫升几千到几万个细胞。比如,对于某些生长速度适中的细胞,可能调整到每毫升 5000 - 8000 个细胞;而对于生长较快或较慢的细胞,则需要根据其特性来确定具体浓度。

2.接种细胞环节
取适量已经准备好的细胞悬液,将其接种到 96 孔板之中。每孔的体积通常在 100 - 200 微升这个区间内。至于每孔的细胞数量,会依据实验设计而有所不同,大致在 1000 - 10000 个。这里要考虑到细胞类型的差异以及实验目的的不同,比如研究某种药物对快速增殖细胞的影响时,可能每孔接种 5000 - 8000 个细胞;若研究对生长缓慢细胞的作用,则可能每孔接种 2000 - 3000 个细胞。

3.孵育处理步骤
根据具体的实验设计,可能需要向 96 孔板的孔中添加不同种类的处理剂,这些处理剂包括药物、生长因子或者对照溶液等。添加完成后,把 96 孔板放置在二氧化碳培养箱中进行孵育。孵育时间根据实验要求而定,一般是从 24 小时到数天不等。在这个过程中,细胞会对所添加的处理剂产生相应的反应,为后续的检测提供条件。

4.加入 MTT 溶液操作
当孵育阶段结束后,向每个孔中添加一定量的 MTT 溶液,其常用浓度为每毫升 5 毫克。添加完成后,继续孵育几个小时,一般是 2 - 4 小时。在这个过程中,活细胞中的相关酶会发挥作用,将 MTT 还原为甲瓒。

5.终止反应与溶解甲瓒过程
把 96 孔板中的培养基移除,然后向每孔中加入二甲基亚砜(DMSO),其目的是溶解在之前步骤中形成的甲瓒结晶。加入 DMSO 后,要轻轻振荡 96 孔板,以此确保甲瓒能够充分溶解,为后续准确测量吸光度值做好准备。
6.读取吸光度步骤
使用酶标仪在 490 纳米或者 570 纳米的波长处对各个孔的吸光度值进行测量。这里要注意设置空白对照孔,空白对照孔是不含细胞但经过和其他孔相同处理的孔,它的作用是校正背景吸光度,从而提高测量结果的准确性。
7.数据分析阶段
根据标准曲线或者参照对照组的数据,计算出细胞的相对存活率或者增殖指数。吸光度值(OD 值)越高,就意味着细胞的活性越强或者细胞数量越多,这为评估细胞在不同处理条件下的状态提供了量化依据。

~~实验注意事项~~
| 细胞状态 | 用于实验的细胞必须处于良好状态,应避免使用有污染或老化的细胞。 |
| 细胞密度 | 细胞接种密度要合适,不同类型的细胞有不同的适宜密度范围。 |
| MTT 试剂 | MTT 试剂要妥善保存,通常需要在低温(一般 -20℃)、避光条件下保存,以防止其分解失效。 |
| DMSO(二甲基亚砜) | DMSO 用于溶解甲瓒结晶,其纯度要高,杂质可能会干扰吸光度的测量。 |
| 胰蛋白酶消化 | 在细胞准备阶段,使用胰蛋白酶消化细胞时,要控制好消化时间和温度。 |
| 孵育条件 | 孵育过程中,CO₂培养箱的温度、CO₂浓度和湿度要保持稳定。 |
| 吸光度测量 | 使用酶标仪测量吸光度时,要提前预热酶标仪,使其达到稳定的工作状态。 |
| 名称 | 货号 | 规格 |
| F17 MMT Cl | sc-223985 | 1g |
| MMT 40.1 | 多次使用研磨杯 | 0020003165 | EA |
| 5'-Amino-5'-deoxy-5'-N-MMT-thymidine 3'-CE phosphoramidite | 297903-1g | 1g |
| Fmoc-His(MMt)-OH | abs45158599-5g | 5g |










 危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)
危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)  营业执照(三证合一)
营业执照(三证合一)