人类相关标志物表现为:CD11c 呈强阳性,MHCII 呈强阳性,同时具备 CD141、XCR1、CLEC9A、IRF8 等特征;
小鼠的标志物则是:CD11c 呈强阳性,MHCII 呈强阳性;
就其驻留特性而言,具有 CD8a、CD24、CLEC9a、CD205、XCR1、ZBTB46 等标识;
而在迁移特性方面,其具有 CD103 这一典型特征。
cDC2的特征
cDC2 定位于外周组织以及淋巴器官之中,并且倾向于在 T - B 细胞区的交界地带聚集。类似于 cDC1,血液、淋巴器官、皮肤以及肺中的 cDC2 能够在体外促使初始 CD4 + T 细胞向 Th1 和 Th2 细胞发生极化。血液与肺中的 cDC2 可分泌 IL - 23,从而引发 Th17 免疫反应。血液、淋巴器官、肺以及皮肤的 cDC2 能够表达 Activin A 与 OX40 配体,是诱导 T 滤泡辅助细胞(Tfh)最为有效的因素。在血液和淋巴器官里,cDC2 在体外交叉呈递可溶性蛋白抗原并刺激细胞毒性 CD8 T 细胞分化的能力与 cDC1 相当。在细胞因子分泌方面,除了 IL - 23 和 Activin A 之外,还涵盖了 IL - 12p70。
最后,肠道中的 cDC2 呈现出高表达整合素 αvβ8 的特征,其生物可利用的 TGF - β 含量较高,在诱导 CD4 Treg 方面的效能优于 cDC1。
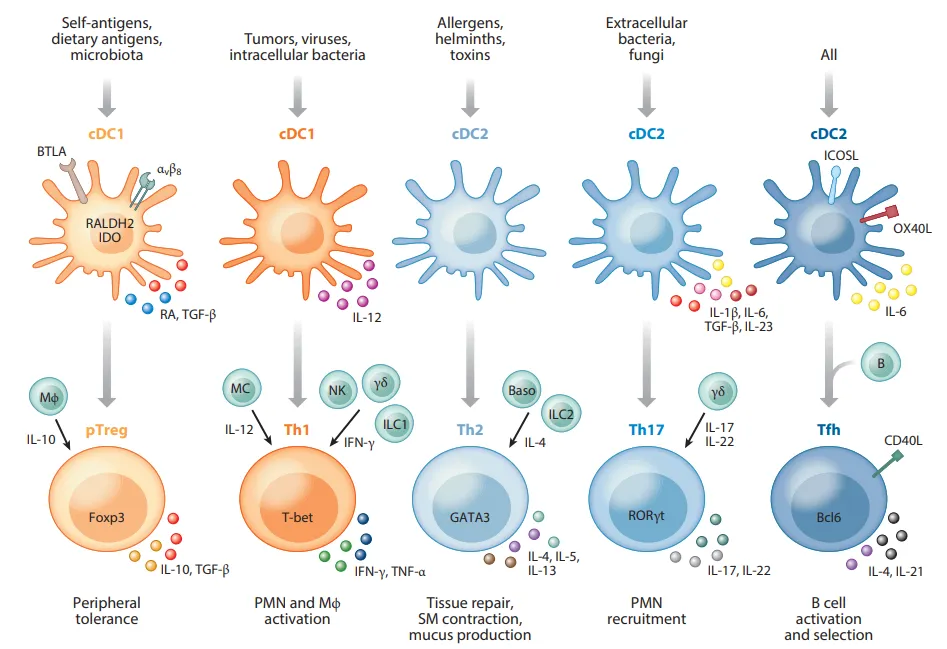
人类的相关标志物体现为:CD11c 呈强阳性,MHCII 呈强阳性,同时具有 CD1c、CD172a、CD11b、IRF4 等特征;
小鼠的标志物情况是:CD11c 呈强阳性,MHCII 呈强阳性;
在驻留方面的标志物为:CD4、CD11b、CD172a、ZBTB46;
而迁移方面则呈现为:cDC2a(具有 T - BET、ESAM 等特征),cDC2b(具备 CLEC12A、CLEC10A、Mgl2 等特征)。
DC3的特征
DC3 最初是借助 scRNA - seq 分析技术在血液样本中被鉴别出来的,其转录组及表型谱呈现出 cDC2 与单核细胞相混合的独特性质。其最为显著的特征标志物为 CD1c 与 CD163 的共同表达。目前已在骨髓、口咽癌组织、银屑病皮肤以及重症 COVID - 19 相关样本中发现了 DC3 的存在,不过淋巴器官与外周组织中 DC3 的分布状况仍需要更为深入且精确的表征分析。
在体外实验环境下,血液中的 DC3 能够高效地刺激初始 CD4 T 细胞,并且更倾向于诱导 Th17 或 Th1 细胞的极化反应。DC3 还具备刺激初始 CD8 T 细胞进行增殖以及促使其表达成熟标志物的能力。DC3 可促进组织归巢分子 CD103 在 CD8 T 细胞上的表达,并且在 I 型干扰素的作用环境下,能够高度表达共刺激分子 GITRL,这对组织驻留记忆 T 细胞的形成有着积极的推动作用。就细胞因子产生方面而言,DC3 既能像 cDC2 那样分泌 IL12p70 和 IL - 23,也能够如单核细胞一般大量分泌 IL - 1β。
pDC的特征
于稳态情形下,浆细胞样 DC(pDC)主要存在于淋巴器官内部,而在外周组织中则未被发现。pDC 最为典型的特征在于其被激活时能够产生 I 型干扰素。在稳态条件下,血液以及淋巴器官中的 pDC 对初始 CD4 + T 细胞的刺激效率相较于经典 DC(cDC)要低。pDC 可凭借细胞间接触方式识别遭受病毒感染的细胞,进而引发持久的干扰素反应。在体外实验环境里,血液与淋巴器官中的 pDC 能够交叉呈递可溶性、细胞相关或者病毒抗原,然而其刺激细胞毒性 CD8 T 细胞分化的能力相对较弱。pDC 还可以借助自身高表达的 ICOS 配体或者 IDO 来诱导 CD4 Treg 的产生。
人类 pDC 的标志物为:CD11c 呈阴性,MHCII 呈强阳性,同时具备 CD123、CD303、CD304、CD45RA 等特征;
小鼠 pDC 的标志物则是:CD11c 呈强阳性,MHCII 呈阳性;
其迁移相关的标志物包括:CD317、B220、Ly49Q、SiglecH、CCR9。
Mo-DC的特性
单核细胞来源的 DC(mo - DC)与单核细胞来源的巨噬细胞在众多表型标志物方面存在共性。不过,与巨噬细胞有所区别的是,mo - DC 具备 DC 细胞所特有的树突状外形,并且能够表达与 DC 相关的转录组学特征,其中涵盖如 IRF4 这样的典型转录因子。
mo - DC 存在于稳态状态下的腹膜、未发生病变的肠道以及肺部组织之中。处于稳态的皮肤里的 CD14 + DC 群体也被视作是由单核细胞衍生而来。
“炎症性” mo - DC 还能够在特应性皮炎与银屑病患者的皮肤、结核病患者的胸腔积液、癌症患者的腹膜腹水、类风湿性关节炎患者的滑液以及克罗恩病患者体内被发现。在乳腺癌、结直肠癌、肺癌以及黑色素瘤的引流淋巴结中,能够观测到具有 mo - DC 表型特征的细胞存在。
在体外实验条件下,源自临床样品的 mo - DC 能够有效地刺激初始 CD4 T 细胞进行增殖,并且更倾向于诱导 Th17 细胞或者 Th1 细胞的产生。来自皮肤、滑液以及腹膜腹水的 mo - DC 可以高效地诱导 T 滤泡辅助细胞(Tfh)发生极化。
腹膜 mo - DC 具备交叉呈递可溶性与颗粒抗原的能力,不过其采用的是依赖于溶酶体蛋白酶的非传统细胞内途径。mo - DC 同样能够有效地诱导效应细胞毒性 CD8 + T 细胞进行分化。与经典 DC2(cDC2)类似,mo - DC 已被证实专门用于分泌 IL - 23 和 IL - 12p70。
人类 mo - DC 的标志物表现为:CD11c 呈强阳性,MHCII 呈强阳性,同时具备 CD11b、CD209、CD206、CD64、F4/80、CD172a、CD14 等特征;
小鼠 mo - DC 的标志物则是:CD11c 呈强阳性,MHCII 呈强阳性,具有 CD11b、CD14、CD209、CD1a/b/c、CD206、IRF4 等标识。
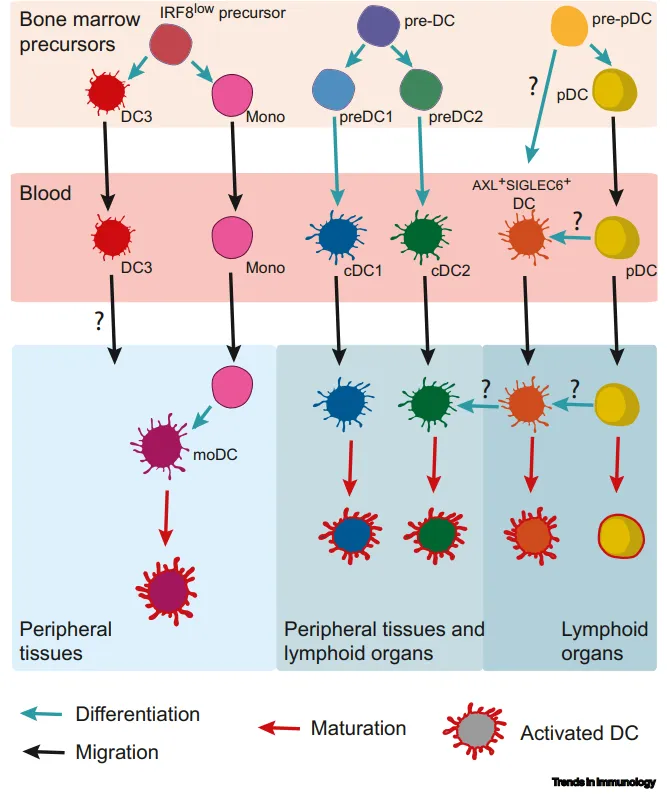
过渡AXL+SIGLEC6+DC的特征
借助 scRNA - seq 分析技术,于血液中鉴别出 AXL + SIGLEC6 + DC,其属于 CD123 + DC 的亚群类别。该类 DC 细胞存在于淋巴器官内部,然而在稳态条件下的外周组织中却未被发现,不过能够被招募至发生炎症的皮肤以及肺部区域。
AXL + SIGLEC6 + DC 呈现出兼具浆细胞样 DC(pDC)和经典 DC(cDC)的转录组学及表型谱特征,不过就功能方面而言,其与 cDC2 更为相近。这类 DC 细胞能够有效地对 CD4 T 细胞起到刺激作用,但是并不会分泌 I 型干扰素。
目前,AXL + SIGLEC6 + DC 是否属于真正意义上的 DC 子集,亦或是中间群体,尚有待进一步确认。鉴于它们在培养系统中能够分化为 cDC2,因此人们推测其有可能是 DC 前体,或者说是处于 pDC 和 cDC2 之间的 “过渡” 群体。
此外,AXL + SIGLEC6 + DC 还对参与 pDC 发育过程的转录因子,如 BCL11A、RUNX2 以及 SPIB 有着较高程度的表达。












 危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)
危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)  营业执照(三证合一)
营业执照(三证合一)